Определите какие продукты образуются на катоде

Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
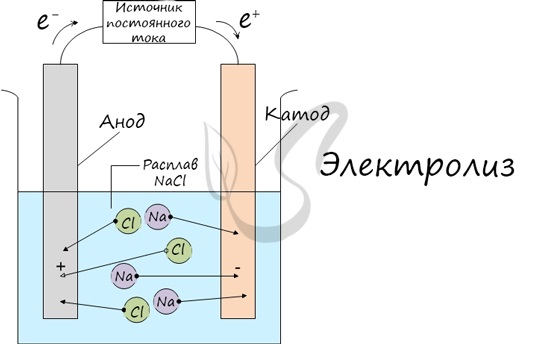
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
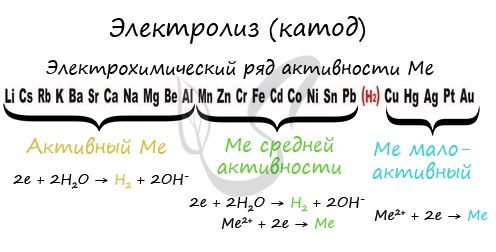
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
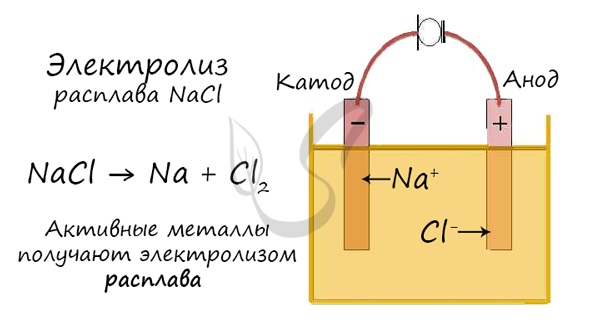
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз – основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H₂O → O₂ + 2H₂
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами или электролиза растворов, в которых содержится несколько растворенных веществ, в ЕГЭ по химии пока нет.
Давайте рассмотрим несколько простых задач на электролиз, а затем перейдем к более сложным.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO₃ + 2H₂O → 4Ag + 4HNO₃ + O₂
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/107 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O₂) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
Объем кислорода:
V(O₂) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO₃) = n(Ag) = 0,02 моль
m(HNO₃) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO₃) = m(HNO₃)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O₂) = 0,112 л, ω(HNO₃) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H₃PO₄) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H₂O → 2KOH + Cl₂ + H₂
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H₃PO₄) = mр-ра(H₃PO₄) ·ω(H₃PO₄) = 50 г · 0,196 = 9,8 г
n(H₃PO₄) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H₃PO₄ + KOH → KH₂PO₄ + H₂O
H₃PO₄ + 2KOH → K₂HPO₄ + 2H₂O
H₃PO₄ + 3KOH → K₃PO₄ + 3H₂O
При соотношении кислоты и щелочи n(H₃PO₄):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K₂HPO₄) = n(H₃PO₄) = 0,1 моль
Ответ: K₂HPO₄
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H₂O → O₂ + 2H₂
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто – за счет электролиза воды. Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,₂(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H₂O) = mр-ра,1(NaOH) – mр-ра,₂ (NaOH) = 525 – 241,5 = 283,5 г
n(H₂O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H₂) = n(H2O) = 15,75 моль
V(H₂) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О₂) = 1/2·n(H2O) = 7,875 моль
V(O₂) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ: V(H₂) = 352,8 л, V(O₂) = 176,4 л
Задачи на электролиз встретились в ЕГЭ по химии в 2018 году. Вот одна из задач реального экзамена по химии:
4. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO₄ + 2H₂O → 2Cu + 2H₂SO₄ + O₂
Находим массу чистого сульфата меди:
m(CuSO₄) = mраствора*ω(CuSO₄) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO₄) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O₂) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O₂) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра₂ равна:
mр-ра₂ = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля.
Найдем массовую долю сульфата меди ω(CuSO₄)₂ и серной кислоты ω(H₂SO₄) в растворе, который остался после электролиза:
m(CuSO₄)ост = n*M = 0,4*160 = 64 г
ω(CuSO₄)₂ = m(CuSO₄)₂/*mр-ра₂ = 64/492 = 0,13 = 13%
ω(H₂SO₄) = m(H₂SO₄)/*mр-ра₂ = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO₄)3 = ω(CuSO₄)₂ *mр-ра3 = 0,13*98,4 = 12,79 г
m(H₂SO₄)₂ = ω(H₂SO₄)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO₄) = m/M = 12,79/160 = 0,08 моль
n(H₂SO₄) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H₂SO₄ + 2NaOH = Na₂SO₄ + 2H₂O
CuSO₄ + 2NaOH = Cu(OH)₂ + 2H₂O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: mр-ра = 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
5. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение и ответ:
Уравнения реакций:
2CuSO₄ + 2H2O = 2Cu↓ + 2H2SO₄ + O2↑ (электролиз)
BaCl₂ + H₂SO₄ = BaSO₄↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO₄) = 640 · 0,15 = 96 г
n(CuSO₄) = 96 / 160 = 0,6 моль
n(O₂) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO₄) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H₂SO₄) = n(CuSO₄) = 0,6 моль
При электролизе сульфата меди может выделится максимальное количество кислорода:
n(O₂ [1]) = 0,5n(CuSO₄) = 0,3 моль
Однако, по условию, на аноде всего выделилось 0,5 моль газа. Следовательно, дальше протекает электролиз воды:
2H₂O → O₂ + 2H₂ (электролиз)
Количество кислорода ,который выделится при электролизе воды:
n(O₂ [2]) = 0,5 – 0,3 = 0,2 моль
Отсюда можно найти массу воды, которая разложилась под действием тока:
n(H₂O прореаг.) = 2n(O₂ [2]) = 0,4 моль
m(H₂O прореаг.) = 0,4 · 18 = 7,2 г
m(O₂ [1]) = 32 · 0,3 = 9,6 г
m(BaCl₂) = 665,6 · 0,25 = 166,4 г
n(BaCl₂) = 166,4 / 208 = 0,8 моль
n(BaCl₂ прореаг.) = n(H₂SO₄) = 0,6 моль
n(BaCl₂ осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl₂ осталось) = 0,2 · 208 = 41,6 г
n(BaSO₄) = n(BaCl₂ прореаг.) = 0,6 моль
m(BaSO₄) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl₂) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl₂) = 3,7 %
Еще больше задач на электролиз вы можете найти в моей статье.
Источник
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H2O → O2 + 2H2
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами или электролиза растворов, в которых содержится несколько растворенных веществ, в ЕГЭ по химии пока нет.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO3 + 2H2O → 4Ag + 4HNO3 + O2
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/108 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O2) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
Объем кислорода:
V(O2) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO3) = n(Ag) = 0,02 моль
m(HNO3) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO3) = m(HNO3)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O2) = 0,112 л, ω(HNO3) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H3PO4) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H2O → 2KOH + Cl2 + H2
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H3PO4) = mр-ра(H3PO4) ·ω(H3PO4) = 50 г · 0,196 = 9,8 г
n(H3PO4) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
H3PO4 + 3KOH → K3PO4 + 3H2O
При соотношении кислоты и щелочи n(H3PO4):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K2HPO4) = n(H3PO4) = 0,1 моль
Ответ: K2HPO4
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H2O → O2 + 2H2
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто — за счет электролиза воды. Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,2(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H2O) = mр-ра,1(NaOH) – mр-ра,2(NaOH) = 525 – 241,5 = 283,5 г
n(H2O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H2) = n(H2O) = 15,75 моль
V(H2) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О2) = 1/2·n(H2O) = 7,875 моль
V(O2) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ: V(H2) = 352,8 л, V(O2) = 176,4 л
4. При электролизе (с инертным анодом) 235 г раствора нитрата меди (II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
5.При электролизе раствора хлорида натрия на катоде выделилось 13,44 л водорода (н.у.). Хлор, выделившийся на аноде, поглотили горячим раствором гидроксида калия. Рассчитайте количества солей – хлорида калия и хлората калия, − образовавшихся в растворе в результате реакции.
6. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора йодида калия. Рассчитайте объём газа (н.у.) и
массовую долю йодида калия в и.
7. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
8. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2= 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Найдем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = n*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO4) = m/M = 12,79/160 = 0,08 моль
n(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: масса раствора 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
9. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида
бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин).
Решение и ответ:
Уравнения реакций:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑ (электролиз)
2H2O = 2H2↑ + O2↑ (электролиз)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO4) = 640 · 0,15 = 96 г n(CuSO4 ) = 96 / 160 = 0,6 моль
n(O2) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO4) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H2SO4) = n(CuSO4 ) = 0,6 моль
n(O2 [1]) = 0,5n(CuSO4) = 0,3 моль
n(O2 [2]) = 0,5 – 0,3 = 0,2 моль
n(H2O прореаг.) = 2n(O2 [2]) = 0,4 моль
m(H2O прореаг.) = 0,4 · 18 = 7,2 г
m(O2 [1]) = 32 · 0,3 = 9,6 г
m(BaCl2) = 665,6 · 0,25 = 166,4 г
n(BaCl2) = 166,4 / 208 = 0,8 моль
n(BaCl2 прореаг.) = n(H2SO4) = 0,6 моль
n(BaCl2 осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl2 осталось) = 0,2 · 208 = 41,6 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,6 моль
m(BaSO4) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl2) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl2) = 3,7 %
10. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и
молярную концентрацию использованного раствора иодида калия.
11. При электролизе 200 г раствора гидроксида натрия с ω(NaОН) = 4% на аноде выделилось 44,8 л (н.у.) кислорода. Какой объём водорода выделился на катоде, и какой стала массовая доля NaOH в растворе после электролиза?
12. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
13. При электролизе (с инертным анодом) 235 г раствора нитрата меди(II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся
растворе.
14. При электролизе 900г 3%-ного раствора нитрата натрия на аноде выделилось 90л (н.у.) кислорода. Определите массовую долю нитрата натрия в растворе после окончания электролиза.
15. Какую массу свинца можно получить при электролизе 200г раствора нитрата свинца с массовой долей 10%?
16. Для нейтрализации кислоты, образовавшейся после электролиза нитрата серебра, потребовалось 145,5мл 10%-ного раствора гидроксида натрия с плотностью 1,1г/мл. Определите массу выделившегося на катоде серебра. Ответ: 43,2г
17. После электролиза 500г водного раствора сульфата меди масса раствора уменьшилась на 8г. Оставшийся раствор нацело прореагировал с 8,96л (н.у.) сероводорода. Определите массовую долю сульфата серебра в исходном растворе и массовые доли веществ, оставшихся в растворе после электролиза.
18. После электролиза с инертными электродами 500г водного раствора сульфата меди с массовой долей 16% масса раствора уменьшилась на 16г. Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
19. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5% масса раствора уменьшилась на 20,22%. Определите массы веществ, выделившихся на электродах, и молярную концентрацию веществ в конечном растворе, если его плотность составила 1,06 мл.
20. В результате электролиза 400мл 20%-ного раствора CuSO4 с плотностью 1,2г/мл на аноде выделилось 4,48л (н.у.) газа. Определите массы веществ, выделившихся на электродах и массовые доли веществ в конечном растворе.
21. После электролиза 200г 2%-ного водного раствора гидроксида натрия массовая доля гидроксида натрия увеличилась на 0,44%. Определите количества веществ, выделившихся на катоде и аноде.
22. При электролизе соли металла, проявляющего в своих соединениях степени окисления +2 и +3, на катоде было получено 2,6 г металла, а на аноде выделился 1,68 л (н.у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу. Ответ: CrCl3
23. 150 г раствора, содержащего 8% сульфата меди (II) и 11,7% хлорида натрия, подвергли электролизу. Электролиз прекратили, когда на катоде выделилось 1,12л (н.у.) водорода. Определите, какие вещества находятся в растворе после электролиза, а также их количество.
24. Раствор, содержащий по 0,2 моль нитрата меди (II), хлорида калия и сульфата рубидия, подвергли электролизу до полного выделения меди. Определите объёмы газов, выделившихся на электродах, и количества веществ в полученном растворе. Какова среда конечного раствора?
25. Раствор, содержащий 0,1моль нитрата ртути (II), 0,3 моль хлорида калия и 0,2моль сульфата натрия подвергли электролизу до полного выделения хлора. Определите объёмы газов, выделившихся на электродах и количества веществ в полученном растворе. Какова среда полученного раствора?
Другие задачи на электролиз:
26. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
27. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
28. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
29. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
30. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
31. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
32. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекрати, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
33. Через 200 г раствора поваренной соли, содержащего 17,55 мас. % NaСl, некоторое время пропускали постоянный ток. Выделилось 3,36 л хлора (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
34. При электролизе 188 г 50 мас. % раствора нитрата меди (II) на катоде выделилось 19,2 г металла. Найти объем газа (н.у.), выделившегося на аноде, и концентрации кислоты и соли в массовых процентах в электролизере.
35. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5 % масса раствора уменьшилась на 10,85 г. Определите количества веществ, выделившихся на электродах и массовые доли веществ в оставшемся растворе.
36. 50 г водного раствора сульфата меди подвергли электролизу, при этом на аноде выделилось 2,8 л газа (н.у.). Определите массовую долю сульфата меди в исходном растворе, если известно, что после электролиза масса раствора составила 42,4 г.
37. Определите состав раствора (в массовых долях), полученного в результате электролиза 100 г раствора сульфата меди, если известно, что во время электролиза на аноде выделилось 2,8 л газа (н.у.), а масса раствора после электролиза составила 92,4 г.
38. 117 г раствора хлорида натрия с массовой долей соли 5 % в течение некоторого времени подвергали электролизу. При этом на электродах выделилось 8,96 л газов (н.у.). Определите состав раствора после электролиза (в массовых долях).
Источник
