Определить к каким электронным семействам они относятся и какие свойства проявляют
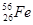
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней:
s- элементы – заполнение внешнего s – подуровня при наличии на предвнешнем уровне двух или восьми электронов, например:
Li 1s22s2
s-элементы являются активными металлами, характерные степени окисления которых численно равны количеству электронов на последнем уровне:
+1 для щелочных металлов и +2 для элементов второй группы
р- элементы – заполнение внешнего p- подуровня, например:
F 1s2 2s22p5
Элементы от В до Ne включительно образуют первую серию p-элементов (элементы главных подгрупп), в атомах которых наиболее удаленные от ядра электроны располагаются на втором подуровне внешнего энергетического уровня.
d- элементы – заполнение предвнешнего d- подуровня, например:
V 1s22s22p63s23p64s23d3
d- элементы относятся к металлам.
f- элементы – заполнение f- подуровня второго снаружи уровня, например:
Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s24f4
f- элементы – это элементы семейств актиноидов и лантаноидов.
Квантовая механика, сравнивая электронные конфигурации атомов приходит к следующим теоретическим выводам:
1. Строение внешней оболочки атома является периодической функцией зарядового числа атома Z.
2. Поскольку химические свойства атома определяются строением внешней оболочки, из предыдущего пункта следует: химические свойства элементов находятся в периодической зависимости от заряда ядра.
Контрольные вопросы
1. Ядерная модель строения атома. Изотопы (радионуклиды).
2. Квантово – механическая модель строения атома.
3. Квантовые числа (главное, орбитальное, магнитное, спиновое).
4. Строение электронных оболочек атомов. Принцип Паули. Принцип наименьшей энергии. Правило Гунда.
5. Электронно-структурные формулы атомов. Гибридизация атомных орбиталей.
6. Характеристики атома. Атомный радиус. Электроотрицательность. Сродство к электрону. Энергия ионизации. S, p, d, f – электронные семейтсва атомов.
Типовые задачи
Задача № 1.Радиусы ионов Na+ и Cu+ одинаковы (0,098 нм). Объяснить различие температур плавления хлорида натрия (801°С) и хлорида меди(I) (430°С).
Решение:
При одинаковых зарядах и размерах ионов Na+ и Cu+ ,ион Cu+ имеет 18 – электронную внешнюю оболочку и более сильно поляризует анион Cl- , чем ион Na+, обладающий электронной структурой благородного газа. Поэтому в хлориде меди(I) в результате поляризации с аниона на катион переносится более значительная часть электронного заряда, чем в хлориде натрия. Эффективные заряды ионов в кристалле CuCl становятся меньше, чем NaCl, а электростатическое взаимодействие между ними – более слабое. Этим объясняется более низкая температура плавления CuCl в сравнении с NaCl, кристаллическая решётка которого близка к чисто ионному типу.
Задача №2. Как обозначается состояние электрона а) с n=4,L=2; б) с n=5,L=3.
Решение: При записи энергетического состояния цифрой указывают номер уровня (n), а буквой – характер подуровня (s, p, d, f). При n=4 и L=2 записываем 4d; при n=5 и L=3 записываем 5f.
Задача № 3. Сколько всего орбиталей соответствует третьему энергетическому уровню? Сколько электронов на этом уровне? На сколько подуровней расщепляется этот уровень?
Решение: Для третьего энергетического уровня n=3, количество атомных орбиталей 9(32), что
является суммой 1(s) +3(p) +5(d)=9. По принципу Паули количество электронов на этом уровне 18. Третий энергетический уровень расщепляется на три подуровня: s,p,d (количество подуровней совпадает с числом значений главного квантового числа).
Задача №4. На какие электронные семейства классифицируются химические элементы?
Решение: Все химические элементы можно классифицировать в зависимости от характера заполняемых подуровней на 4 типа:
s-элементы-заполняют электронами ns подуровень;
p-элементы -заполняют электронами np подуровень;
d-элементы-заполняют электронами (n-1)d подуровень;
f-элементы –заполняют электронами (n-2)f подуровень;
Задача № 5. Какой подуровень заполняется в атоме электронами после заполнения подуровня: а) 4р; б)4s
Решение: А) подуровню 4р отвечает сумма (n+1), равная 4+1=5. Такой же суммой характеризуются подуровни 3d (3+2=5) и 5s (5+0=5). Однако состоянию 3d отвечает меньшее значение n (n=3), чем состоянию 4р, поэтому подуровень 3d будет заполняться раньше, чем подуровень 4р. Следовательно, после заполнения подуровня 4р будет заполняться подуровень 5s, которому отвечает на единицу большее значение n(n=5).
Б) подуровню 4s соответствует сумма n+1=4+0=4. Такой же суммой n+1 характеризуется подуровень 3р, но заполнение этого подуровня предшествует заполнению подуровня 4s, т.к. последнему отвечает большее значение главного квантового числа. Следовательно, после подуровня 4s будет заполняться подуровень с суммой (n+1)=5,причем из всех возможных комбинаций n+l, соответствующих этой сумме(n=3, l=2; n=4; l=1; n=5; l=0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, то есть вслед за подуровнем 4s будет заполняться подуровень 3d.
Вывод: таким образом, заполнение подуровня d отстает на один квантовый уровень, заполнение подуровня f отстает на два квантовых уровня.
Для написания электронной формулы элемента необходимо: арабской цифрой указать номер энергетического уровня, написать буквенное значение подуровня, количество электронов записать в виде показателя степени.
Например: 26Fe4 1s22s22p63s23p64s23d6
Электронная формула составлена с учетом конкуренции подуровней, т.е. правила минимума энергии. Без учета последнего электронная формула будет записываться :26Fe41s22s22p63s23p63d64s2.
Задача № 6. Электронная структура атома описывается формулой 1s22s22p63s23d74s2. Какой это элемент?
Решение: Этот элемент принадлежит к электронному типу d-элементов 4 периода , т.к. происходит застройка электронами 3d подуровня; число электронов 3d 7 свидетельствует о том, что это седьмой элемент по порядку. Общее число электронов 27,значит порядковый номер 27. Этот элемент кобальт.
Тестовые задания
Выберите правильный вариант ответа
01.ЭЛЕКТРОННАЯ ФОРМУЛА ЭЛЕМЕНТА ИМЕЕТ ВИД … 5S24D4. УКАЗАТЬ ЧИСЛО ЭЛЕКТРОНОВ В НАРУЖНОМ УРОВНЕ
1) 1
2) 3
3) 4
4) 6
02. МОГУТ ЛИ СУЩЕСТВОВАТЬ В АТОМЕ ДВА ЭЛЕКТРОНА С ОДИНАКОВЫМ НАБОРОМ ВСЕХ ЧЕТЫРЕХ КВАНТОВЫХ ЧИСЕЛ?
1) не могут
Могут
3) могут только в возбужденном состоянии
4) могут только в нормальном (невозбужденном) состоянии
03. КАКОЙ ПОДУРОВЕНЬ ЗАПОЛНЯЕТСЯ ПОСЛЕ ПОДУРОВНЯ 4D?
1) 4f
2) 5s
3) 5p
4) 6p
04. ЭЛЕКТРОННАЯ ФОРМУЛА ЭЛЕМЕНТА ИМЕЕТ ВИД: 1S22S22P63S2. УКАЗАТЬ ЧИСЛО ВАЛЕНТНЫХ ЭЛЕКТРОНОВ
1) 8
2) 3
3) 5
4) 2
05. ЭЛЕКТРОННАЯ ФОРМУЛА ЭЛЕМЕНТА ИМЕЕТ ВИД: 1S22S22P63S23P64S23D7. КАКОЙ ЭТО ЭЛЕМЕНТ?
1)
2)
3)
4)
06. КАКОЙ ПОДУРОВЕНЬ ЗАПОЛНЯЕТСЯ ПЕРЕД 4D-ПОДУРОВНЕМ?
1) 4f
2) 5s
3) 6s
4) 6p
07. СРЕДИ ПРИВЕДЕННЫХ НИЖЕ ЭЛЕКТРОННЫХ КОНФИГУРАЦИЙ УКАЗАТЬ НЕВОЗМОЖНУЮ
1) 2р3
2) 3р6
3) 2s2
4) 2d2
08. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМА ЭЛЕМЕНТА ВЫРАЖАЕТСЯ ФОРМУЛОЙ: 5S24D3. ОПРЕДЕЛИТЬ КАКОЙ ЭТО ЭЛЕМЕНТ.
1)
2)
3)
4)
09. У КАКОГО ЭЛЕМЕНТА НАЧИНАЕТСЯ ЗАПОЛНЕНИЕ ПОДУРОВНЯ 4D?
1)
2)
3)
4)
10. У КАКОГО ЭЛЕМЕНТА ЗАКАНЧИВАЕТСЯ ЗАПОЛНЕНИЕ ПОДУРОВНЯ 3D?
1)
2)
3)
4)
11. ОПРЕДЕЛИТЕ ЭЛЕКТРОННУЮ ЕМКОСТЬ (ВМЕСТИМОСТЬ) ТРЕТЬЕГО ЭНЕРГЕТИЧЕСКОГО УРОВНЯ
1) 3
2) 18
3) 2
4) 32
12. СКОЛЬКО ЗНАЧЕНИЙ ПРИНИМАЕТ ML ПРИ L =3?
1) 3
2) 6
3) 7
4) 9
13. СКОЛЬКО НЕСПАРЕННЫХ ЭЛЕКТРОНОВ В НЕВОЗБУЖДЕННОМ СОСТОЯНИИ ИМЕЕТ АТОМ ФОСФОРА?
1) 1
2) 2
3) 4
4) 5
14. КАКИЕ ЗНАЧЕНИЯ ПРИНИМАЕТ ПОБОЧНОЕ КВАНТОВОЕ ЧИСЛО (L), ЕСЛИ ЗНАЧЕНИЕ ГЛАВНОГО КВАНТОВОГО ЧИСЛА (N) РАВНО 3?
1) 0,1, 2
2) 1, 2, 3
3) 3, 4, 5
4) 1,3, 5
15. ПРИЗНАКОМ СХОДСТВА ХИМИЧЕСКИХ БИОГЕННЫХ ЭЛЕМЕНТОВ НАТРИЯ И КАЛИЯ ЯВЛЯЕТСЯ ОДИНАКОВОЕ ЧИСЛО
1) электронов внешнего слоя
2) номера группы
3) электронных слоев
4) нейтронов в ядре
Источник
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
1. s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными1 являются электроны внешнего уровня.
2. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
3. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
4. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов. Например:
;
.
Элементы с одинаковым строением внешнего и предвнешнего энергетических уровней называют полными электронными аналогами. Например:
;
.
116 Вертикальное, горизонтальное и диагональное сходство элементов в периодической системе.
Диагональная периодичность
Диагональная периодичность – повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
Диагональную периодичность не следует понимать как абсолютное сходства атомных, молекулярных, термодинамических и других свойств. Та, в своих соединениях атом лития имеет степень окисления (+I), а атом магния – (+II). Однако свойства ионов Li+ и Mg2+ очень близки, проявляясь, в частности, в малой растворимости карбонатов и ортофосфатов.
В результате объединения вертикальной, горизонтальной и диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких “геохимических звезд” можно предсказать присутствие элемента в минералах и рудах.
Горизонтальная аналогия
Некоторые элементы, относящиеся к одному периоду, и, не являющиеся ни типовыми, ни электронными аналогами, тем не менее, обнаруживают значительное сходство друг с другом. Горизонтальная аналогия наблюдается у d- и f-элементов с более чем наполовину заполненными электронными подуровнями. Примером горизонтальных аналогов могут служить железо, кобальт и никель, которые при различных электронных конфигурациях ([Ar]183d64s2, [Ar]183d74s2 и [Ar]183d84s2) обладают определенным сходством.
Существование горизонтальной аналогии объясняется тем, что в рядах d- и f-элементов изменение свойств с увеличением заряда ядра замедляется (вспомним хотя бы то, что все d- и f-элементы являются металлами). Особенно медленно изменяются свойства во второй половине рядов, где в квантовых ячейках подуровней происходит образование электронных пар. С другой стороны, горизонтальными аналогами обычно являются элементы, не реализующие свою высшую степень окисления, отвечающую числу валентных электронов. Так, для железа число валентных электронов равно восьми, для кобальта – девяти, для никеля – десяти. Однако для всех этих элементов наиболее характерны степени окисления +2 и +3; железо может проявлять степень окисления +6, а кобальт и никель – +4: но подобные соединения относительно редки и обычно неустойчивы. В результате для железа, кобальта и никеля формулы основных классов соединений однотипны (например, МеО, Ме2О3, Ме(ОН)2, Ме(ОН)3 и т.д.), а свойства этих соединений, равно как и простых веществ, близки.
Аналогичное явление наблюдается и для платиновых металлов. Триады рутений, родий, палладий и осмий, иридий, платина являются горизонтальными аналогами. В то же время пары рутений-осмий, родий-иридий, палладий-платина относятся к шринк-аналогам. В результате все платиновые металлы близки по свойствам.
В ряду лантаноидов элементы подсемейства церия (Ce-Gd) сильнее отличаются друг от друга по свойствам, чем элементы подсемейства тербия (Tb-Lu); это явление также связано с горизонтальной аналогией.
Дата добавления: 2015-01-29; просмотров: 183; Нарушение авторских прав
Источник
В зависимости от того, какой подуровень
последним заполняется электронами, все
элементы делятся на четыре типа –
электронные семейства:
s
– элементы;
заполняется электронами s
– подуровень внешнего уровня. К ним
относятся первые два элемента каждого
периода. Валентными1являютсяs-электроны
внешнего уровня.p
– элементы;
заполняется электронами р – подуровень
внешнего уровня. Это последние шесть
элементов каждого периода (кроме I
и VII).
Валентными
являются s–
и p–
электроны внешнего уровня.d
– элементы; заполняется
электронами d
– подуровень второго снаружи уровня,
а на внешнем уровне – один или два
электрона (y
46Pd
– нуль). К ним относятся элементы
вставных декад больших периодов,
расположенных между s
– и p
– элементами (их также называют
переходными элементами). Валентными
являются s
– электроны внешнего уровня и d
– электроны предвнешнего уровня
(второго
снаружи).f
– элементы;
заполняется электронами f
– подуровень третьего снаружи уровня,
а на внешнем уровне остается два
электрона. Они расположены в 6 – м (4f
– элементы) и 7 – м (5f
– элементы) периодах периодической
системы. 4f
– элементы объединяют в семейство
лантаноидов, а 5f
– элементы – семейство актиноидов.
В периодической системе s – элементов
14, p – элементов 30, d – элементов 38, f –
элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением
внешнего энергетического уровня носят
название электронных аналогов.Например:
;
.
Элементы с одинаковым строением
внешнего и предвнешнего энергетических
уровней называют полными электронными
аналогами.Например:
;
.
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было
открытие периодического закона, сделанное
в 1869 г. гениальным русским ученым Д.
И. Менделеевым. Периодический закон
в формулировке Д. И. Менделеева гласит:
“ свойства элементов, а потому и свойства
образуемых ими простых и сложных тел,
стоят в периодической зависимости от
их атомного веса”.
Графическим выражением этого закона
стала созданная им периодическая система
элементов.
В настоящее время известно несколько
сотен вариантов периодической системы
элементов, но все они в своей основе
содержат предложенные Менделеевым
принципы её построения. Наибольшее
распространение получили короткая
(восьмиклеточная) и длинная
(тридцатидвухклеточная) формы периодической
система элементов.
Развитие учения о строении атома вскрыло
глубокий физической смысл периодического
закона. Как было доказано, свойства
элементов зависят, прежде всего, от
заряда атомных ядер, который в свою
очередь определяет распределение
электронов на электронных оболочках
атомов. Основной характеристикой атома
является положительный заряд ядра,
численно равный порядковому номеру
элемента. В нейтральном атоме заряд
ядра и общее число электронов равны.
Распределением электронов на электронных
оболочках атомов определяются свойства
элементов и их соединений, положение
элемента в периодической системе.
Периодичность изменения свойств
химических элементов и их соединений
зависит от периодически повторяющейся
сходной структуры электронных оболочек
атомов.
В 1913 г. ученик Резерфорда английский
ученый Мозли, исследуя спектры лучей
Рентгена для различных элементов,
установил простое соотношение между
длиной волны рентгеновских лучей и
порядковым номером элемента (закон
Мозли):
Корень квадратный из величины, обратной
длине волны рентгеновских лучей,
испускаемых атомами различных элементов,
находится в линейной зависимости от
порядкового номера элемента, т. е.
где
– длина волны; Z
– порядковый номер элемента;
– постоянная, одинаковая для всех
элементов.
Из
уравнения следует, что, зная
и измерив ,
можно вычислить порядковый номер
элемента. Это экспериментальный метод
проверки правильности распределения
элементов в периодической системе по
возрастанию заряда ядра. Закон Мозли
показал, что Д.И. Менделеев правильно
расположил элементы в периодической
системе, позволил установить общее
число элементов в каждом периоде, а
главное, направил усилия ученых на
открытие предсказанных им элементов.
Вскоре несколько элементов было открыто
с помощью анализа рентгеновских спектров
(гафний, Z=72;
рений, Z=75
и др.).
Вместе с тем из закона
Мозли следует, что порядковый номер –
это не простая нумерация элементов, а
выражение конкретного внутреннего
свойства атома – величины элементарных
положительных зарядов ядра. Именно
положительный заряд ядра (а не атомная
масса) является главной характеристикой
атома.
В
свете современных представлений о
строении атома изменилась и формулировка
периодического закона: свойства
химических элементов, а также формы и
свойства их соединений находятся в
периодической зависимости от величины
заряда атомных ядер.
Источник
Ковалентность атомов
Химические и многие физические свойства атомов элементов определяются в основном их валентными электронами.
Валентные электроны – это электроны, наименее прочно связанные с ядром и участвующие в образовании ковалентных связей. Их электронная конфигурация зависит от того, к какому семейству (s-, p-, d– или f-) относится данный элемент.
В зависимости от того, какой подуровень заполняется электронами, различают s-, р-, d– и f-семейства (элементы). Если в атоме элементов заполняется электронами s-подуровень последнего энергетического уровня (ns) – это s-элементы. Если ns-подуровень заполнен электронами, а заполняется nр-подуровень – это р-элементы. При размещении электронов на (n–1)d-подуровне при заполненном ns-подуровне – это будут d-элементы. Элементы, в атомах которых заполняется (n–2)f-подуровень, называются f-элементами.
В табл. 2 показаны электронные семейства элементов, соответствующие им валентные электроны и расположение s-, p-, и d-элементов в периодической системе элементов Д.И. Менделеева.
Таблица 2
Электронные семейства элементов и валентные электроны
| Семейство | Валентные электроны | Период | Число элементов в периоде | Группа | Подгруппа |
| s | ns1–2 | 1-7 | 1-2 | главная | |
| p | ns2np1–6 | 2-6 | 3-8 | ||
| d | (n – 1)d1–10ns1–2 | 4-7 | 3-8 1-2 | побочная |
Количество валентных электронов равно номеру группы, в которой расположен элемент (исключение – d-элементы подгрупп Co, Ni, Cu, Zn).
К s-элементам относятся элементы главных подгрупп первой и второй групп (две группы); к р-элементам – главные подгруппы, начиная с третьей и кончая восьмой группой (шесть групп); d-элементы образуют десять побочных подгрупп, начиная с третьей группы четвертого периода; f-элементы – это лантаноиды и актиноиды.
Поэтому в атомах:
– s-элементов число электронов на последнем ns-подуровне соответствует номеру группы, в которой расположен элемент;
– р-элементов сумма электронов на последнем уровне ns-, nр-подуровнях соответствует номеру группы, в которой находится элемент;
– d-элементов сумма электронов на (n–1)d, ns-подуровнях равна номеру группы, в которой расположен элемент. Исключение составляют атомы элементов подгруппы кобальта, никеля, меди и цинка.
При рассмотрении химической связи необходимо знать ковалентность атома элемента. Она определяется числом одиночных валентных электронов. Ковалентность атома можно изменить (повысить) за счёт возбуждения атома, если на данном энергетическом уровне есть свободные орбитали.
Пример 4. Напишите электронную формулу атомов 4Be; 7N; 15P; 22Ti. Определите электронное семейство элемента. Определите ковалентность атомов в нормальном и возможных возбужденных состояниях.
Решение. Бериллий: 4Ве 1s22s2. Данный элемент относится к s-семейству. Валентные электроны 2s2. Распределим их по орбиталям:
нормальное состояние возбужденное состояние
2p 2p
2s hν 2s ¯
¯ ¯
к = 0 к* = 2
В нормальном состоянии ковалентность (к) бериллия – ноль. Поглощая энергию, атом из нормального состояния переходит в возбужденное. При этом происходит переход одного электрона с s-подуровня на свободную орбиталь p-подуровня того же уровня. В возбужденном состоянии ковалентность атома (к*) равна двум.
Азот: 7N 1s22s22р3. Элемент относится к р-семейству. Валентные электроны 2s22р3. Распределим их по орбиталям данного энергетического уровня с учётом правила Гунда:
нормальное состояние
2p
2s ¯ ¯ ¯
¯
к = 3
В нормальном состоянии ковалентность атома азота равна трём. Поглощение энергии не изменяет ковалентность азота, так как на втором энергетическом уровне нет свободных орбиталей. Однако, за счёт электронной пары, расположенной на 2s-подуровне, ковалентность азота может быть равной четырём. Это его максимальная ковалентность.
Фосфор: 15Р 1s22s22р63s23р3. Фосфор относится к р-элементам и его валентные электроны 3s23р3. Распределим валентные электроны по орбиталям данного энергетического уровня с учётом правила Гунда:
нормальное состояние возбужденное состояние
d d
p p ¯
s ¯ ¯ ¯ hν s ¯ ¯ ¯
¯ ¯ к = 3 к* = 5
В нормальном состоянии ковалентность фосфора равна трём. Фосфор – аналог азота. Но в атоме фосфора, в отличие от азота, есть свободные орбитали
d-подуровня. При поглощении энергии один s-электрон переходит на d-орбиталь этого же энергетического уровня. В возбужденном состоянии ковалентность фосфора равна пяти.
Титан. 22Ti 1s22s22р63s23р63d24s2. Титан – элемент d-семейства. Валентные электроны 3d24s2. Распределим их по орбиталям третьего и четвёртого энергетических уровней с учётом правила Гунда:
нормальное состояние возбужденное состояние
4p 4р
4s hν 4s ¯
3d ¯ 3d ¯
¯ ¯ ¯ ¯
к = 2 к* = 4
В нормальном состоянии ковалентность титана равна двум. При поглощении атомом энергии один s-электрон четвёртого энергетического уровня переходит на свободную орбиталь р-подуровня того же уровня. В возбужденном состоянии ковалентность титана равна четырём.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
61. Руководствуясь Периодической системой, определите название химического элемента. В каком периоде, группе и подгруппе находится этот элемент, если его нейтральному атому отвечает следующая электронная формула 1s22s22p63s23p63d104s24p1? К какому семейству относится данный элемент? Какова ковалентность атома в нормальном и возбужденном состояниях? Покажите это, используя квантовые ячейки.
62.Напишите электронную формулу атома элемента с порядковым номером 25. К какому семейству относится данный элемент? Какие электроны являются валентными? Распределите их по квантовым ячейкам и определите ковалентность в возбужденном состоянии.
63.Напишите электронные формулы атомов 42Мо0 и 47Ag0 c учётом «проскока» одного электрона. Распределите валентные электроны по атомным орбиталям (магнитно-квантовым ячейкам). Объясните, почему в данном случае происходит «проскок» электрона.
64.Некоторый элемент имеет валентные электроны 4s24p2. Определите, какой это элемент. Напишите электронную формулу этого элемента. Какова ковалентность атома в нормальном и возбужденном состояниях? Покажите это, используя квантовые ячейки.
65.Для атома некоторого элемента возможны три состояния, записанные в виде электронных формул: 1s22s22p63s23p4; 1s22s22p63s23p33d1; 1s22s22p63s13p33d2. Какой это элемент? Как называются эти состояния? Как перейти от первого состояния ко второму и третьему состояниям? Определите ковалентность атома для каждого состояния.
66. В атоме некоторого элемента заполнены электронами последний и предпоследний энергетические уровни следующим образом: 4s24p64d25s2. Какой это элемент, и к какому семейству он относится? Напишите электронную формулу атома этого элемента и определите ковалентность в возбужденном состоянии, используя квантовые ячейки.
67.Напишите электронную формулу атома элемента с порядковым номером 33. Какой это элемент? Пользуясь правилом Гунда, распределите валентные электроны по квантовым ячейкам. Определите ковалентность атома в нормальном и в возбужденном состояниях?
68.Напишите электронную формулу атома элемента с порядковым номером 8. Какой это элемент? Пользуясь правилом Гунда, распределите валентные электроны по квантовым ячейкам. Какова ковалентность атома в нормальном состоянии? Объясните, можно ли изменить ковалентность атома путем перевода его из нормального состояния в возбужденное.
69.Для атома некоторого элемента возможны четыре состояния, записанные в виде электронных формул: 1s22s22p63s23p5; 1s22s22p63s23p43d1; 1s22s22p63s23p33d2; 1s22s22p63s13p33d3. Какой это элемент? Как называются эти состояния? Как перейти от первого состояния ко второму, третьему и четвертому состояниям? Определите ковалентность атома для каждого состояния.
70. В атоме некоторого элемента заполнен предпоследний энергетический уровень следующим образом: 3s23p63d8. Какой это элемент, и к какому семейству он относится? Напишите электронную формулу атома этого элемента. Пользуясь правилом Гунда, распределите валентные электроны по квантовым ячейкам и определите ковалентность в возбужденном состоянии.
71. Напишите электронную формулу атома элемента с порядковым номером 34. К какому семейству относится данный элемент? Какие электроны являются валентными? Распределите их по квантовым ячейкам и определите ковалентность во всех возможных возбужденных состояниях.
72. Напишите электронные формулы атомов 29Cu0 и 42Мо0 (учесть «проскок» электрона). Распределите валентные электроны по атомным орбиталям (магнитно-квантовым ячейкам). Объясните, почему в данном случае происходит «проскок» электрона.
73.Определите, в каком периоде, группе, подгруппе находится элемент, если электронная конфигурация подуровней, на которых располагаются валентные электроны в его атоме, следующая 4d55s2. Назовите этот элемент. Пользуясь правилом Гунда, распределите валентные электроны по квантовым ячейкам и определите ковалентность в нормальном и возбужденном состояниях.
74. Даны следующие элементы: 20Са, 27Со, 34Se. Исходя из положения элемента в Периодической системе Д.И. Менделеева, определите для каждого из них: а) сколько энергетических уровней занято электронами; б) к какому семейству относится элемент; в) на каких уровнях и подуровнях находятся валентные электроны, запишите их электронную конфигурацию; г) определите ковалентность в нормальном и возбуждённых состояниях.
75. Напишите электронную формулу атома элемента с порядковым номером 35. К какому семейству относится данный элемент? Определите, какие электроны являются валентными. Распределите их по квантовым ячейкам и определите ковалентность в нормальном и во всех возможных возбужденных состояниях.
76. Определите, в каком периоде, группе, подгруппе находится элемент, если его атом имеет следующую конфигурацию внешнего и предвнешнего энергетических уровней: 4s24р64d105s25р4. Назовите этот элемент, распределите валентные электроны по квантовым ячейкам и определите ковалентность в нормальном и во всех возможных возбужденных состояниях.
77. Исходя из положения в Периодической системе Д.И. Менделеева, для элементов 38Sr, 43Tc, 51Sb определите: а) сколько энергетических уровней занято электронами; б) к какому семейству относится элемент; в) на каких уровнях и подуровнях находятся валентные электроны, какова их электронная конфигурация; г) ковалентность атомов в нормальном и возбуждённых состояниях.
78. Напишите электронную формулу атома элемента с порядковым номером 42. К какому семейству относится данный элемент? Определите, какие электроны являются валентными. Распределите их по квантовым ячейкам и определите ковалентность в нормальном и во всех возможных возбужденных состояниях.
79. Определите, в каком периоде, группе, подгруппе находится элемент, если электронная формула атома включает электронную конфигурацию 5d6. Назовите этот элемент. Пользуясь правилом Гунда, распределите валентные электроны по квантовым ячейкам и определите ковалентность в нормальном и во всех возможных возбужденных состояниях.
80. Исходя из положения элемента в Периодической системе Д.И. Менделеева, определите для каждого из элементов 56Ba, 74W, 84Po: а) сколько энергетических уровней занято электронами; б) к какому семейству относится элемент; в) на каких уровнях и подуровнях находятся валентные электроны, какова их электронная конфигурация.
Источник
