Оксид кальция обладает какими свойствами

Оксид кальция — неорганическое соединение с  формулой CaO. В литературе также можно встретить такие его названия, как негашеная известь, окись кальция, жженая известь, кирабит, «кипелка».
формулой CaO. В литературе также можно встретить такие его названия, как негашеная известь, окись кальция, жженая известь, кирабит, «кипелка».
Негашеная известь называется так для отличия от гашеной извести, когда при соединении оксида кальция с водой проходит бурная реакция — известь «гасится» водой. Получается гашеная известь Ca(OH)2, востребованная во многих областях.
Жженой известью реактив называют с отсылкой на способ получения: известь (карбонат кальция CaCO3) обжигают до тех пор, пока она не начинает разлагаться, в результате чего получается жженая известь (окись кальция).
Обычно негашеной или жженой известью называют техническую квалификацию реактива.
Получить окись кальция можно разными методами.
• Промышленный способ описан выше: разложением известняка CaCO3 при нагревании.
• Разложением при нагревании гидроокиси кальция или солей кальция (солей определенных кислот, содержащих кислород). Например, разложением нитрита кальция Ca(NO3)2 получают CaO высокой чистоты.
• Прямым окислением (сжиганием) кальция в воздухе.
Свойства
Реагент представляет собой порошкообразное вещество белого или сероватого цвета без запаха. Структура кристаллов подобна структуре поваренной соли. Реактив гигроскопичен, поглощает из воздуха влагу и углекислый газ. Хорошо растворяется в глицерине, не растворяется в этиловом спирте. В воде не растворяется, а вступает с ней в химическую реакцию. Не горит. Токсичен.
С химической точки зрения очень активное соединение, осно́вный оксид. Реагирует с водой с образованием щелочи Ca(OH)2 и выделением большого количества тепла. В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
Меры предосторожности
Негашеная известь — едкое вещество, которое относится ко 2-му (высокоопасному) классу веществ. Особенно опасно смешивать оксид с водой. Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Опасность представляют известковая пыль, ее пары и аэрозольные частицы. Они попадают в органы дыхания, вызывая раздражение и кашель. При попадании в легкие могут вызвать пневмонию. Проглатывание оксида кальция вызывает ожог пищевода и желудка.
Очень опасен реактив для слизистых носа и особенно глаз. Способен вызвать язвы слизистой носа и даже прободение носовой перегородки.
Пострадавшему от контакта с химикатом обязательно следует вызвать скорую помощь. До приезда скорой нужно хорошо промыть место поражения: кожу, глаза, пищевод.
При работе с оксидом кальция (как на производствах, так и в быту) следует использовать защитную одежду; респиратор; очки; перчатки, стойкие к щелочам. На предприятиях обязательно контролируют ПДК реактива в воздухе. Рабочее место должно располагаться в помещении с общей принудительной вентиляцией. Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.
Хранят реактив в герметичной упаковке  (многослойные ламинированные бумажные мешки), на сухих крытых складах с хорошей механической вентиляцией, при комнатной температуре. Реактив несовместим с водой, фтором, сильными кислотами.
(многослойные ламинированные бумажные мешки), на сухих крытых складах с хорошей механической вентиляцией, при комнатной температуре. Реактив несовместим с водой, фтором, сильными кислотами.
В лабораториях работы следует проводить в вытяжном шкафу. Хранят реактив в герметичных стеклянных или пластиковых сосудах с обязательными предупреждающими этикетками.
Источник
Оксид кальция – это кристаллическое соединение белого цвета. Другие названия этого вещества – негашеная известь, окись кальция, «кирабит», «кипелка». Оксид кальция, формула которого CaO, и его продукт взаимодействия с (H2O) водой – Ca(OH)2 («пушонка», или гашеная известь) нашли широкое применение в строительном деле.
Как получают оксид кальция?
1. Промышленный способ получения данного вещества заключается в термическом (под воздействием температуры) разложении известняка (кальция карбоната):
CaCO3 (известняк) = CaO (кальция оксид) + CO2 (углекислый газ)
2. Также кальция оксид можно получить посредством взаимодействия простых веществ:
2Ca (кальций) + O2 (кислород) = 2CaO (кальция оксид)
3. Третий способ получения оксида кальция заключается в термическом разложении кальция гидроксида (Ca(OH)2) и кальциевых солей нескольких кислородсодержащих кислот:
2Ca(NO3)2 (нитрат кальция) = 2CaO (получаемое вещество) + 4NO2 (оксид азота) + O2 (кислород)
Физические свойства оксида кальция
1. Внешний вид: кристаллическое соединение белого цвета. Кристаллизуется по типу хлорида натрия (NaCl) в кубической кристаллической гранецентрированной решетке.
2. Молярная масса составляет 55,07 грамм/моль.
3. Плотность равна 3,3 грамм/сантиметр³.
Термические свойства оксида кальция
1. Температура плавления равна 2570 градусов
2. Температура кипения составляет 2850 градусов
3. Молярная теплоёмкость (при стандартных условиях) равна 42.06 Дж/(моль·К)
4. Энтальпия образования (при стандартных условиях) составляет -635 кДж/моль
Химические свойства оксида кальция
Оксид кальция (формула CaO) – это основной оксид. Поэтому он может:
– растворяться в воде (H2O) с выделением энергии. При этом образуется гидроксид кальция. Эта реакция выглядит так:
CaO (оксид кальция) + H2O (вода) = Ca(OH)2 (кальциевый гидроксид) + 63,7 кДж/моль;
– реагировать с кислотами и кислотными оксидами. При этом образуются соли. Вот примеры реакций:
CaO (кальциевый оксид) + SO2 (сернистый ангидрид) = CaSO3 (сульфит кальция)
CaO (кальциевый оксид) + 2HCl (соляная кислота) = CaCl2 (кальциевый хлорид) + H2O (вода).
Применение оксида кальция:
1. Основные объемы рассматриваемого нами вещества используются при производстве силикатного кирпича в строительстве. Раньше негашеную известь использовали в качестве известкового цемента. Его получали при ее смешивании с водой (H2O). В результате оксид кальция переходил в гидроксид, который потом, поглощая из атмосферы углекислый газ (CO2), сильно твердел, превращаясь в кальция карбонат (CaCO3). Несмотря на дешевизну этого метода, в настоящее время цемент известковый практически не применяется в строительстве, так как он обладает способностью хорошо впитывать и накапливать в себе жидкость.
2. В качестве огнеупорного материала оксид кальция подходит как недорогой и доступный материал. Плавленый кальциевый оксид имеет устойчивость к воздействию воды (H2O), что позволило его применять в качестве огнеупора там, где использование дорогостоящих материалов нецелесообразно.
3. В лабораториях используют высший оксид кальция для сушения тех веществ, которые с ним не реагируют.
4. В пищевой отрасли данное вещество зарегистрировано в качестве пищевой добавки под обозначением Е 529. Используется в качестве эмульгатора для создания однородной смеси из несмешиваемых между собой веществ – воды, масла и жира.
5. В промышленности кальциевый оксид используют для удаления сернистого ангидрида (SO2) из дымовых газов. Применяют, как правило, 15% раствор водяной. В результате реакции, в которой взаимодействуют гашеная известь и диоксид серы, получается гипс CaCO4 и CaCO3. При проведении экспериментов ученые добивались показателя в 98% отчистки дыма от диоксида серы.
6. Используется в специальной «самогреющейся» посуде. Емкость с небольшим количеством кальциевого оксида располагается между двух стенок сосуда. При прокалывании капсулы в воде начинается реакция с выделением некоторого количества тепла.
Источник
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.

Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
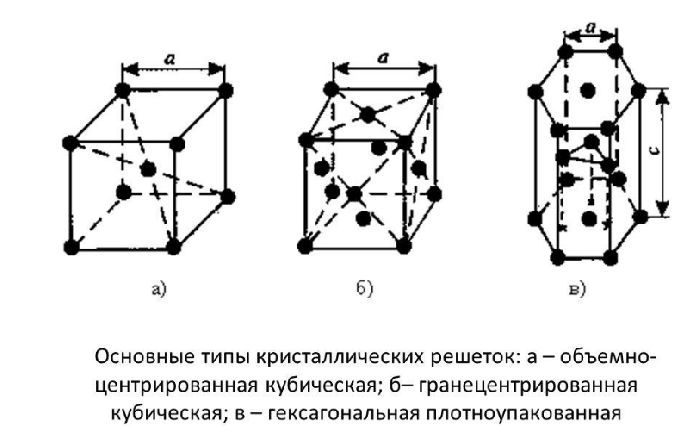
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
Признак | Значение |
Формула соединения оксид кальция | CaO |
Температура плавления | 2627°C |
Температура кипения | 2850°C |
Растворимость | В глицерине. В этаноле не растворяется, с водой образует гидроксид |
Молярная масса | 56,077 г/моль |
Плотность | 3,37 г/см3 |
Химическая связь в кристалле | Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.

Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
2Ca + O2 → 2CaO;
- при термической обработке гидроксида или солей кальция –
Ca(OH)2 → CaO + H2O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции | Что образуется | Молекулярное уравнение |
С водой | Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла | CaO + H2O → Ca(OH)2 |
С кислотами | Растворяется, образуя соли | CaO + 2HCl → CaCl2 +H2O |
С оксидами неметаллов (кислотными остатками) | Образуются соли | CaO + SO2 → CaSO3 |
С углеродом при нагревании | Образуется карбид кальция | CaO + 3С → СаС2 + CO |
С алюминием | Восстанавливает кальций. Образуется оксид алюминия | 3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.

Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 81.
Источник
Оксид кальция (пищевая добавка Е529) — химическое вещество с формулой CaO. Внешне выглядит как твёрдые белые или серовато-белые гигроскопичные массы, зерна или порошок без запаха. Температура плавления 2630 °C, с водой энергично образует гашёную известь Ca(OH)2; растворим в глицерине; нерастворим в этаноле.
Вещество в большом количестве встречающееся в земной коре и широко используемое в промышленности.
Пищевая добавка Е529 относится к улучшителям муки и хлеба синтетического происхождения, используется в технологических целях в процессе производства пищевых продуктов.
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
CaCO3 → CaO + CO2
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
2Ca + O2 → 2CaO
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
2Ca(NO3)2 → 2CaO + 4NO2 + O2
Применение
Пищевая добавка
Катализатор гидролиза жиров — процесс идёт под давлением 0,6–0,8 МПа в присутствии катализатора (0,1–0,3 % от массы жира). Используется в качестве катализатора переэтерификации глицерином рафинированных жиров, а также саломасов из хлопкового или подсолнечного масла; расход катализатора — 0,3 % от массы жира, температура процесса 210–220 °C. Является питательной средой для дрожжей, поэтому входит в состав некоторых комплексных хлебопекарных улучшителей.
Другие сферы применения
В настоящее время в основном используются в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и тд.
До второй половины ⅩⅩ века известь широко использовали в качестве строительной побелки — прокалённый мел или известняк (оксид кальция) при смешивании с водой образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция. В настоящее время известковый цемент при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени), уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешёвый и эффективный агент для осушения растворителей и жидких веществ.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести Ca(OH)2 и диоксида серы получается осадок сульфита кальция CaSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещённый между двух стенок ёмкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Польза и вред
Научные данные о пользе применения пищевой добавки Е529 для здоровья человека в настоящий момент отсутствуют.
В производстве, при работе с оксидом кальция, необходимо соблюдать меры, предусмотренные техникой безопасности (носить защитные перчатки и очки).
Оксид кальция относится к высокотоксическим веществам (класс опасности 2). Это едкое вещество, особенно опасен при смешивании с водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Действие CaO, подобно действию щелочи, состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути. Вдыхание известковой пыли может вызвать воспаление лёгких.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и хорошо контролируемых исследований о возможности применения оксида кальция у беременных женщин не проведено.
Применение в период грудного вскармливания
Специальных исследований о возможности применения оксида кальция в период грудного вскармливания не проведено.
Особые указания
В Российской Федерации, Евросоюзе пищевая добавка Е529 разрешена для применения в пищевой промышленности. Не входит в перечень разрешённых на Украине.
Гигиенические нормы
Опасности по ГН-98: ПДК в воздухе рабочей зоны 1 мг/м3, класс опасности 2. Предупреждение: при добавлении воды следует защищать глаза.
В Российской Федерации разрешён в качестве улучшителя муки и хлеба в пищевые продукты согласно ТИ в количестве согласно ТИ (п. п. 3.2.15,3.7.7 СанПиН 2.3.2.1293-03); в качестве осветляющего, фильтрующего материала, флокулянта и сорбента в сахарной промышленности, максимальное остаточное количество согласно ТИ (п. 5.1.23 СанПиН 2.3.2.1293-03); в качестве катализатора гидрогенизации пищевых масел, максимальное остаточное количество меньше 0,1 мг/кг (п. 5.2.15 СанПиН 2.3.2.1293-03).
Классификация
Категория при беременности по FDA
N (не классифицировано FDA)
Источник
25.02.2020
Оксид кальция находит столь широкое применение,
 что этому посвящена отдельная статья. В ней приведены лишь основные сферы использования реактива, и даже их около 20.
что этому посвящена отдельная статья. В ней приведены лишь основные сферы использования реактива, и даже их около 20.• В строительной отрасли для изготовления стройматериалов (высокоглиноземистый цемент, силикатный кирпич, гипс, сухие смеси для отделочных работ, вяжущие материалы для бетонов). Для проведения кладочных работ. Иногда используется как простой и доступный источник ацетилена для сварочных работ.
• Переплавляя оксид кальция, получают недорогие водостойкие огнеупоры.
• В химпроме для получения различных производных кальция, стеарата кальция, хлорной извести, соды, гидроокиси кальция, карбида; для производства эбонита; в качестве катализатора в органических синтезах.
• В сельском хозяйстве для снижения кислотности почв. Применяется для получения средств борьбы с вредителями сельскохозяйственных культур (например, для изготовления бордосской жидкости).• В пищепроме — разрешенная в РФ пищевая добавка Е529 (регулятор кислотности для хлебобулочных и кондитерских изделий; эмульгатор для соединения жиров с водой). Применяется для улучшения качества муки для хлебобулочного производства, входит в состав хлебопекарских смесей-улучшителей. Питательная среда для выращивания дрожжей. Оксид кальция применяется в пищевой индустрии в строго контролируемых, безопасных количествах.
• Востребован на сахарных заводах как флокулянт и сорбент, фильтрующий материал, осветлитель.
• На предприятиях по производству пищевых масел используется как катализатор реакции гидрогенизации жиров. Эта процедура улучшает свойства масел, увеличивает их стойкость к окислению и температурным воздействиям.
• Используется для очистки воды на заводах, производящих алкогольные напитки.
• Для очистки поваренной соли для пищевых и фармацевтических производств от карбонатов кальция и магния.
• В лабораторной практике используется для осушения жидких реактивов и материалов, с которыми он не вступает в реакцию. Может применяться в хлоркальциевых трубках для удаления влаги и углекислоты из поступающего воздуха. Как лабораторный источник ацетилена (из окиси кальция получают карбид, из карбида ацетилен).
• В кожевенном деле для нейтрализации лишней кислоты.
• В текстильпроме — при печати рисунков на ситцевых тканях.
• В нефтеперерабатывающей отрасли применяется в качестве добавок в моторные масла (фенатные, сульфатные, алкилсалицилатные). Для производства солидола.
• В металлургии — при изготовлении тормозных колодок; в качестве флюса.
• На промышленных производствах — для удаления двуокиси серы из дымовых газов.
• В водоподготовке для бытовых и технических нужд — для умягчения воды, удаления из нее солей кальция и магния (солей жесткости).
• Для обработки сточных и технических вод, для удаления из них кислых компонентов.
• Для нейтрализации проливов кислот и любых кислых сред.
• В саморазогревающей посуде. Герметичный контейнер с реактивом помещают в воду между двойными стенками посуды. При прокалывании контейнера с оксидом кальция начинается экзотермическая реакция, разогревающая содержимое посуды.
Источник
