Образование каких продуктов определяет направление реакций
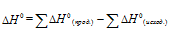
Согласно спецификации в 24 задании проверяют Ваши знания: обратимых и необратимых химических реакций, химическое равновесие, смещение равновесия под действием различных факторов.
Давайте разберем эту тему по пунктам.
Сначала, приведу определения обратимой и необратимой реакций.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Условия необратимости реакции:
- образование осадка: BaCl2 + H2SO4 = BaSO4↓ + 2HCl
- выделение газа: K2S + 2HCl = 2KCl + H2S↑
- образование слабого электролита: HCl + NaOH = NaCl + H2O.
Обратимой называется реакция самопроизвольно протекающая как в
прямом, так и в обратном направлении.
Некоторые обратимые реакции:
N2 + 3H2 ⇄ 2NH3
NH4Cl(тв) ⇄ NH3(г) + HCl(г)
СН3СООН ⇄ СН3СОО(-) + Н(+)
Исходя из определения обратимой реакции, можем представить себе, что начиная с какого-то момента, параллельно проходят обе реакции, как прямая, так обратная. Образующиеся в результате прямой реакции продукты реагируют между собой, превращаясь в исходные вещества, а исходные, в свою очередь, продолжают реагировать с образованием продуктов реакции. Понятно, что на начальном этапе скорость прямой реакции значительно больше скорости обратной, только по тому, что концентрации исходных веществ несоизмеримо больше концентраций продуктов реакции. Но, через некоторое время, концентрации продуктов увеличиваются, и скорость их взаимодействия между собой также увеличивается, а концентрации исходных веществ – уменьшаются, как и скорость их взаимодействия. В некоторый момент скорости прямой и обратной реакции уравниваются V(пр.) = V(обр.) (на рисунке, линии, описывающие скорость прямой и обратной реакции, сливаются в одну) и система приходит к состоянию химического равновесия. То есть, к состоянию с минимумом энергии в котором система может находиться неограниченно долгое время.
Химическое равновесие – состояние системы, в котором скорость прямой реакции равна скорости обратной.
О том, что система достигла состояния химического равновесия можно судить по тому, что концентрации всех веществ, участвующих в процессе, на протяжении достаточно долгого времени будут постоянны (не равны между собой, но постоянны во времени), как это видно на рисунке. Такие концентрации называются равновесными.
Для смещения равновесия, например для получения большего количества продуктов реакции, нужно целенаправленно повлиять на систему.
О влиянии на равновесную систему внешних факторов: температуры, давления, концентрации веществ говорит принцип Ле-Шателье (принцип “наоборот”):
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие.
Разберем влияние каждого из факторов.
Изменение температуры
Повышение температуры смещает равновесие в сторону эндотермической реакции (реакции проходящей с поглощением теплоты):
Понижение температуры смещает равновесие в сторону экзотермической реакции (реакции проходящей с выделением теплоты):
Изменение давления
Повышение давления смещает равновесие в сторону меньшего количества моль газа:
Понижение давления смещает равновесие в сторону большего количества моль газообразных веществ:
Изменение концентрации
Увеличение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к уменьшению их концентраций:
где С – концентрация вещества.
Уменьшение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к увеличению их концентраций:
Хочу отметить, что ни добавление твердых веществ, ни их измельчение не приводит к смещению равновесия, так как равновесная реакция проходит на границе раздела фаз (твердое-газ, твердое- жидкость) и увеличивая поверность раздела фаз мы ускоряем как прямую, так и обратную реакции.
Влияние других веществ, не участвующих в реакции
- Прибавление веществ не участвующих в реакции, но взаимодействующих с реагентами или продуктами реакции:
Для реакции:
добавление Н2SO4(конц.) (сильное водоотнимающее средство) снижает концентрацию Н2О(ж). Равновесие смещается вправо.
Добавление NaOH снижает концентрацию CH3COOH(ж), так как образуется соль – ацетат натрия. Равновесие смещается влево.
- Прибавление веществ, несущих одноименный ион.
Для реакции:
добавление НCl увеличивает концентрацию ионов H(+). Равновесие
смещается влево.
- Разбавление.
Разбавление усиливает диссоциацию слабых электролитов (закон разбавления Оствальда).
Ниже приведен график зависимости степени диссоциации слабого электролита от его концентрации.
Зависимость степени диссоциации слабого электролита от концентрации.
Как видно из графика, с увеличением концентрации степень диссоциации уменьшается и наоборот с уменьшением концентрации, разбавлением – степень диссоциации увеличивается.
Рассмотрим это на примере уксусной кислоты:
для уксусной кислоты концентрацией 0,1 моль/л – степень диссоциации составляет 1,42%, а при разведении ее в 10 раз до концентарции 0,01 моль/л – степень диссоциации уже увеличится до 4,2%.
- Добавление инертного газа к газовой смеси
Здесь инертным можно считать любой газ, не реагирующий с веществами входящими в уравнение реакции.
- При условии сохранения постоянного объема (V – const) – равновесие не смещается, так как не изменяются концентрации газообразных веществ.
- При условии постоянного давления (Р -const) увеличивается объем смеси, что равносильно уменьшению давления в системеи смещению равновесия в сторону образования большего числа моль газа.
Добавление катализатора (ингибитора)
Катализаторы (ингибиторы) не приводят к смещению равновесия, а только ускоряют (замедляют) достижение состояния равновесия.
А теперь давайте рассмотрим некоторые примеры тестовых заданий:
А – повышение давления смещает равновесие в сторону образования меньшего количества моль газов. Смотрим на уравнение реакции и видим, что у нас слева 3 моль газа (Н2) и справа 3 моль газа (Н2О (г)), поэтому равновесие практические не смещается. (ответ 3)
Б – добавление катализатора не смещает равновесие. (ответ 3)
В – увеличение концентрации паров воды приводит к увеличению концентрации одного из продуктов, поэтому равновесие сместиться в сторону их расходования, то есть в сторону обратной реакции. ( ответ 2)
Г – измельчение железа, твердого вещества – не смещает равновесие. (ответ 3)
Другой пример:
А – повышение давления не влияет на смещение равновесия в растворе. (ответ 3).
Б – добавление твердого гидроксида натрия в раствор приведет к его растворению. В растворе гидроксид натрия прореагирует с соляной кислотой. Таким образом равновесие сместится в сторону прямой реакции, так как уменьшается концентрация одного из продуктов реакции. (ответ 1)
В – увеличение температуры приводит к усилению гидролиза. (ответ 1)
Для реакций гидролиза тепловой эффект реакции могут не указывать, но Вы должны помнить, что гидролиз это эндотермический процесс.
Г – разбавление или увеличение концентрации воды приводит к смещению равновесия в сторону прямой реакции. ( ответ 1)
Третий и последний пример:
А – введение инертного газа при постоянном объеме не влияет на смещение равновесия. (ответ 3)
Б – уменьшение концентрации бутадиенасмещаетравновесие в сторону прямой реакции, так как уменьшается концентрация одного из продуктов. (ответ 1)
В – увеличение температуры приводит к смещению равновесия в сторону эндотермической реакции, то есть в сторону прямой реакции. (ответ 1)
Г – понижение давления смещает равновесие в сторону образования большего числа моль газа, то есть в сторону прямой реакции, в ходе которой образуется 3 моль газа. ( ответ 1)
А вот некоторые задания для самостоятельного решения:
Успехов в изучении химического равновесия!
Источник
Движущие силы химической реакции обусловлены ее стремлением к уменьшению запаса энергии, т.е. к уменьшению энтальпии при p = const и ее стремлением к увеличению энтропии.
В ходе химической реакции участвующие частицы перегруппировываются таким образом, чтобы уменьшалась энергия системы; это проявляется в их сближении и взаимодействии. Вместе с тем реагирующие частицы обладают отчетливой тенденцией к беспорядочному расположению. Эти два фактора обусловливают химическую обратимость реакций; преобладающее направление реакции определяется значением и знаком величин ΔH иΔS.
критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: ΔG < 0
Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH – TΔS при ΔS > 0вычитаемое будет всегда отрицательным, а при ΔS < 0 – положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH.
Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в заданном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение энтальпии реакции.
Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG.
По значению стандартной энергии Гиббса реакции можно рассчитать значение константы равновесия K и сделать вывод о положении равновесия. Для рассчета энергии Гиббса реакции необходимо использовать выражение:
ΔG° = -RTlnK = -RT·2.3lgK
где R – универсальная газовая постоянная: 8.31441 Дж/(моль·K).
Для обратимых реакций можно найти такое значение температуры, при которой K = 1 и ΔG° = 0. При этой температуре (она обозначается так:T↔) протекание прямой и обратной реакции равновероятно; эта температура называется температурой равновесия протекания реакции.
Между энергией Гиббса реакции и константой равновесия существует соответствие:
| ΔGT > 0 K < 1 |
| ΔGT = 0 K = 1 |
| ΔGT < 0 K > 1 |
Таким образом, преобладающее направление протекания обратимой реакции определяется знаком энергии Гиббса; практически важное прямое направление реакции, т.е. сдвиг равновесия в сторону образования продуктов преобладает при условии ΔGT << 0 K >> 1.
Для кислотно-основных реакций, протекающих в водном растворе, величина ΔG°T определяется выражением:
ΔG°T = 2,3RT(pKkI – pKkII)
где pKkI = -lgKkI и pKkII = -lgKkII; KkI – константа кислотности реагента – кислоты (справочное значение), KkII – константа кислотности реагента – основания (справочное значение).
Для окислительно-восстановительных реакций, протекающих в водном растворе, величины ΔG°T рассчитывают по соотношению:
где
ze – число электронов, переданное от восстановителя к окислителю в реакции;
E°Ox – стандартный потенциал окислителя (справочная величина);
E°Red – стандартный потенциал восстановителя (справочная величина);
F – постоянная Фарадея (96485 Кл).
4-вопрос) Скорость химической реакции. Факторы, влияющие на скорость реакции. Приведите примеры.
Скорость реакции определяется изменением молярной концентрации одного из
реагирующих веществ:
V = ± ((С2 – С1) / (t2 – t1)) = ± (DС / Dt)
где С1 и С2 – молярные концентрации веществ в моменты
времени t1 и t2 соответственно (знак (+) – если скорость
определяется по продукту реакции, знак (–) – по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость
определяется количеством столкновений и вероятностью того, что они приведут к
превращению. Число столкновений определяется концентрациями реагирующих
веществ, а вероятность реакции – энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических
связей и строение молекул реагентов. Реакции протекают в направлении разрушения
менее прочных связей и образования веществ с более прочными связями. Так, для
разрыва связей в молекулах H2 и N2 требуются высокие
энергии; такие молекулы мало реакционноспособны. Для разрыва связей в
сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и
скорость реакции значительно выше. Реакции между ионами в растворах
электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с
водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид
меди – не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема)
чаще происходят столкновения молекул реагирующих веществ – скорость реакции
возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций
реагирующих веществ.
aA + bB + . . . ® . . .
V = k • [A]a • [B]b • . . .
Константа скорости реакции k зависит от природы реагирующих веществ,
температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости
реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости
реакции не входит.
3. C скорость°Температура. При повышении температуры на каждые 10
реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры
от t1 до t2 изменение скорости реакции можно рассчитать
по формуле:
| (t2 – t1) / 10 | ||
| Vt2 / Vt1 | = g |
(где Vt2 и Vt1 – скорости реакции при температурах t2
и t1 – температурный коэффициент даннойgсоответственно;
реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более
точным является уравнение Аррениуса:
k = A • e –Ea/RT
где
A – постоянная, зависящая от природы реагирующих веществ;
R – универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л •
атм/(моль • К)];
Ea – энергия активации, т.е. энергия, которой должны обладать сталкивающиеся
молекулы, чтобы столкновение привело к химическому превращению.
Энергетическая диаграмма химической реакции.
А – реагенты, В – активированный комплекс (переходное состояние), С – продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при
увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных
систем (когда вещества находятся в разных агрегатных состояниях), чем больше
поверхность соприкосновения, тем быстрее протекает реакция. Поверхность
твердых веществ может быть увеличена путем их измельчения, а для растворимых
веществ – путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее
скорость, оставаясь к концу реакции неизменными, называются катализаторами
. Механизм действия катализаторов связан с уменьшением энергии активации реакции
за счет образования промежуточных соединений. При гомогенном катализе
реагенты и катализатор составляют одну фазу (находятся в одном агрегатном
состоянии), при гетерогенном катализе – разные фазы (находятся в
различных агрегатных состояниях). Резко замедлить протекание нежелательных
химических процессов в ряде случаев можно добавляя в реакционную среду
ингибиторы (явление “отрицательного катализа”).
5-вопрос) Основные типы химических связей. Приведите примеры соединений с различными типами связей.
Источник
Температура наступления равновесия системы
Задача 10.
Термохимическое уравнение реакции: СО(г) + 2H2(г) = CH3OH(ж) + 128 кДж.
Вычислите, при какой температуре наступает равновесие в этой системе?
Решение:
Так как при реакции выделяется тепло, то это экзотермическая реакция. При экзотермических реакциях энтальпия системы уменьшается и ∆H < 0 (Н2 < H1). Тепловые эффекты выражаются через ∆H.
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Энтропия S, так же как энтальпия Н, является свойством вещества, пропорциональным его количеству. Энтропия является функцией состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса:
∆Sх.р. = ∆S0прод. – ∆S0исх.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка (– Т∆S). При Р = const и Т = const общую движущую силу процесса, которую обозначают ∆G, можно найти из соотношения:
∆G = (Н2 – H1) – (TS2 – TS1); ∆G = ∆H – T∆S.
Химическое равновесие – состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
В состояния равновесия:
∆G = 0 и ∆H = T∆S.
Находим ∆S. для данной системы:
S0(СО) = 197,55·10-3 кДж/моль·К;
S0(Н2) = 130,52·10-3 кДж/моль·К;
S0(СН3ОН) = 126,78·10-3 кДж/моль·К;
∆Sх.р. = 126,78·10-3-(197,55·10-3) + (2·130,52·10-3) = -331,81·10-3.
Из условия равновесия :
∆H = T∆S находим Т = ∆H/∆S.
Т = (-128 кДж/моль)/(-331,81·10-3 кДж/моль·К) = 385,7 K.
Ответ: при 385,7 K наступит равновесие в системе.
Определение направления протекания реакции
Задача 11.
Определить направление протекания реакции:
СН4(г) + СО2(г) ⇔ 2СО(г) + 2Н2(г) при стандартных условиях. Вычислить ∆G0298
Решение:
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования ∆Hобр продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов:
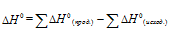
∆Нх.р. = [2∆Н(СО(г)] + [2∆Н(Н2(г)] – [∆Н(СН4(г)]+ [∆Н(СО2(г)]
т.к. ∆Н для простых веществ равна 0, то выражение принимает вид:
∆Нх.р. = [2∆Н(СО(г)] – [∆Н(СН4(г)]- [∆Н(СО2(г)]
∆Нх.р. = 2(-110,53)-(-74,85)-(-393,51) = 247,3 кДж/моль.
Энтропия – функция состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2)состояния и не зависит от пути процесса:
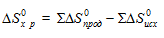
∆Sх.р. = [2∆S(СО(г)] + [2∆S(Н2(г)] – [∆S(СН4(г)] + [∆S(СО2(г)] =
= 2(197,55) + 2(130,52) – 186,27 – 213,66 = 256,26·10-3 кДж/моль·К.
∆G, можно найти из соотношения:
∆G = ∆H – T∆S.
Необходимо рассчитать возможность самопроизвольного протекания реакции при стандартных условиях (Т = 298 K), получим:
∆G = 247,3 – (298·256,26·10-3) = +170,9 кДж.
Ответ: ∆G = +170,9 кДж. Так как ∆G > 0, следовательно, при стандартных условиях невозможно протекание прямой реакции. Реакция может протекать в обратном направлении.
Источник
