Объясните на примере этана какие продукты образуются при хлорировании

Опубликовано 9 месяцев назад по предмету
Химия
от kima79
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
![]()
Математика – 5 месяцев назад
Сколько здесь прямоугольников
![]()
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
![]()
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
![]()
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
![]()
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
![]()
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
![]()
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 1921946
более месяца назад
Просмотров : 56
Ответов : 1
Лучший ответ:

а) хлорировании;
CH4 Cl2 = CH3Cl HCl
хлорметан
б) нитровании;
CH4 HNO3 = CH3NO2 H2O
нитрометан
в) окислении алканов.
горение – частный случай реакции окисления
CH4 2O2= CO2 2H2O
диоксид углерода и вода
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи:































Другие вопросы:
Что могу рассказать о себе знаки препинания
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов : 1
подчеркните красной линеей структуры ,которые находятся в ядре
более месяца назад
Смотреть ответ
Просмотров : 5
Ответов : 1
В вазе лежат фрукты.Лимонов и апельсинов в ней – 3, а апельсинов и мандаринов – 5. Сколько лимонов, апельсинов и мандаринов в вазе? Сколько решений имеет задача?
более месяца назад
Смотреть ответ
Просмотров : 14
Ответов : 1
1.Упростите выражения:а)8y-(2x 5y) (x-y)б)-7a-(5a-(3a-9))
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
По периодической системе найдите и назовите элементы, у которых значения относительных атомных масс: a)больше в 2 раза, б)больше в 3 раза
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Источник
Химические свойства, получение и применение алканов
Существует огромное число различных алканов. Их многообразие объясняется как возможностью образования углеродных цепей различной длины, так и изомерией. В связи с этим изучать химические свойства каждого алкана отдельно не представляется возможным. В то же время молекулы различных алканов имеют сходное строение: атомы углерода соединены между собой и атомами водорода одинарными ковалентными связями. Учитывая это, можно ожидать, что химические свойства различных алканов будут во многом сходными.
Все алканы характеризуются низкой химической активностью. Они не взаимодействуют с растворами кислот, оснований, солей. На них не действует такой сильный окислитель, как KMnO4, и такие сильные восстановители, как щелочные металлы. Вы знаете, что щелочные металлы очень активны и реагируют практически со всеми веществами, с которыми соприкасаются, в том числе легко окисляются кислородом воздуха. Чтобы уберечь щелочные металлы от окисления, их хранят под слоем керосина — смеси, состоящей в основном из насыщенных углеводородов. При этом алканы, входящие в состав керосина, не реагируют со щелочными металлами.
Из-за низкой химической активности алканов реакции с их участием протекают в жёстких условиях (при нагревании или облучении ультрафиолетовым излучением).
Мы изучим реакции алканов с галогенами (Cl2 и Br2) и кислородом (O2), а также превращения, которые они претерпевают при нагревании.
1. Галогенирование. Взаимодействие с галогенами
Взаимодействие алканов с галогенами — хлором и бромом — протекает при нагревании или облучении ультрафиолетовым излучением.
Если смесью газообразных метана и хлора заполнить стеклянный сосуд и поместить его в тёмное место, реакция протекать не будет. Однако при нагревании смеси или облучении её ультрафиолетовым излучением протекает химическая реакция замещения атомов водорода в молекуле метана на атомы хлора:
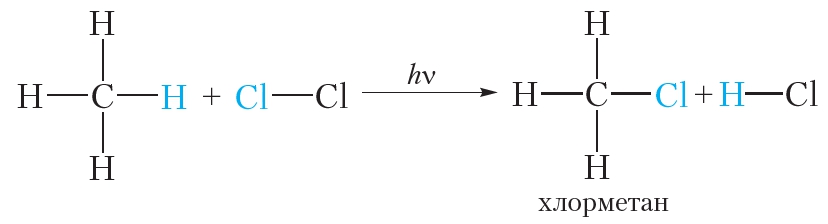
В уравнениях реакций, протекающих при облучении, над стрелкой записывают буквы hv. Данная реакция называется реакцией галогенирования и относится к реакциям замещения.
Если только один атом водорода в молекуле замещается на атом галогена, то реакцию называют моногалогенированием. Приведённая выше реакция является реакцией монохлорирования метана. В избытке хлора оставшиеся три атома водорода молекулы метана могут последовательно замещаться на галоген:
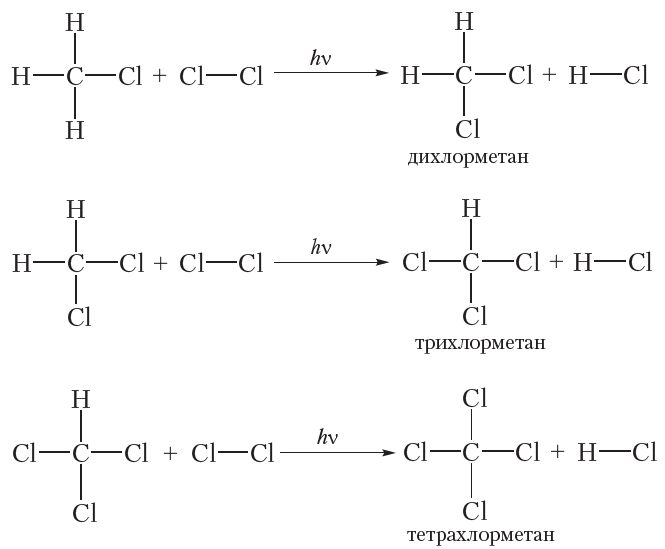
Приведём уравнения реакций всех четырёх стадий хлорирования метана с использованием молекулярных формул:
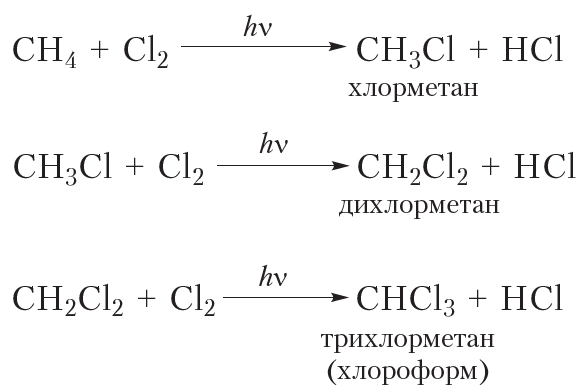
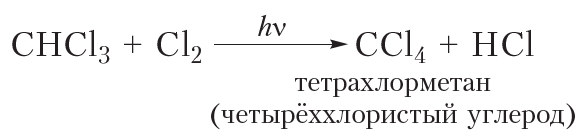
Рассмотрим реакции монохлорирования гомологов метана.
Монохлорирование этана
Для этана уравнение реакции следующее:
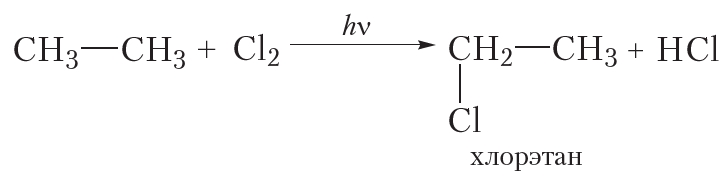
Отметим, что в названии «хлорэтан» нет необходимости указывать цифрой положение атома хлора. Это связано с тем, что при замещении любого атома водорода в молекуле этана на атом хлора образуется одно и то же вещество:

Таким образом, при монохлорировании этана так же, как и в случае метана, получается только одно органическое вещество — хлорэтан.
Монохлорирование пропана
При монохлорировании пропана образуется смесь двух органических веществ:
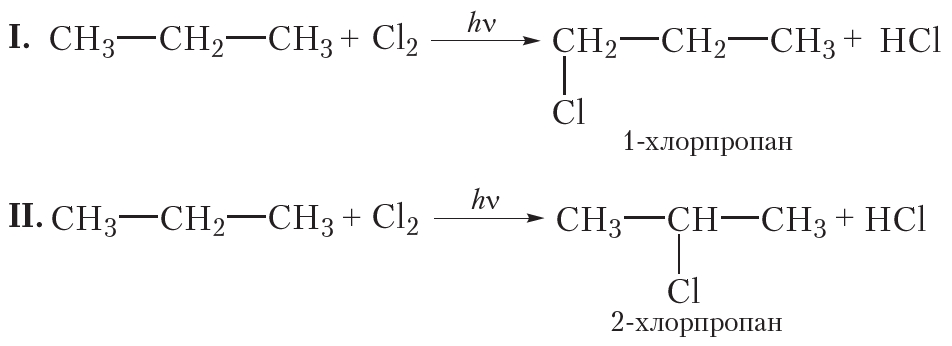
В случае I происходит замещение на галоген атома водорода при первоматоме углерода, продукт реакции 1-хлорпропан. В случае II замещается атом водорода при втором атоме углерода, продуктом реакции является 2-хлорпропан. Обратите внимание на то, что при построении названий нумерацию атомов углерода начинают с того конца углеродной цепи, к которому ближе расположен атом хлора.
В результате реакции монохлорирования пропана образуются два продукта: 1-хлорпропан и 2-хлорпропан, имеющие одинаковые молекулярные формулы C3H7Cl. Это неудивительно, ведь 1-хлорпропан и 2-хлорпропан — изомеры.
Если мы запишем уравнение реакции монохлорирования пропана с использованием молекулярных формул, оно будет выглядеть следующим образом:
![]()
Уравнение реакции, записанное в таком виде, не только не позволяет определить, какой именно продукт (1-хлорпропан или 2-хлорпропан) имеется в виду, но и приводит к распространённому заблуждению, что при монохлорировании пропана образуется только один органический продукт — C3H7Cl, хотя на самом деле их два. Поэтому в органической химии при записи уравнений реакций обычно используют структурные, а не молекулярные формулы веществ.
В результате хлорирования алканов происходит замещение одного или нескольких атомов водорода в молекуле алкана на атомы галогена. Поэтому получающиеся органические вещества называют галогенпроизводными алканов.
Пример. Замещение двух атомов водорода хлором в молекуле этана.
Реакция протекает в два этапа.
а) Первая стадия хлорирования этана. На первой стадии происходит замещение одного атома водорода. При этом образуется только одно органическое вещество — хлорэтан:

б) Вторая стадия хлорирования этана. На данной стадии происходит взаимодействие молекулы хлора с молекулой хлорэтана, образовавшегося на первой стадии. Очевидно, что при этом могут образоваться два органических вещества:
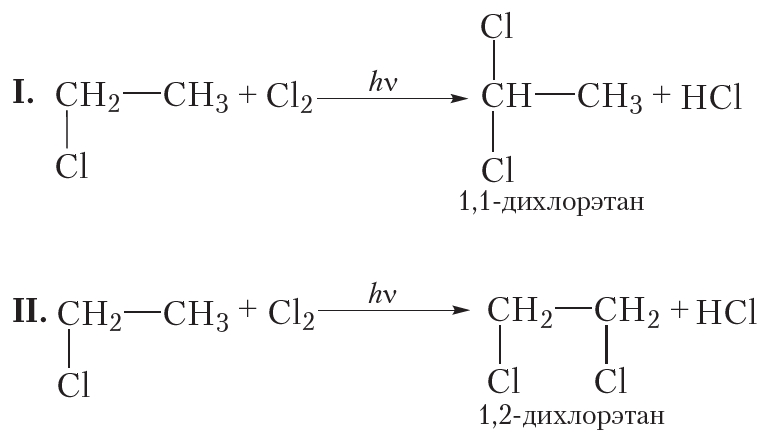
Действительно, в результате хлорирования этана можно получить смесь двух дихлорпроизводных.
Алканы вступают в реакции замещения также с бромом. Например:
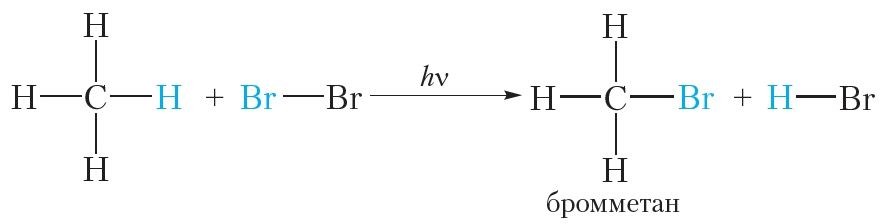
 В заключение ещё раз обратим внимание, что реакции алканов с хлором и бромом протекают в жёстких условиях: при облучении или нагревании.
В заключение ещё раз обратим внимание, что реакции алканов с хлором и бромом протекают в жёстких условиях: при облучении или нагревании.
С механизмом реакции галогенирования алканов вы можете познакомиться, перейдя по ссылке в QR-коде.
В реакциях галогенирования атомы водорода в молекуле алкана замещаются на атомы галогена, при этом углеродная цепь молекулы сохраняется. В других реакциях алканов их углеродный скелет изменяется или полностью разрушается. Рассмотрим такие реакции.
2. Пиролиз
При сильном нагревании алканов в их молекулах происходит разрыв связей ![]() и
и ![]() . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода. Разложение веществ при высоких температурах называют пиролизом (от греч. пиро — огонь, жар и лизис — разложение, распад). Например:
. В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода. Разложение веществ при высоких температурах называют пиролизом (от греч. пиро — огонь, жар и лизис — разложение, распад). Например:
![]()
Общая схема реакции пиролиза алканов (n — число атомов углерода в молекуле алкана):
![]()
Эту реакцию используют в промышленности для получения сажи и водорода.
3. Изомеризация
Ещё одним химическим свойством алканов является изомеризация, то есть превращение одного изомера в другой. Это свойство возможно для алканов, начиная с бутана, так как метан, этан и пропан изомеров не имеют. Реакция изомеризации протекает при пропускании алкана через реактор, нагретый до высокой температуры, в присутствии катализатора. При этом молекулы алканов линейного строения превращаются в молекулы разветвлённого строения, например реакция изомеризации н-бутана:
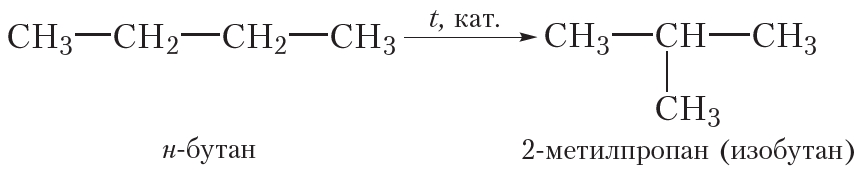
4. Горение. Взаимодействие с кислородом
Важнейшее свойство алканов — горение. Алканы воспламеняются при поджигании. Уравнение реакции горения метана:
![]()
Эта реакция вам хорошо знакома, она протекает при поджигании газа в кухонной газовой плите, ведь метан — основной компонент природного газа. Смесью пропана и изомерных бутанов наполняют газовые баллоны. Уравнения реакций горения этих алканов:
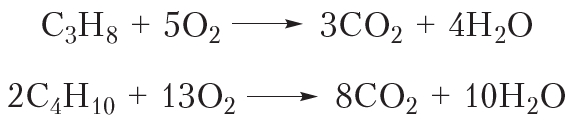
Последующие члены гомологического ряда алканов также горят при поджигании. Можно записать общее уравнение реакции горения:
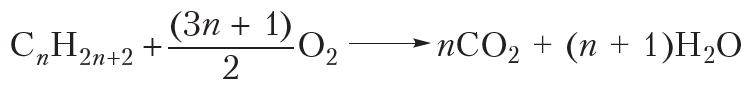
Видно, что при горении атомы водорода из молекулы алкана переходят в молекулы воды, а атомы углерода — в молекулы углекислого газа. Если горение алкана происходит в условиях недостатка кислорода, то, наряду с углекислым газом (СО2), может образоваться угарный газ (СО) или углерод (С) в виде сажи:
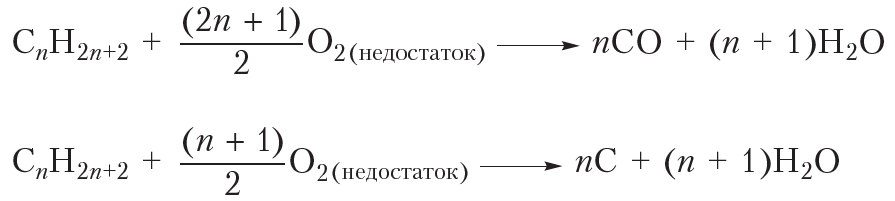
Отметим, что свойство гореть в кислороде присуще почти всем органическим соединениям. Поскольку все органические вещества содержат углерод, то при их горении могут образовываться оксиды углерода и сажа.
Образование угарного газа (CO) при неполном сгорании органического вещества смертельно опасно из-за высокой токсичности СО. Отравление угарным газом может произойти при неправильной эксплуатации печей и каминов.
Как видно, химические свойства алканов не отличаются большим разнообразием. Для них характерны в основном реакции окисления (в частности, горения), разложения и изомеризации при высокой температуре, а также реакции замещения, в результате которых получают галогенпроизводные алканов.
Получение и применение алканов

* Другие методы
получение алканов
Алканы входят в состав природного газа и нефти, поэтому основной метод их получения — выделение из природных источников (природного газа и нефти).
Вместе с тем, алканы могут быть получены из других органических веществ. Эти реакции мы будем рассматривать по мере дальнейшего изучения органической химии.
При горении алканов выделяется большое количество теплоты. В связи с этим алканы используются в качестве топлива. Мы уже говорили, что метан является основным компонентом природного газа. Смесью пропана и изомерных бутанов заполняют газовые баллоны. Жидкие алканы входят в состав бензина и дизельного топлива.
Другим направлением использования алканов является получение из них различных веществ. То есть алканы применяются в качестве сырья в химической промышленности. Взаимодействием метана с водяным паром получают водород:
![]()
Этот процесс называют конверсией метана. Образующаяся смесь водорода и оксида углерода(II) называется синтез-газом. Из водорода, выделенного из синтез-газа, и азота воздуха получают аммиак. Эти процессы осуществляют в больших масштабах на предприятии ОАО «Гродно Азот».
Из алканов получают углеводороды с двойными и тройными связями (ненасыщенные углеводороды). Эти углеводороды являются химически более активными, и из них синтезируют множество полезных органических веществ. Способы получения и свойства ненасыщенных углеводородов рассмотрим в следующих параграфах.
Молекулы различных алканов имеют сходное строение, поэтому алканы обладают сходными химическими свойствами.
Алканы при повышенной температуре или облучении вступают в реакции замещения с галогенами (хлором и бромом), в результате которых углеродный скелет молекулы алкана сохраняется, а атомы водорода замещаются атомами галогенов.
При сильном нагревании алканов в их молекулах происходит разрыв связей ![]() и
и ![]() . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода (пиролиз).
. В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода (пиролиз).
Нагревая алканы неразветвлённого строения в присутствии катализатора, можно получить разветвлённые алканы (изомеризация).
Алканы сгорают в кислороде. В результате реакции могут образовываться СО2, СО, С и Н2О.
Алканы содержатся в природном газе и нефти.
Алканы в основном используются в качестве топлива, а также для получения других веществ (водород, ненасыщенные углеводороды).
*Механизм реакции галогенирования алканов
Для того чтобы метан вступил в реакцию замещения с хлором, необходимо облучение смеси ультрафиолетовым излучением. Интересно, что данная реакция продолжается и после прекращения облучения.
Какое же воздействие оказывает ультрафиолетовое излучение на смесь метана с хлором? Сначала под действием излучения молекула хлора распадается на два атома хлора, каждый из которых имеет неспаренный электрон. Эта реакция называется инициированием:
![]()
Частицы, имеющие неспаренный электрон, называются радикалами. Радикалы при обычных условиях чрезвычайно неустойчивы и сразу же вступают во взаимодействие с другими молекулами.
Так, образовавшийся в результате распада молекулы хлора радикал Cl• взаимодействует с молекулой метана. При этом образуется молекула хлороводорода и радикал метил •CH3:

(1)
Радикал •CH3, в свою очередь, взаимодействует со следующей молекулой хлора, образуя хлорметан и новый радикал хлор:
![]()
(2)
Далее снова повторяются превращения (1) и (2). Цепочка этих превращений может повторяться сотни раз, поэтому подобные реакции называют цепными. Реакции (1) и (2) называются ростом цепи:
![]()
Цепь может оборваться в результате взаимодействия двух радикалов. Такая реакция называется обрывом цепи:
![]()
Следует отметить, что облучение смеси ультрафиолетовым светом необходимо лишь для распада молекулы хлора на атомы — стадии инициирования. Так как на стадии роста цепи в реакциях участвуют активные частицы (радикалы), то на этой стадии подвод энергии уже не требуется. Поэтому реакция хлорирования метана продолжает протекать даже после прекращения облучения.
По цепному радикальному механизму протекает реакция между водородом и кислородом, известная вам из курса неорганической химии. Такие реакции идут с очень большими скоростями и могут сопровождаться взрывом.
*Получение алканов
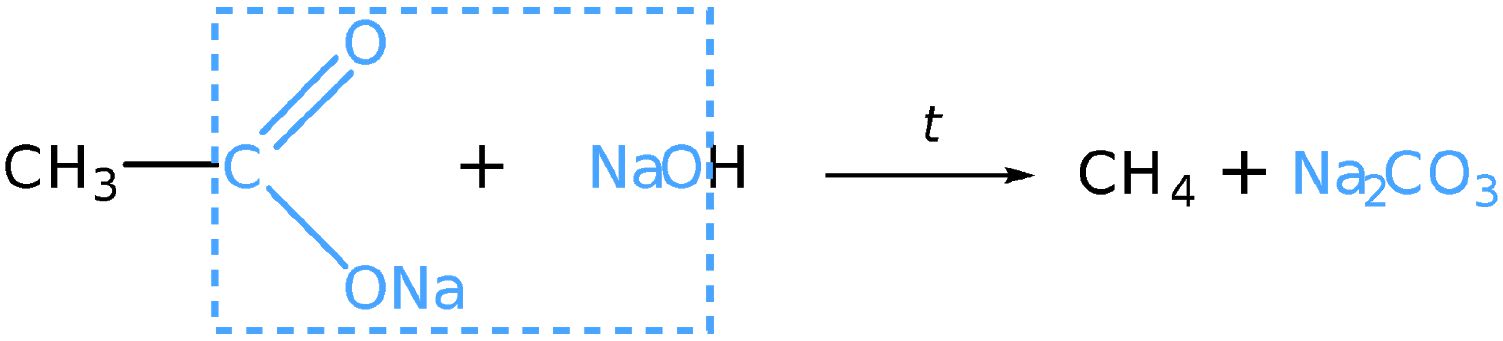
Нагревание солей карбоновых кислот со щёлочью
Алканы можно получить нагреванием натриевых солей карбоновых кислот с гидроксидом натрия. Так, при нагревании твёрдой смеси натриевой соли уксусной кислоты (ацетата натрия) с гидроксидом натрия образуется метан. Уравнение реакции:
Реакция Вюрца
Одним из методов получения алканов является реакция Вюрца, которая заключается во взаимодействии галогенпроизводных алканов с металлическим натрием. В качестве примера приведём реакцию получения этана:
![]()
Очевидно, что данную реакцию следует использовать для получения алканов симметричного строения, т. е. состоящих из двух одинаковых частей.
Реакция названа в честь её первооткрывателя — французского химика Шарля Адольфа Вюрца (1817–1884).
Вопросы и задания
1. Напишите уравнение реакции монобромирования этана.
2. Напишите уравнения реакций, которые протекают при взаимодействии н-бутана с хлором. Считайте, что только один атом водорода в молекуле н-бутана замещается на хлор. Подпишите названия образующихся органических веществ.
3. Сколько хлорпроизводных можно получить в результате хлорирования этана? Напишите уравнения реакций получения всех возможных хлорпроизводных этана, назовите хлорпроизводные. Можно ли при записи уравнений реакций в данном случае использовать молекулярные формулы?
4. Напишите уравнение реакции горения бутана в избытке кислорода. Какой объём (н. у.) углекислого газа образуется при сжигании 1 моль бутана?
5. Напишите уравнение реакции пиролиза метана с образованием водорода и углерода. Найдите массу углерода, который может быть получен при полном разложении 44,8 дм3 (н. у.) метана.
6. Назовите основные области применения алканов.
7*. Напишите уравнения реакций, при помощи которых из этана и неорганических веществ можно получить н-бутан.
8*. В результате реакции хлорирования этана образуется небольшое количество н-бутана. Объясните данное явление, напишите уравнения соответствующих реакций.
9*. Напишите структурную формулу вещества состава С3Н6О2, если известно, что его водный раствор имеет кислую реакцию, а при прокаливании его натриевой соли с NaOH образуется этан. Напишите уравнения протекающих реакций. (Ответ: пропановая кислота.)
10*. Предложите две возможные структурные формулы вещества состава С4Н8О2, если известно, что его раствор имеет кислую реакцию. При прокаливании натриевой соли вещества с гидроксидом натрия образуется пропан. (Ответ: бутановая кислота и 2-метилпроановая кислота.)
11*. Установите строение углеводорода С6Н14, при монобромировании которого образуется третичное бромпроизводное. Этот углеводород может быть получен по методу Вюрца без побочных продуктов. Напишите схемы протекающих реакций. (Ответ: 2,3-диметилбутан.)
12*. Получите пропан из уксусной кислоты.
13*. В газообразной смеси метана и хлора на три молекулы метана приходится одна молекула хлора.
а) Рассчитайте массовые доли метана и хлора в этой смеси.
б) Исходную смесь объёмом 45 л (н. у.) поместили в замкнутый сосуд и облучили светом. Считая, что только один атом водорода в молекуле метана замещается на хлор, рассчитайте массы всех веществ в смеси, образовавшейся после окончания реакции.
(Ответ:
а) Массовые доли: метана — 40,3 %; хлора — 59,7 %.
б) m(CH4) = 16 г; m(CH3Cl) = 25,25 г; m(HCl) = 18,25 г.)
Источник

Ответ
Ответ дан
тайная
а) хлорировании;
CH4 + Cl2 = CH3Cl + HCl
хлорметан
б) нитровании;
CH4 + HNO3 = CH3NO2 + H2O
нитрометан
в) окислении алканов.
горение – частный случай реакции окисления
CH4 + 2O2= CO2 + 2H2O
диоксид углерода и вода