No2 какие свойства проявляет
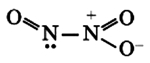
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 мая 2020; проверки требуют 5 правок.
| Оксид азота(IV) | |
|---|---|
| Систематическое наименование | Оксид азота(IV) |
| Традиционные названия | диоксид азота; двуокись азота, тетраоксид диазота |
| Хим. формула | NO2 |
| Рац. формула | NO2 |
| Состояние | бурый газ или желтоватая жидкость |
| Молярная масса | 46,0055 г/моль |
| Плотность | г. 2,0527 г/л ж. 1,4910г/см³ тв. 1,536 г/см³ |
| Энергия ионизации | 1,6E-18 Дж[1] |
| Температура | |
| • плавления | -11,2 °C |
| • кипения | +21,1 °C |
| Энтальпия | |
| • образования | 33,10 кДж/моль |
| Давление пара | 720 ± 1 мм рт.ст.[1] |
| Рег. номер CAS | 10102-44-0 |
| PubChem | 3032552 |
| Рег. номер EINECS | 233-272-6 |
| SMILES | N(=O)[O] |
| InChI | InChI=1S/NO2/c2-1-3 JCXJVPUVTGWSNB-UHFFFAOYSA-N |
| RTECS | QW9800000 |
| ChEBI | 33101 |
| Номер ООН | 1067 |
| ChemSpider | 2297499 |
| Предельная концентрация | 2 мг/м³ |
| Токсичность | Токсичен, окислитель |
| NFPA 704 | 3 2 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Оксид азота (IV) (диоксид азота, двуокись азота) NO2— бинарное неорганическое соединение азота с кислородом. Представляет собой ядовитый газ красно-бурого цвета с резким неприятным запахом или желтоватую жидкость.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C диоксид азота состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже +21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Получение[править | править код]
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислоты на медь:
.
Также взаимодействием нитритов с серной кислотой:
,
оксид азота(II) NO тотчас же реагирует с кислородом:
/
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность[почему?]:
Разработан более совершенный лабораторный способ получения NO2[2].
Последняя реакция была разработана и реализована в новой химической машине – генераторе окислителя ракетного топлива марки NTO согласно ГОСТ Р ИСО 15859-5-2010[3].
Другие способы получения оксида азота(IV) перечислены в статье [2].
Химические свойства[править | править код]
Кислотный оксид. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
В реакциях с галогенами образует соли нитрония, нитрозила и оксиды галогенов:
Применение[править | править код]
Диоксид азота применяется при производстве серной и азотной кислот. Также диоксид азота используется в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Физиологическое действие и токсичность[править | править код]
Оксид азота (IV) (диоксид азота) особо токсичен, является мощным окислителем. Числится в списке сильнодействующих ядовитых веществ. В больших дозах может стать сильнейшим неорганическим ядом. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
«Лисий хвост»[править | править код]
На фото справа — «лисий хвост» на Нижнетагильском металлургическом комбинате
«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота (NOx) на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Вредное воздействие[править | править код]
Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек.
Двуокись азота воздействует в основном на дыхательные пути и лёгкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом.
Примечания[править | править код]
Литература[править | править код]
- 1. Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- 2. A New Method of Nitrogen Dioxide Production / D.A. Rudakov / June 2018. doi: 10.13140/RG.2.2.19010.27844 (https://www.researchgate.net/publication/325846942_A_New_Method_of_Nitrogen_Dioxide_Production)
Источник
Уравнения окислительно-восстановительных реакций оксидов азота…
Азот образует несколько оксидов:
- солеобразующие оксиды:
- N2O3 – оксид азота (III)
- NO2 – оксид азота (IV)
- N2O4 – димер оксида азота (IV)
- N2O5 – оксид азота (V)
- несолеобразующие оксиды:
- N2O – оксид азота (I)
- NO – оксид азота (II)
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
– +
N=N=O
N2O (I) – бесцветный газ со слабым запахом и сладковатым вкусом.
- растворяется в воде, но не реагирует с ней;
- разлагается при слабом нагревании:
2N2O → 2N2+O2 - реагирует с водородом со взрывом:
N2O+H2 → N2+H2O - получают разложением нитрата аммония:
NH4NO3 → N2O+2H2O - применяют в смеси с кислородом в качестве “веселящего газа”, как средство общего наркоза в медицине, а также для получения азидов:
N2O+NaNH2 → NaN3+H2O
Оксид азота NO(II)
Молекула имеет вид:
·N=O
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
- Бесцветный газ, без запаха.
- Малорастворим в воде.
- Легко окисляется на воздухе с образованием диоксида азота:
2NO+O2=2NO2. - Взаимодействует с другими окислителями (CrO3,Cl2, KMnO4).
- Реагирует с активными металлами, водородом:
K+NO=KNO
2NO+2H2=N2+2H2O
NO(II) содержится в выхлопных газах автомобилей с двигателями внутреннего сгорания – проходя через каталитический конвертор, состоящий из нагретых до высокой температуры керамических ячеек, оксиды азота восстанавливаются, а СО окисляется:
2NO+2CO → N2+2CO2
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
В промышленных целях NO(II) получают каталитическим окислением аммиака (в роли катализатора используется платина):
4N-3H3+5O20 → 4N+2O-2+6H2O
В лабораторных условиях NO(II)получают действием разбавленной азотной кислотой на медь:
3Cu0+8HN+5O3 = 3Cu+2(NO3)2+2N-2O↑+4H2O
Монооксид азота используют для получения азотной кислоты.
Оксид азота N2O3(III)
Строение молекулы:
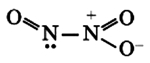
Связь N+-O- образована по донорно-акцепторному механизму.
Оксид азота N2O3(III) при н.у. является темно-синей жидкостью. При низких температурах (ниже -100°C) кристаллизуется.
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Соли азотистой кислоты – нитриты NaNO2, KNO2 являются устойчивыми соединениями, проявляя, как кислотные, так и восстановительные свойства, поскольку атом азота в них имеет “среднее” значение степени окисления (+3).
Оксид азота NO2(IV)
Строение молекулы:
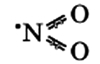
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный “полуторный” характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
Оксид азота NO2(IV) – смешанный оксид, ему соответствуют две кислоты: азотистая и азотная, поэтому, реакция взаимодействия с водой имеет следующий вид:
2N+4O2+H2O = HN+3O2+HN+5O3
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
На воздухе NO2 взаимодействует с водой с образованием только азотной кислоты:
4N+4O2+O20+2H2O ↔ 4HN+5O3-2
Оксид азота NO2(IV) взаимодействует с растворами щелочей с образованием воды и двух солей – нитрата и нитрита:
2N+4O2+2NaOH = NaN+3O2+NaN+5O3+H2O
В избытке кислорода образуется только нитрат натрия:
4N+4O2+4NaOH+O20 = 4NaN+5O3-2+2H2O
При температуре ниже 22°C молекулы оксида азота NO2(IV) легко соединяются попарно (димеризуются), в результате чего образуется бесцветная жидкость, превращающаяся в кристаллы при дальнейшем охлаждении до температуры ниже -10,2°C.

В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Оксид азота N2O5(V)
Строение молекулы:
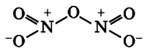
Связи N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
- Аммиак
- Азотная кислота
Источник
Оксиды азота
При описании свойств азота отмечалось, что при непосредственном взаимодействии азота с кислородом образуется только оксид азота (II) NO. Однако существуют оксиды азота со всеми возможными степенями окисления (от +1 до +5).
N2O – оксид азота (I), «веселящий газ»
При обычной температуре N2O – бесцветный газ со слабым приятным запахом и сладковатым вкусом; обладает наркотическим действием, вызывая сначала судорожный смех, затем – потерю сознания.
Способы получения
1. Разложение нитрата аммония при небольшом нагревании:
NH4NO3 = N2O↑ + 2Н2О
2. Действие HNO3 на активные металлы
10HNO3(конц.) + 4Са = N2O↑ + 4Ca(NO3)2 + 5Н2О
Химические свойства
N2O не проявляет ни кислотных, ни основных свойств, т. е. не взаимодействует с основаниями, с кислотами, с водой (несолеобразующий оксид).
При Т > 500’С разлагается на простые вещества. N2O – очень сильный окислитель. Например, способен в водном растворе окислить диоксид серы до серной кислоты:
N2O + SO2 + Н2О = N2↑ + H2SO4
NO – оксид азота (II), монооксид азота.
При обычной температуре NO – бесцветный газ без запаха, малорастворимый в воде, очень токсичный (в больших концентрациях изменяет структуру гемоглобина).
Способы получения
1. Прямой синтез из простых веществ может быть осуществлен только при очень высокой Т:
N2 + O2 = 2NО – Q
2. Получение в промышленности (1-я стадия производства HNO3).
4NH3 + 5O2 = 4NО + 6Н2О
3. Лабораторный способ – действие разб. HNO3 на тяжелые металлы:
8HNO3 + 3Cu = 2NO + 3Cu(NO3)2 + 4Н2О
Химические свойства
NO – несолеобразующий оксид (подобно N2О). Обладает окислительно-восстановительной двойственностью.
2NO + SO2 + Н2О = N2O↑ + H2SO4
2NO + 2H2 = N2 + 2Н2О (со взрывом)
2NO + O2 = 2NO2
10NO + 6KMnO4 + 9H2SO4 = 10HNO3 + 3K2SO4 + 6MnSO4 + 4Н2О
NO2 – оксид азота (IV), диоксид азота
При обычной температуре NO2 – красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
Способы получения
I. Промышленный – окисление NO: 2NO + O2 = 2NO2
II. Лабораторные:
действие конц. HNO3 на тяжелые металлы: 4HNO3 + Сu = 2NO2↑ + Cu(NO3)2 + 2Н2О
разложение нитратов: 2Pb(NO3)2 = 4NO2↑ + O2↑ + 2РbО
Химические свойства
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами – они всегда окислительно – восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот – азотной и азотистой:
2NO2 + Н2О = HNO3 + HNO2
Если растворение происходит в присутствии O2, то образуется одна кислота – азотная:
4NO2 + 2Н2О + O2 = 4HNO3
Аналогичным образом происходит взаимодействие NO2 со щелочами:
в отсутствие O2: 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2О
в присутствии O2: 4NO2 + 4NaOH + O2 = 4NaNO3 + 2Н2О
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
10NO2 + 8P = 5N2 + 4P2O5
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
2NO2 + 7Н2 = 2NH3 + 4Н2О
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
2NO2 + 2N2H4 = 3N2 + 4Н2О + Q
N2O3 и N2O5 – неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
Источник
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Из Википедии — свободной энциклопедии
| Систематическое наименование | Оксид азота(IV) |
|---|---|
| Хим. формула | NO2 |
| Состояние | бурый газ или желтоватая жидкость |
| Молярная масса | 46,0055 г/моль |
| Плотность | г. 2,0527 г/л ж. 1,4910г/см³ тв. 1,536 г/см³ |
| Энергия ионизации | 1,6E-18 Дж[1] |
| Т. плав. | -11,2 °C |
| Т. кип. | 21,1 °C |
| Энтальпия образования | 33,10 кДж/моль |
| Давление пара | 720 ± 1 мм рт.ст.[1] |
| Рег. номер CAS | 10102-44-0 |
| PubChem | 3032552 |
| Рег. номер EINECS | 233-272-6 |
| SMILES | N(=O)[O] |
| InChI | 1S/NO2/c2-1-3 JCXJVPUVTGWSNB-UHFFFAOYSA-N |
| RTECS | QW9800000 |
| ChEBI | 33101 |
| Номер ООН | 1067 |
| ChemSpider | 2297499 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |

Бурый газ
Оксид азота (IV) (диоксид азота) NO2 — ядовитый газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета.
В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислоты на медь:
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
Химические свойства
Кислотный оксид. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
Применение
Диоксид азота применяется при производстве серной и азотной кислот. Также диоксид азота используется в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Физиологическое действие
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
«Лисий хвост»
На фото справа — «лисий хвост» на Нижнетагильском металлургическом комбинате
«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота (NOx) на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Вредное воздействие
Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек.
Двуокись азота воздействует в основном на дыхательные пути и легкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом.
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Источник
Эта статья описывает оксиды азота как химические соединения; об образовании и способах сокращения выбросов оксидов азота при горении см. NOx (оксиды азота).
Окси́ды азо́та — неорганические бинарные соединения азота с кислородом.
Список оксидов[править | править код]
Известны 10 соединений азота с кислородом. Кроме пяти классических оксидов азота — закиси азота N2O, окиси азота NO, оксида азота(III) N2O3, диоксида азота NO2 и оксида азота(V) N2O5 — известны также димер диоксида азота N2O4 и 4 малостабильных соединения: нитрозилазид NON3, нитрилазид NO2N3, тринитрамид N(NO2)3 и нитратный радикал NO3.
N2O[править | править код]
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза, в высоких концентрациях токсичен. Также N2O называют закисью азота. Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси;
- увеличивает содержание кислорода в поступающем заряде;
- повышает скорость (интенсивность) сгорания в цилиндрах двигателя.
NO[править | править код]
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота(II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением аммиака при производстве азотной кислоты. В больших количествах очень ядовит, обладает удушающим действием.
N2O3[править | править код]
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NO2[править | править код]
Оксид азота NO2 (диоксид азота) — бурый ядовитый газ тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
и растворами щелочей:
N2O5(V)[править | править код]
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Леонтьев А. В., Фомичева О. А., Проскурнина М. В., Зефиров Н. С. Современная химия оксида азота(I) (рус.) // Успехи химии. — Российская академия наук, 2001. — Т. 70, № 2. — С. 107—122.
- Weller, Richard, Could the sun be good for your heart? Архивы TedxGlasgow. Filmed March 2012, posted January 2013
- Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- Stryer, Lubert. Biochemistry, 4th Edition. — W.H. Freeman and Company, 1995. — P. 732. — ISBN 0-7167-2009-4.
- Plant-based Diets | Plant-based Foods | Beetroot Juice | Nitric Oxide VegetablesАрхивы . Berkeley Test.
- Ghosh, S. M.; Kapil, V.; Fuentes-Calvo, I.; Bubb, K. J.; Pearl, V.; Milsom, A. B.; Khambata, R.; Maleki-Toyserkani, S.; Yousuf, M.; Benjamin, N.; Webb, A. J.; Caulfield, M. J.; Hobbs, A. J.; Ahluwalia, A. Enhanced Vasodilator Activity of Nitrite in Hypertension: Critical Role for Erythrocytic Xanthine Oxidoreductase and Translational Potential (англ.) // Hypertension : journal. — 2013. — Vol. 61, no. 5. — P. 1091—1102. —
Источник

