Назовите 2 сложных вещества какими физическими свойствами они обладают

Об
атомах и химических элементах
Другого
ничего в природе нет
ни
здесь, ни там, в космических глубинах:
все
— от песчинок малых до планет —
из
элементов состоит единых.
С.
П. Щипачев, «Читая Менделеева».
В
химии кроме терминов “атом” и “молекула” часто
употребляется понятие “элемент”. Что общего и чем эти понятия различаются?
Химический
элемент – это
атомы одного и того же вида. Так, например, все атомы водорода –
это элемент водород; все атомы кислорода и ртути – соответственно элементы
кислород и ртуть.
В
настоящее время известно более 107 видов атомов, то есть более 107 химических
элементов. Нужно различать понятия “химический элемент”, “атом” и “простое
вещество”
Простые
и сложные вещества
По
элементному составу различают простые вещества, состоящие из атомов
одного элемента (H2, O2, Cl2, P4,
Na, Cu, Au), и сложные вещества, состоящие из атомов разных
элементов (H2O, NH3, OF2, H2SO4,
MgCl2, K2SO4).
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ | |
МЕТАЛЛЫ | НЕМЕТАЛЛЫ |
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ | |
Железо Fe, медь Cu, алюминий Al, ртуть Hg, золото Au, серебро Ag и другие | Уголь С, сера S, фосфор P, йод I2, кислород O2, водород H2 и другие. |
1. Твёрдое агрегатное состояние (исключение – ртуть) 2. Металлический блеск 3. Хорошие проводники тепла и электричества. 4. Пластичные и ковкие. | 1. Твёрдые (Уголь С, сера S, фосфор P, йод I2), жидкие (бром Br2) и газообразные (кислород O2, водород H2). 2. Металлическим блеском не обладают (исключение йод) 3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ. 4. Хрупкие |
На
2019 год в периодической таблице – 118 химических элементов, которые
образуют около 500 простых веществ.

Самородное
золото – простое вещество
Способность
одного элемента существовать в виде различных простых веществ, отличающихся по
свойствам, называется аллотропией. Например, элемент кислород O
имеет две аллотропные формы – кислород O2 и
озон O3 с различным числом атомов в молекулах. Аллотропные
формы элемента углерод C – алмаз и графит – отличаются строение их кристаллов. Существуют
и другие причины аллотропии.
| Название элемента | Аллотропные формы | Пример простого вещества |
| Углерод С | Графит
|
|
| Углерод С |
|
Сложные
вещества часто называют химическими соединениями, например, оксид
ртути(II) HgO (получается путем соединения атомов простых веществ – ртути Hg и
кислорода O2), бромид натрия (получается путем соединения атомов
простых веществ – натрия Na и брома Br2).
Итак,
подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые –
молекулы таких веществ состоят из атомов одного вида. В химических реакциях не
могут разлагаться с образованием нескольких более простых веществ.
2. Сложные –
молекулы таких веществ состоят из атомов разного вида. В химических реакциях
могут разлагаться с образованием более простых веществ.
Различие
понятий “химический элемент” и “простое вещество”
Отличить
понятия “химический элемент” и “простое вещество” можно
при сравнении свойств простых и сложных веществ. Например, простое вещество
– кислород – бесцветный газ, необходимый для дыхания,
поддерживающий горение. Мельчайшая частица простого вещества кислорода –
молекула, которая состоит из двух атомов. Кислород входит также в состав оксида
углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит
химически связанный кислород, который не обладает свойствами простого вещества,
в частности он не может быть использован для дыхания. Рыбы, например, дышат не
химически связанным кислородом, входящим в состав молекулы воды, а свободным,
растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических
соединений, следует понимать, что в эти соединения входят не простые вещества,
а атомы определенного вида, то есть соответствующие элементы.
При
разложении сложных веществ, атомы могут выделяться в свободном состоянии и
соединяясь, образовывать простые вещества. Простые вещества состоят из атомов
одного элемента. Различие понятий «химический элемент» и «простое вещество»
подтверждается и тем, что один и тот же элемент может образовывать несколько
простых веществ. Например, атомы элемента кислорода могут образовать
двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно
различные простые вещества. Этим объясняется тот факт, что простых веществ
известно гораздо больше, чем химических элементов.
Пользуясь
понятием «химический элемент», можно дать такое определение простым и сложным
веществам:
Простыми
называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными
называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие
понятий «смесь» и «химическое соединение»
Сложные
вещества часто называют химическими соединениями.
Осуществите
переход по ссылке и просмотрите опыт взаимодействия простых веществ железа и серы.
Попробуйте
ответить на вопросы:
1.Чем
отличаются по составу смеси от химических соединений?
2. Сопоставьте
свойства смесей и химических соединений?
3. Какими
способами можно разделить на составляющие компоненты смеси и химического
соединения?
4. Можно
ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная
характеристика смесей и химических
Вопросы для сопоставления смесей с химическими соединениями | Сопоставление | |
Смеси | Химические соединения | |
Чем отличаются по составу смеси от химических соединений? | Вещества можно смешивать в любых соотношениях, т.е. состав смесей | Состав химических соединений постоянный. |
Сопоставьте свойства смесей и химических соединений? | Вещества в составе смесей сохраняют свои свойства | Вещества, образующие соединения, свои свойства не сохраняют, так как |
Какими способами можно разделить на составляющие компоненты смеси и | Вещества можно разделить физическими способами | Химические соединения можно разложить только с помощью химических |
Можно ли судить по внешним признакам об образовании смеси и химического | Механическое смешивание не сопровождается выделением теплоты или | Об образовании химического соединения можно судить по признакам |
Задания
для закрепления
I.
Поработайте с тренажёрами
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
II.
Решите задание
Из предложенного списка веществ выпишите отдельно
простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3,
H3PO4, N2, Fe. Объясните ваш выбор, в каждом
из случаев.
III.
Ответьте на вопросы
№1. Сколько простых веществ записано в ряду
формул:
H2O, N2, O3, HNO3,
P2O5, S, Fe, CO2, KOH.
№2. К сложным относятся оба
вещества:
А) С (уголь) и S (сера);
Б) CO2 (углекислый газ) и H2O
(вода);
В) Fe (железо) и CH4 (метан);
Г) H2SO4 (серная кислота)
и H2 (водород).
№3. Выберите правильное
утверждение: простые вещества состоят из атомов одного вида.
А) Верно; Б) Неверно
№4. Для смесей характерно то, что
А) Они имеют постоянный состав;
Б) Вещества в составе “смеси” не сохраняют
свои индивидуальные свойства;
В) Вещества в “смесях” можно разделить
физическими свойствами;
Г) Вещества в “смесях” можно разделить при
помощи химической реакции.
№5. Для “химических соединений”
характерно следующее:
А) Переменный состав;
Б) Вещества, в составе “химического соединения
«можно разделить физическими способами;
В) Об образовании химического соединения можно
судить по признакам химических реакций;
Г) Постоянный состав.
№6. В каком случае идёт речь
о железе как о химическом элементе?
А) Железо – это металл, который притягивается
магнитом;
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) В состав сульфида железа входит один атом железа.
№7.
В каком случае идёт речь о кислороде как о простом веществе?
А) Кислород – это газ, поддерживает дыхание и
горение;
Б) Рыбы дышат кислородом, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 3301000
более месяца назад
Просмотров : 7
Ответов : 1
Лучший ответ:

H2O
H2SO4
тока эти свойства знаю
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Решите уравнение tg4x 1=0
более месяца назад
Смотреть ответ
Просмотров : 10
Ответов : 1
Помогите!В одной цистерне было 4 раза больше воды,чем в другой.Когда из первой цистерны вылили 56 л воды,а во вторую долили 22 л,то воды в обеих цистернах стало поровну.Сколько литров воды было во второй цистерне первоначально?
более месяца назад
Смотреть ответ
Просмотров : 5
Ответов : 1
Помогите пжл Не получается вообще. СРОЧНО ПОМОГИТЕ!!!!!!!
более месяца назад
Смотреть ответ
Просмотров : 5
Ответов : 1
Какую форму имеют орбиты планет солнечной системы
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Какие военные походы совершил Карл Великий ? Каков был их общий результат?
более месяца назад
Смотреть ответ
Просмотров : 11
Ответов : 1
Источник
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С – алмаз, графит, карбин, фуллерен.
- O – кислород, озон.
- S – ромбическая, моноклинная, пластическая.
- P – белый, красный, чёрный.
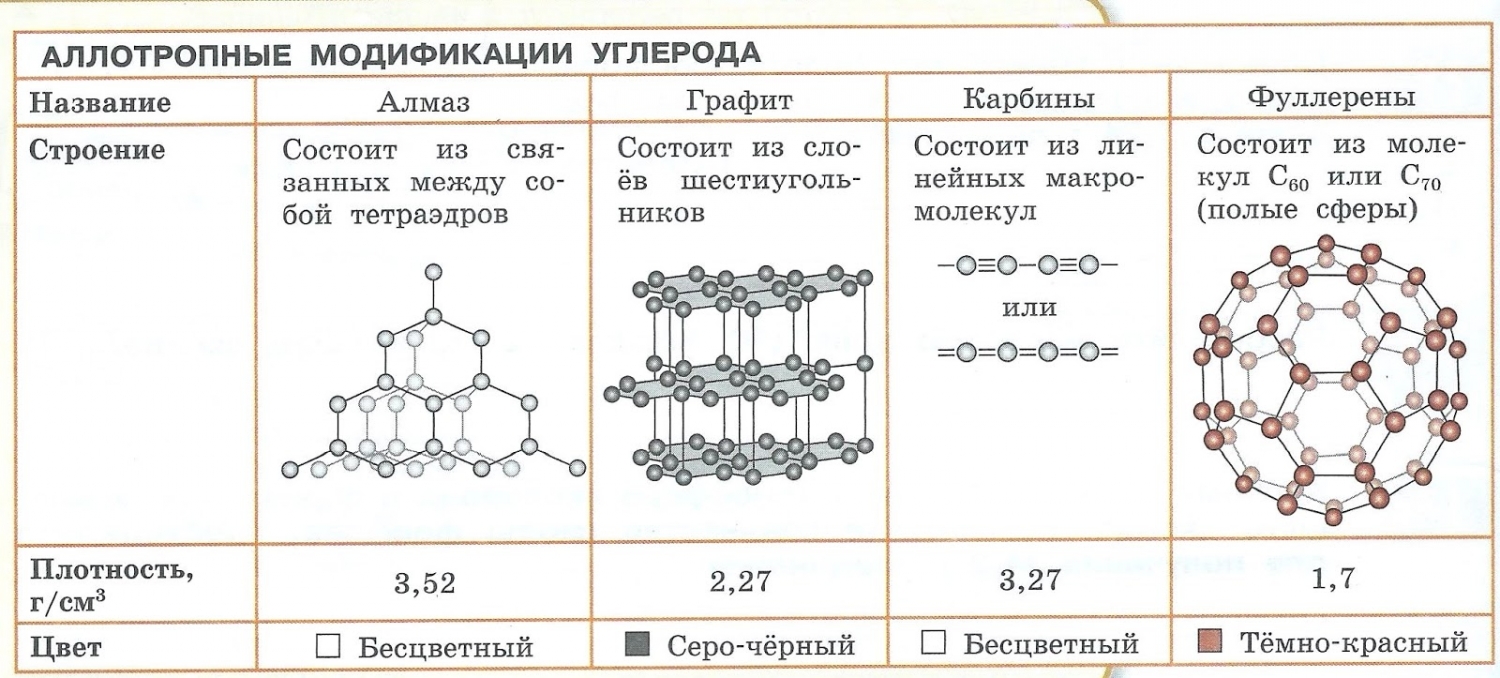
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
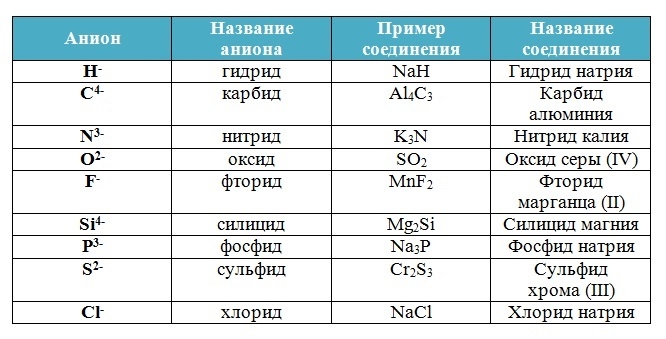
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me – металл
- Ac – кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Источник



