Напиши какие свойства и состав

Дина В.
30 октября 2018 · 1,5 K
Наблюдение, оценка внешнего вида. Этот способ не самодостаточен, но с него всегда начинают. Потом данные наблюдения могут подтвердить или опровергнуть какие-то другие предположения.
Оценка физических свойств — плотность, агрегатное состояние, температура плавления/кипения, прочие свойства. Если, скажем, мы видим серебристую тяжёлую жидкость, которая не смачивает никакие поверхности и скатывается в характерные шарики, мы с большой вероятностью предполагаем ртуть.
Оценка химических свойств. У очень многих ионов и ионных групп есть известные реакции выявления: например, все неорганические кислоты реагируют с металлами, и почти все — по одной и той же схеме (хотя есть исключения). Кислоты и щёлочи также окрашивают лакмус, например (но в разные цвета).
Хитрая технология, доступная только на сложном оборудовании: спектральный анализ. Суть её, грубо говоря, в том, что каждый элемент пропускает через себя свет особым образом, и это позволяет напрямую получить информацию о том, какие атомы содержатся в веществе.
Как этиловый и метиловый спирты влияют на нервную клетку? Какие необратимые процессы происходят в ней?
Естественные науки, НАУЧПОП.
Более ядовиты продукты метаболизма этилового и метилового спирта.
В печени имеется 2 фермента, способных “утилизировать” поступившие спирты. Метанол под действием фермента алкогольдегидрогеназа распадается на формальдегид, а этанол на ацетальдегид. Формальдегид токсичнее ацетальдегида, поэтому и метанол считается более опасным в сравнении с этанолом. Затем, спустя какое-то время альдегиды под действией другого фермента – альдегиддегидрогеназы распадаются до соответствующих карбоновых кислот – муравьиная (метановая) для метанола, и уксусная (этановая) для этанола. Эти соединения уже не представляют никакой угрозы для организма, позже они распадаются с образованием углекислого газа и воды. Но фермент альдегиддегидрогеназа работает у всех с разной скоростью, и поэтому алкогольное опьянение длится у всех по разному.
Метанол вызывает слепоту именно из-за пораженияглазного нерва.
Прочитать ещё 1 ответ
Что описывает химия?
Студент-эколог, фотограф-любитель, путешественница
Химия – это наука о веществах, их составе, строении и свойствах. Она изучает частицы, из которых состоят все окружающие нас предметы, газы, жидкости, их взаимодействие. С помощью химии можно описать пути протекания различных процессов.
Например, почему для того чтобы тесто для выпечки поднималось, используют пищевую соду и уксусную кислоту? Пищевая сода – это гидрокарбонат натрия, кислая соль – NaHCO3. Уксусная кислота имеет формулу CH3COOOH. Что происходит, когда они взаимодействуют? Зная свойства эти веществ, можно легко понять, что при взаимодействии кислой соли и кислоты получается средняя соль. Стоит упомянуть, что реакция между данными типами веществ пойдёт только в том случае, если кислота, с которой проводится реакция, сильнее кислоты, которая находится в составе кислой соли. Так как в нашем случае именно так всё и есть, можно записать схему протекания реакции:
NaHCO3 + CH3COOH → CH3COONa + CO2↑ + H2O
В итоге сода нейтрализована кислотой, из-за чего её неприятный привкус в выпечке будет отсутствовать. Пузырики выделяющегося углекислого газа и будут разрыхлять тесто, и оно поднимется.
Вот на таком примере из бытовой жизни можно понять, что описывает химия – она описывает взаимодействия между веществами, основывая их на свойствах этих веществ, строении их молекул и элементарных частиц.
Чем химический элемент отличается от вещества?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Чем отличается элемент от вещества ?????
✅Вещество- это то, из чего состоят физические тела.Является одной из форм материи
✅Выделяют простые вещества,состоящие из атомов одного элемента
Например, О2,Сl2,N2
И сложные вещества ,состоящие из атомов двух или более элементов
Например, Н2О,СО2,С6Н12О6
✅Элемент-это совокупность атомов с одинаковым зарядом атомных ядер
Элементы представлены в таблице Менделеева
✅Если сказать:«Кислород -это газ»,то здесь понятно,что это вещество
Если сказать: «Кислород входит в состав воды», то здесь можно сделать вывод о том,что кислород-это элемент
Прочитать ещё 2 ответа
Состав какого вещества быстро разъедает металл?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Лучше всего металлы реагируют с кислотами, при этом происходит химическая реакция с образованием соли и выделением водорода. Есть определенная смесь кислот (пропорции концентрированных соляной и азотной кислот) называемая “царской водкой” она разъедает даже царский металл золото.
Источник
1. Почему алканы называют предельными и насыщенными углеводородами?
Потому что атомы углерода в молекулах алканов соединены только одинарными связями.
2. Какие соединения образуют гомологический ряд? Являются ли гомологами метан и этилен?
Гомологический ряд образуют соединения, сходные по строению и химическим свойствам и отличающиеся по составу молекул на одну или несколько групп CH2mathrm{CH_2}CH2.
Метан и этилен не являются гомологами.
3. Алкан, имеющий неразветвлённую цепь из пяти атомов углерода, называется н-пентан. Составьте формулы двух изомеров и двух гомологов н-пентана. Является ли углеводород состава С7Н16 гомологом пентана?
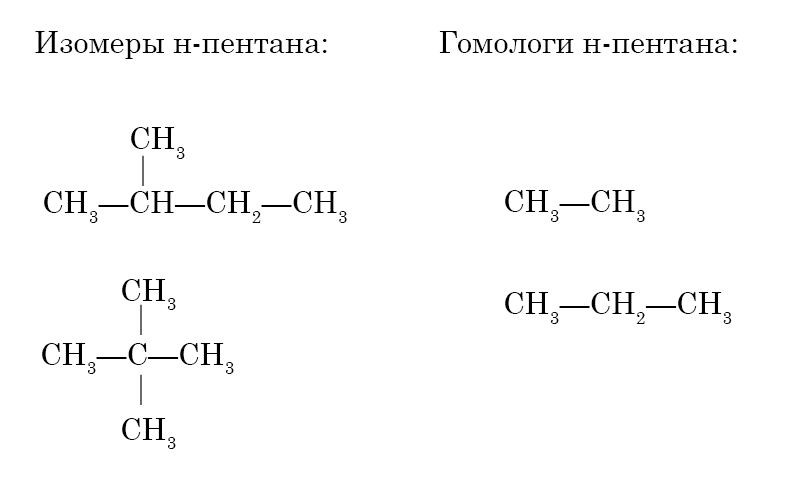
Углеводород состава C7H16mathrm{C_7{H_{16}}}C7H16 является гомологом пентана.
4. Приведите формулы газообразных при нормальных условиях алканов. Изобутан (изомер н-бутана) имеет температуру кипения, равную –12 °С. В каком агрегатном состоянии находится изобутан при нормальных условиях?
Формулы газообразных при нормальных условиях алканов:
CH4mathrm{CH_4}CH4, CH3−CH3mathrm{CH_3{-}CH_3}CH3−CH3, CH3−CH2−CH3mathrm{CH_3{-}CH_2{-}CH_3}CH3−CH2−CH3, CH3−CH2−CH2−CH3mathrm{CH_3{-}CH_2{-}CH_2{-}CH_3}CH3−CH2−CH2−CH3

Изобутан при нормальных условия находится в газообразном агрегатном состоянии.
5. В процессе ремонта автомобилей загрязнённые машинным маслом детали иногда промывают керосином. Можно ли для этой цели использовать воду либо водные растворы кислот или щелочей и почему?
Нельзя, потому что вода или водные растворы кислот или щелочей (полярные растворители) не способны промыть детали, загрязненные машинным маслом (неполярное вещество) (принцип “подобное растворяется в подобном”).
6. Алканы содержатся в нефти. Какие физические свойства алканов объясняют образование плёнки на поверхности воды при попадании в неё нефтепродуктов?
Жидкие и твердые алканы имеют плотность меньше плотности воды (<1 г/см3mathrm{{<}{1},г/{см}^3}<1г/см3).
7. Постройте график зависимости температуры кипения алканов от числа атомов углерода в их молекулах.

8. Среди перечисленных укажите формулы предельных углеводородов: C2H6, C3H6, C8H14, C9H20.
Формулы предельных углеводородов: C2H6mathrm{C_2H_6}C2H6, C9H20mathrm{C_9{H_{20}}}C9H20.
Источник
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Если же сахар смешать с водой, происходит диффузия — молекулы сахара проникают между молекулами воды. Образуется раствор, в состав которого входят как молекулы воды, так и молекулы сахара.
Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
Чистые вещества | Смеси | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды. Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида. Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара. Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной. Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?
Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, вода считается практически чистой, если образец жидкости не имеет цвета, вкуса и запаха, замерзает при температуре (0) °С, кипит при температуре (+100) °С, при температуре (+4) °С имеет плотность (1000) кг/м³ и практически не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.
В банках золото хранится в слитках, массовая доля благородного металла в которых составляет (99,9) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет (99,999) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
Источник
Запрос «Жир» перенаправляется сюда; см. также другие значения.
Шариковая модель триглицерида. Красным цветом выделен кислород, чёрным — углерод, белым — водород
Жиры́, также триглицери́ды, триацилглицериды (сокр. ТАГ) — органические вещества, продукты этерификации карбоновых кислот и трёхатомного спирта глицерина.
В живых организмах выполняют, прежде всего, структурную и энергетическую функции: они являются основным компонентом клеточной мембраны, а в жировых клетках сохраняется энергетический запас организма.
Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жиры растительного происхождения называют маслами (маслами также называют некоторые животные жиры, например, сливочное и топлёное масла). Растительные масла, как правило, имеют жидкую консистенцию при комнатной температуре. Исключение составляют масла тропических растений (пальмовое, кокосовое, какао и т. п.). Жиры животного происхождения, напротив, при комнатной температуре обычно находятся в застывшей фазе. Исключение составляют рыбий жир, говяжий жир с ног (например, при варке холодца) и др.
Состав жиров[править | править код]
Состав жиров определили французские ученые М. Шеврель и М. Бертло.
В 1811 году М. Шеврель установил, что при нагревании смеси жира с водой в щелочной среде образуются глицерин и карбоновые кислоты (стеариновая и олеиновая). В 1854 году химик М. Бертло осуществил обратную реакцию и впервые синтезировал жир, нагревая смесь глицерина и карбоновых кислот.
Состав жиров отвечает общей формуле
где R¹, R² и R³ — радикалы (одинаковых или различных) жирных кислот.
Природные жиры содержат в своём составе три кислотных радикала, имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода (содержание «нечётных» кислотных радикалов в жирах обычно менее 0,1 %).
Природные жиры чаще всего содержат следующие жирные кислоты:
Насыщенные:
Алкановые кислоты:
- стеариновая (C17H35COOH)
- маргариновая (C16H33COOH)
- пальмитиновая (C15H31COOH)
- капроновая (C5H11COOH)
- масляная (C3H7COOH)
Ненасыщенные:
Алкеновые кислоты:
- пальмитолеиновая (C15H29COOH, 1 двойная связь)
- олеиновая (C17H33COOH, 1 двойная связь)
Алкадиеновые кислоты:
- линолевая (C17H31COOH, 2 двойные связи)
Алкатриеновые кислоты:
- линоленовая (C17H29COOH, 3 двойные связи)
- арахидоновая (C19H31COOH, 4 двойные связи, реже встречается)
В состав некоторых природных жиров входят остатки и насыщенных, и ненасыщенных карбоновых кислот.
Состав природных жиров[править | править код]
| Триглицериды | Остатки кислот, % по массе | ||||
|---|---|---|---|---|---|
| Пальмитиновая | Стеариновая | Олеиновая | Линолевая | Линоленовая | |
| Сливочное масло | 25 | 11 | 34 | 6 | 5 |
| Подсолнечное масло | 11 | 4 | 38 | 46 | – |
| Оливковое масло | 10 | 2 | 82 | 4 | – |
| Льняное масло | 5 | 3 | 5 | 62 | 25 |
| Пальмовое масло | 44 | 5 | 39 | 11 | – |
| Бараний жир (твёрдый) | 38 | 30 | 35 | 3 | 9 |
| Говяжий жир (твёрдый) | 31 | 26 | 40 | 2 | 2 |
| Свиной жир (твёрдый) | 27 | 14 | 45 | 5 | 5 |
| Жиры в организме человека | 25 | 8 | 46 | 10 | – |
Животные жиры[править | править код]
Чаще всего в животных жирах встречаются стеариновая и пальмитиновая кислоты, ненасыщенные жирные кислоты представлены в основном олеиновой, линолевой и линоленовой кислотами. Физико-химические и химические свойства жиров в значительной мере определяются соотношением входящих в их состав насыщенных и ненасыщенных жирных кислот.
Растительные масла[править | править код]
В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50 %.
Свойства жиров[править | править код]
Энергетическая ценность жира примерно равна 9,3 ккал на грамм, что соответствует 39 кДж/г. Таким образом, энергия, выделяемая при расходовании 1 грамма жира, приблизительно соответствует, с учётом ускорения свободного падения, поднятию груза весом 39000 Н (массой ≈ 4000 кг) на высоту 1 метр.
При сильном взбалтывании с водой жидкие (или расплавленные) жиры образуют более или менее устойчивые эмульсии (см. гомогенизация). Природной эмульсией жира в воде является молоко.
Физические свойства[править | править код]
Жиры — вязкие жидкости или твёрдые вещества, легче воды. Их плотность колеблется в пределах 0,9—0,95 г/см³. Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях (бензол, дихлорэтан, эфир и др.) и частично растворимы в этаноле (5—10 %).
Классификация[править | править код]
Чем больше в жирах содержание ненасыщенных кислот, тем ниже температура плавления жиров.[2]
| Агрегатное состояние жиров | Различия в химическом строении | Происхождение жиров | Исключения |
|---|---|---|---|
| Твёрдые жиры | Содержат остатки насыщенных ВКК | Животные жиры | Рыбий жир(жидк. при н/у) |
| Смешанные жиры | Содержат остатки насыщенных и ненасыщенных ВКК | ||
| Жидкие жиры(масла) | Содержат остатки ненасыщенных ВКК | Растительные жиры | Кокосовое масло, какао масло(твёрд. при н/у) |
Номенклатура[править | править код]
По тривиальной номенклатуре глицериды называют, добавляя окончание -ид к сокращенному названию кислоты и приставку, показывающую, сколько гидроксильных групп в молекуле глицерина проэтерифицировано.
Химические свойства[править | править код]
Гидролиз жиров[править | править код]
Гидролиз для жиров характерен, так как они являются сложными эфирами. Он осуществляется под действием минеральных кислот и щелочей при нагревании. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза — образование глицерина и соответствующих карбоновых кислот:
С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH
Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омыление жиров (см. Мыло).
С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло)
Гидрирование (гидрогенизация) жиров[править | править код]
В составе растительных масел содержатся остатки ненасыщенных карбоновых кислот, поэтому они могут подвергаться гидрированию. Через нагретую смесь масла с тонко измельченным никелевым катализатором пропускают водород, который присоединяется по месту двойных связей ненасыщенных углеводородных радикалов. В результате реакции жидкое масло превращается в твёрдый жир. Этот жир называется саломасом, или комбинированным жиром. При гидрировании, как побочный эффект, происходит изомеризация некоторых из оставшихся двойных связей, тем самым некоторые молекулы жира превращаются в трансжиры, доля трансижиров в масле увеличивается.
Пищевые свойства жиров[править | править код]
Жиры являются одним из основных источников энергии для млекопитающих. Эмульгирование жиров в кишечнике (необходимое условие их всасывания) осуществляется при участии солей жёлчных кислот. Энергетическая ценность жиров примерно в 2 раза выше, чем углеводов, при условии их биологической доступности и здорового усвоения организмом.
Насыщенные жиры расщепляются в организме на 25—30 %, а ненасыщенные жиры расщепляются полностью.
Благодаря крайне низкой теплопроводности, жир, откладываемый в подкожной жировой клетчатке, служит теплоизолятором, предохраняющим организм от потери тепла (у китов, тюленей и др.).
Применение жиров[править | править код]
- Пищевая промышленность (в частности, кондитерская)
- Фармация
- Производство мыла и косметических изделий
- Производство смазочных материалов
См. также[править | править код]
- Липиды
Примечания[править | править код]
- ↑ Темирбулатова А. Е. — Учебник по химии для 11х классов естественно-математического направления, 2011 — С.218
- ↑ под ред. А. С. Егорова — Репетитор по химии, 2009. — С.642
Литература[править | править код]
- Триглицериды // Большая российская энциклопедия. Том 32. — М., 2016. — С. 389.
- Жиры // Большая российская энциклопедия. Том 10. — М., 2008. — С. 98—99.
- Тютюнников, Б. Н. Химия жиров / Б. Н. Тютюнников, З. И. Бухштаб, Ф. Ф. Гладкий и др. — 3-е изд., перераб. и доп. — М.: Колос, 1992. — 448 с.
- Беззубов, Л. П. Химия жиров / Л. П. Беззубов. — 3-е изд. — М.: Пищевая промышленность, 1975. — 280 с.
- Щербаков, В. Г. Химия и биохимия переработки масличных семян / В. Г. Щербаков. — М.: Пищевая промышленность, 1977. — 180 с.
- Евстигнеева Р. П. Химия липидов / Р. П. Евстигнеева, Е. Н. Звонкова, Г. А. Серебренникова, В. И. Швец. — М.: Химия, 1983. — 296 с., ил.
Источник
