На каких свойствах водорода основаны способы его собирания

История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть. Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье. Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
СН4 + Н2О = СО + 3Н2
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
Источник
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Источник
В чистом, несвязанном виде водород в природе практически не встречается. Он может выделяться в незначительных количествах при извержении вулкана или из скважин при добывании нефти (всего 1 % содержится в земной коре). Поэтому существуют искусственные методы получения водорода в промышленности.

Методы выделения
Водород – это лёгкий бесцветный газ, занимающий первую клетку в периодической системе Менделеева. Газ нетоксичен, но горюч и взрывоопасен. Это самый распространённый элемент во Вселенной.
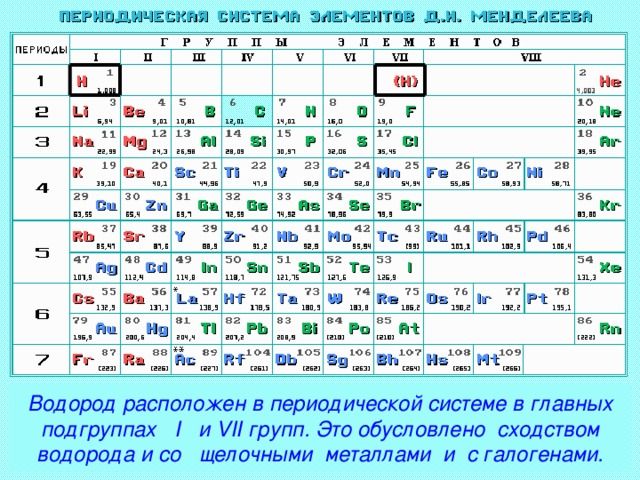
Рис. 1. Водород в периодической таблице.
С водородом химические элементы легко образуют неустойчивые связи, которые легко разрушаются, например, при нагревании.
В промышленности водород выделяют:
- из метана;
- из воды;
- из гидридов.
В лабораторных условиях получают водород в результате реакции металла с кислотой. Кроме того, водород образуется при взаимодействии пара воды с металлами и неметаллами, а также при электролизе воды.
Основные способы получения водорода описаны в таблице.
Взаимодействие | Реакция получения | Побочные продукты |
Натрия с водой | 2Na + 2H2O → 2NaOH + H2↑ | Гидроксид натрия |
Гидрида кальция с водой | CaH2 + 2H2O → Ca(OH)2 + 2H2↑ | Гидроксид кальция |
Гидрида натрия с водой | NaH + H2O → NaOH + H2↑ | Гидроксид натрия |
Водяного пара с раскалённым железом | 4Н2О + 3Fe → Fe3O4 + 4H2↑ | Оксид железа (II, III) |
Водяного пара с раскалённым коксом (газификация угля) | H2O + C → CO↑ + H2↑ | Угарный газ |
Метана с водяным паром (разложение метана при 1000°C) | CH4 + H2O → CO↑ + 3H2↑ | Угарный газ |
Фиолетового фосфора и водяного пара | 2Р + 8Н2О → 2Н3РО4 + 5Н2↑ | Фосфорная кислота |
Цинка с разбавленной соляной кислоты | Zn + 2HCl → ZnCl2 + H2↑ | Соль хлорид цинка |
Алюминия или кремния со щёлочью и водой | 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Si + 2KOH + H2O → Na2SiO3 + 2H2↑ | Соль тетрагидроксоалюминат натрия или метасиликат натрия |
Разложение метана при высокой температуре | CH4 → C + 2H2↑ | Сажа |
Окисление метана | 2CH4 + O2 → 2CO + 4H2↑ | Угарный газ |
Электролитический способ разложения воды (добавляют электролиты, например, КОН) | 2H2O → 2H2↑ + O2↑ | Кислород |
Электролиз растворов солей | 2NaCl + 2H2O → 2NaOH + Cl2 + H2↑ | Гидроксид натрия и свободный хлор |
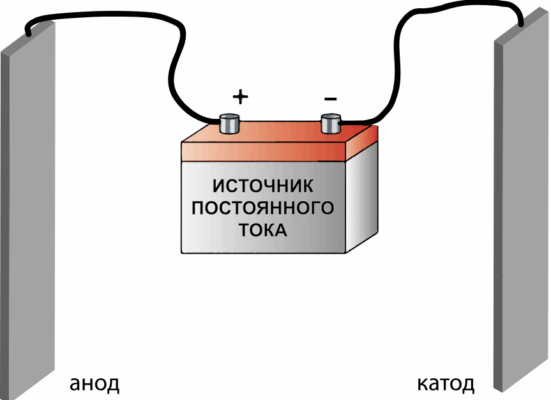
Рис. 2. Электролиз солей.
Водород при взаимодействии с кислотами и металлами, содержащими примеси, получается загрязнённым, поэтому проводят процесс очистки. Для этого полученное водородное соединение пропускают через раствор перманганата или бихромата калия, а затем через раствор гидроксида калия и концентрированную серную кислоту.
Использование водорода
Реакции собирания и распознавания водорода необходимы для извлечения чистого газа, который используется в качестве экологического топлива, а также участвует в различных химических реакциях для получения соединений.
Водород применяется в различных отраслях промышленности:
- при производстве аммиака (NH3);
- для получения соляной кислоты (HCl);
- при синтезе метилового спирта;
- для восстановления металлов;
- при сварке (в результате взаимодействия водорода и кислорода выделяется большое количество тепла);
- для получения растительных жиров при производстве маргарина.
Водород использовался для наполнения воздушных шаров и аэростатов. Сегодня сжиженный водород – топливо для ракет.

Рис. 3. Сжиженный водород.
Что мы узнали?
Из урока 9 класса узнали, как получают водород в промышленных и лабораторных условиях. Водород выделяется в ходе реакций металлов, гидридов, фосфора с водой, при газификации угля, при взаимодействии цинка с соляной кислотой и алюминия или кремния со щёлочью. Водород получают из метана путём его окисления, разложения при высокой температуре или при взаимодействии с водой. Также водород выделяется при электролизе солей и разложении воды.
Тест по теме
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 142.
Источник
Урок 31 Класс 8 –
Тема: Практическая работа № 4 Получение водорода и исследование его свойств.
Дата ____________20
МБОУ «С(К)ОШ №16», учитель химии Березинская А.А.
Цель:
совершенствовать экспериментальные умения – приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетрад;
работа над развитием навыков умелого обращения с огнем, опасными веществами.
умение составлять уравнения химических реакций, умение делать выводы, соблюдать правила техники безопасности;
расширение кругозора обучающихся, формирование уважения к истории науки.
развитие представлений о здоровом образе жизни в блоках: «Химия в быту – безопасное поведение».
Коррекционные цели: коррекция и развитие связной устной и письменной речи, коррекция и развитие моторной памяти, развитие умений делать выводы.
Оборудование:
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
спиртовка, спички
автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
Реактивы:
гранулы цинка, соляная кислота (разб.), оксид меди (II).
Тип урока: урок- практикум (виртуальная лаборатория)
Правила техники безопасности: Работа со спиртовкой; работа со стеклом; Проверка прибора на герметичность.
Ход работы:
I. Подготовка к проведению практической работы.
Инструктаж по технике безопасности при работе с сухим горючим.
Технический инструктаж о проведении практической работы.
II. Актуализация знаний
Какие исходные вещества будем использовать мы для получения водорода?
Необходимо ли нагревать реакционную смесь?
На что обратить внимание при записи наблюдений?
Какой прибор будем использовать для получения водорода?
Какими способами можно собрать водород, почему?
Знакомство с инструкцией: учебник стр. ________
III. Проведение практической работы (просмотр видео: Получение водорода.)
III. Закрепление знаний, умений, навыков.
После проведения работы сделать вывод, записать все результаты в тетрадь.
Домашнее задание: § ________.
Практическая работа № 4.Получение водорода и исследование его свойств.
С правилами ТБ ознакомлен (а)
Цель: научиться получать, собирать водород; изучить физические и химические свойства водорода.
Оборудование:
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага,спиртовка, спички, автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой.
Реактивы: гранулы цинка, соляная кислота (разб.), оксид меди (II).
Ход работы
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q – при обычных условиях
Наблюдения:
реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
из газоотводной трубки выделяется бесцветный газ
при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода

Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
Наблюдения:
при сжигании первой порции газа раздается резкий лающий звук
при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
Наблюдения:
порошок меняет цвет с черного на медный
на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разбавленной соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
3
Источник
