На каких свойствах водорода основаны эти способы
Химические свойства водорода
Цель: Познакомить учащихся с химическими свойствами и его применением, провести лабораторный опыт, показывающий восстановительные свойства водорода.
Ход урока
I. Организационный момент
II. Проверка домашнего задания
Рассказать о водороде, как о химическом элементе. Рассказать о водороде, как о простом веществе. Определите, в каких фразах о водороде говорится как о простом веществе, а в каких — как о химическом элементе.
1. Водород входит в состав воды, кислот, природного горючего газа |
2. Водород содержится в органических веществах |
3. Один из способов получения водорода — это разложение воды при действии постоянного электрического тока |
4. В лабораторных условиях водород получают при взаимодействии некоторых металлов с кислотами (например, цинка с соляной кислотой) |
5. Масса 1 л водорода составляет 0,09 г |
6. При помощи стратостата, наполненного водородом, в 1933 г. русские стратонавты поднялись на высоту 19 км |
7. Относительная атомная масса водорода равна 1 |
8. Гремучий газ — это смесь, состоящая из двух объемов водорода и одного объема кислорода |
Как получают водород в лаборатории и промышленности? Какими способами собирают водород в сосуд? На каких свойствах водорода основаны эти способы? Задача: Какой объём водорода образуется при разложении 18 мл воды электрическим током?
III. Изучение новой темы
1. Химические свойства кислорода
Молекула водорода образована двумя атомами водорода. Чтобы водород вступил в химическую реакцию с другим веществом необходимо разрушить его молекулу до атомов (т. е. разрушить связь между атомами). Связь между атомами прочная. Чтобы разрушить эту связь нужно приложить немалую энергию. Например, чтобы превратить 1 г молекулярного водорода в атомарный нужно затратить такое количество энергии, которого хватило бы чтобы вскипятить 0,5 литров воды. Поэтому при обычных температурах водород вступает в реакцию только с очень активными веществами. Например, с металлом натрием и неметаллом фтором. В остальных случаях реакции идут при высокой температуре или при наличии катализатора.
- Горение водорода
2Н2+ О2 = 2Н2О
– чистый водород горит ровным голубым пламенем, при этом выделяется большое количество теплоты. Пламя водорода – это раскалённый пар. Водород можно использовать как топливо, причём экологически чистое, т. к. при его горении не образуется вредных веществ. Но пока не найдено дешёвого способа получения водорода, поэтому как топливо его широко не используют. Лишь в реактивных двигателях.
Смесь водорода с кислородом взрывается. Особенно сильный взрыв при отношении объёмов водорода и кислорода в смеси 2:1. Это так называемый «гремучий газ». Именно поэтому водород перед поджиганием необходимо проверять на чистоту. В пробирке этот взрыв безопасен. Если же взрыв произойдёт в сосуде с малым отверстием, то он разорвётся вдребезги, и осколки поранят окружающих.
- Получение аммиака
3Н2 + N2 = 2NH3
– аммиак в качестве раствора используют в медицине, в сельском хозяйстве для получения минеральных удобрений.
- Взаимодействие с металлами
– с активными металлами реакция идёт при комнатной температуре:
2К + Н2 = 2КН – гидрид калия
2Nа + Н2 = 2NаН – гидрид натрия
– с менее активными металлами реакция идёт при повышенной температуре:
2АI + 3Н2 = 2АIН3 (↑t) – гидрид алюминия
При взаимодействии водорода с металлами образуются гидриды.
- Взаимодействие с неметаллами
Н2 + F2 = 2НF – фтороводород
Н2 + СI2 = 2НСI – хлороводород
- Взаимодействие с оксидами металлов
Лабораторная работа
«Взаимодействие водорода с оксидом меди (II)»
Соберём прибор, как показано на рисунке. В пробирку поместим небольшое количество чёрного порошка оксида меди и будем пропускать над ним водород. Пробирку, в которой находится оксид меди (II) будем нагревать в пламени спиртовки.
В: Что наблюдаем?
– Через некоторое время на стенках пробирки появятся капельки воды, а чёрный порошок становится красным.
В: Что произошло? Давайте напишем уравнение реакции.
СuО + Н2 = Сu + Н2О
– в этой реакции произошёл процесс восстановления: водород отнял кислород от оксида меди и восстановил медь, т. е. медь выделилась в чистом виде.
Вещества, которые отнимают кислород от других веществ, относят к восстановителям.
2. Применение водорода
Применение водорода основано на его свойствах: лёгкость и свойства восстановителя. (Сообщение учащегося)
По ходу выступления учащиеся заполняют таблицу:
Свойства водорода | Применение водорода |
Самый лёгкий газ | Наполнение зондов для изучения атмосферы |
Горит в кислороде | Резка и сварка металлов |
Восстановление металлов из их оксидов | Получение некоторых металлов в чистом виде |
IV. Закрепление
С какими веществами взаимодействует кислород? При каких условиях идут многие реакции водорода с веществами? Почему? Чем является водород в химических реакциях? Водород можно перелить из одного сосуда в другой. Как это сделать? Как перелить кислород из одного сосуда в другой? Дана медная пластинка. Как её химическим путём обратить в порошок меди?
Источник
Часть 2.
Так как водород, фактически, не встречается на Земле в свободной форме, его вынуждены извлекать из прочих связанных соединений.
Одним из главных преимуществ водородной энергетики является большое разнообразие химических способов получения водорода.
Преимуществом тут является независимость от одного метода получения водорода, что благоприятно сказывается на энергетической безопасности всей концепции водородной энергетики.
Основными методами получения водорода являются:
1. паровая конверсия метана и природного газа;
2. газификация угля;
3. электролиз воды;
4. пиролиз;
5. частичное окисление;
6. биотехнологии.
Водород можно получать взаимодействием активных металлов с кислотами-неокислителями. Например, взаимодействием Цинка и Хлороводорода:
Zn + 2HCl = ZnCl2 + H2.
Как мы видим, взаимодействие Цинка с соляной кислотой даёт выход водорода. Существуют и другие способы подобного получения водорода. Например, взаимодействие алюминия с водными растворами щелочей и т.п. Однако, подобный способ подходит лишь для лабораторных исследований и демонстраций, потому что он очень дорогой.
Концепция водородной энергетики подразумевает промышленное производство водорода; массовость и дешевизна должны быть неотъемлемой частью всей концепции.
Промышленные способы добычи водорода:
1. Электролиз воды
Промышленная установка щелочного электролиза воды
Разберём его чуть подробнее, так как много всяких изобретателей пытаются использовать именно эту технологию.
Воздействуя на дистиллированную воду электрическим током, можно разложить её на составляющие – кислород и водород:
2H2O = 2H2 + O2.
«Впервые электролитическое разложение воды на кислород и водород было осуществлено в 1800 году, а промышленное освоение этого метода началось с 1888 года, когда стали доступны генераторы постоянного тока».
Электролиз воды – довольно дорогая технология получения водорода. В совокупности, на неё приходится всего 4-5% от общего произведённого объёма водорода.
Технология электролиза воды выглядит привлекательно в связи с экологической чистотой получения и возможности создания установок с широким диапазоном производительности (от нескольких литров до сотен кубометров водорода в час).
Способ прост и удобен в эксплуатации, обладает высокой чистотой производимого водорода. Дополнительно, побочным продуктом является получение кислорода – ценного химического вещества.
Но главное, электролиз водорода – очень перспективный метод экологически чистого получения водорода из возобновляемых или атомных источников энергии.
Я напомню, что концепция производства водородной энергетики и её дальнейшего развития в водородную экономику преследует именно экологическую чистоту.
Методов разложения воды для выделения водовода множество.
Основные из них:
- электрохимический;
- термический;
- термохимический;
- биохимический;
- фотохимический;
- электролитический.
Разумеется, наиболее проработанный и изученный метод – электролитический. Он позволяет производить водород с КПД до 90%.
Существуют три промышленных способа реализации электролизной технологии производства водорода. Они отличаются типом используемого электролита и условиями проведения электролиза.
Способы реализации электролизной технологии производства водорода
Щелочной электролиз — процесс прохождения электрического тока через раствор электролита от анода к катоду, вследствие чего на них образуются газы – соответственно, водород и кислород:
1. на аноде: 2OH– → 0,5O2 + H2O + 2e (выделение кислорода);
2. на катоде : 2H2O + 2e– → H2 + 2OH (выделение водорода);
3. суммарная реакция: H2O → H2 + 0,5O2.
Дальнейшим усовершенствованием технологии в области КПД и экономичности стала разработка электролизёров с твердо-полимерным электролитом (ТПЭ).
ТПЭ-электролизёры в 6 раз дороже водно-щелочных с аналогичными характеристиками, но при этом экологически чистые; имеют значительно меньшие массо-габаритные характеристики и энергозатраты, повышенный уровень безопасности, возможность работы в нестационарных режимах, простое обслуживание.
Основной элемент ТПЭ – беспористая полимерная мембрана перфторированного углерода, обладающая высокой химической стойкостью и высокой электропроводностью. Переносчиком заряда в таких мембранах является гидратированный протон:
1. на анод: H2O → O2 + 4H+;
2. на катод: 4H(+) + 4e(–) → 2H2.
Минимальная чистота получения водорода электролизом с ТПЭ – 99,98%.
Принципиальная схема электролизной ячейки с ТПЭ
Третий метод – высокотемпературный электролиз водяного пара. Проводится в ячейках с твёрдым электролитом на основе оксидов циркония, оксидов некоторых элементов (оксиды кальция, иттрия, иттербия, селена, ванадия) для увеличения его электропроводимости. Подобный электролит обладает униполярной проводимостью – ток через него переносится ионами кислорода, образующимися при диссоциации воды и выделении водорода на катоде:
Н2О (пар) + 2е → О2 + Н2 (газ) катод О 2(–) → 0,5 О2 (газ) + 2е.
Вывод водорода осуществляется из катодного пространства вместе с непрореагировавшим паром.
Принципиальная схема ячейки для высокотемпературного электролиза водяного пара с коаксиальным расположением электродов: 1 — катодное пространство ячейки; 2 — катод; 3 — твёрдый электролит на основе оксидов циркония; 4 — анод; 5 — анодное пространство ячейки
Независимо от способа реализации, основной вклад в стоимость водорода, производимого методом электролиза (70–90 %), вносят затраты на электроэнергию!
В комментариях к прошлой статьи читатель писал о якобы новом изобретённом им способе электролиза для получения водорода из морской воды. Но ничего нового тут нет. Смотрим формулу:
2NaCl + 2H2O = H2+ Cl2+ 2NaOH.
Ну это же элементарно, давно известно и вовсю применяется.
Для получения водорода из воды при электролизе требуется, как минимум, столько же энергии, сколько её выделяется при сгорании водорода. Однако не вся эта энергия должна поступать в виде электроэнергии — можно использовать в электролизёрах и тепловую энергию воды. Тут имеется энергетический баланс: чем выше её температура, тем больше вклад тепловой энергии и меньше вклад электрической. В ряде случаев это сулит немалую выгоду – можно использовать тепло от любого источника: скажем, от ядерного реактора. Особенно значительна экономия электроэнергии при температурах воды в районе тысячи градусов. Однако, в этих условиях сама вода переходит в пар, и снова потребуется твердый термостойкий электролит.
Многочисленные работы, в которых сделана попытка дать технико-экономическую оценку путей развития производства водорода на ближайшие годы, свидетельствуют о перспективности разрабатываемых электрохимических методов.
В перспективе можно ожидать, что параллельно с разработкой термических, термохимических, биохимических и других методов получения водорода из воды, начнутся интенсивные работы по усовершенствованию существующих и созданию более экономичных новых методов электролитического разложения воды на базе электрической энергии станций, работающих на атомной энергии. Одно из таких направлений уже разрабатывается – электролиз воды под давлением.
2. Паровая, или парокислородная конверсия метана (ПКМ).
Производство водорода методом риформинга конверсии метана
Метан – основной компонент природного газа, его концентрация в нём достигает от 77 до 99%. Высокое содержание метана и в попутных нефтяных газах – от 31 до 91%. Метан – это, фактически, большая молекула водорода, которая состоит из одного атома углерода и 4-х атомов водорода. Уже из химической формулы ясно, что метан «сильно обогащён» водородом. Следовательно, получение водорода именно из метана должно быть наиболее рентабельным.
Схема реактора паровой конверсии метана
Процесс отделения водорода от углеродной основы в метане протекает в трубчатых печах (химических паровых реформерах) с внешним подводом теплоты при температурах 750–850 градусов Цельсия через стенку трубы на каталитических поверхностях (никель, корунд и др.):
CH4+H2O ↔ CO+3H2;
далее с монооксидом углерода, или попросту «угарным газом», идёт реакция:
CO+H2O ↔ CO2+H2.
Это самый дешёвый и рентабельный способ получения водорода. Себестоимость процесса – от 2 до 5 долларов за 1 кг водорода!
В парокислородной конверсии вместе с горячим паром в активную зону реактора подаётся кислород. Реакции процесса аналогичные, что и для ПКМ, однако дополнительно происходит окисление метана кислородом:
CH4+O2 ↔ 2CO+3H2.
Реагирование веществ в парокислородной конверсии метана даёт общий результирующий тепловой эффект, равный нулю!
Это делает установку дороже на 5–10 %.
Главное преимущество парокислородной конверсии по сравнению с ПКМ — передача теплоты напрямую, а не через стенку теплообменника.
Сравнение характеристик ПКМ и парокислородной конверсии
В настоящий момент уже разработан высокоэффективный проточный мембранный аппарат для одновременного риформинга метана и окисления СО на никелевых и палладиевых катализаторах. Чистота водорода достигает 99,999 %, тогда как при конверсии природного газа — всего 76,2 %.
3. Газификация угля
Установка газификация угля
Самый старейшим с 1940-вых годов способом получения водорода является газификация угля. Справедливо встаёт вопрос: причём здесь уголь, ведь в его составе всего около 6% нужного нам газа? Однако, получение водорода из угля связано с термическим разложением воды, а сам уголь непосредственно используется в качестве энергоресурса и химического реагента. В угле много углерода, который и будет реагировать с кислородом, водой и угарным газом.
Воздействуя на уголь одновременно водяным паром и кислородом, получаем уже знакомую парокислородную конверсию.
Основные реакции процесса газификации угля:
C+O2 ↔ CO2;
C+2H2O ↔ CO2+2H2;
C+H2O ↔ CO+H2;
C+CO2 ↔ 2CO.
Существует большое количество способов газификации угля. Они отличаются термодинамическими параметрами, размером и принципом подачи угля в газогенератор, а также способом удаления шлака. Существует многоступенчатый процесс производства водорода железопаровым способом:
Fe3O4+CO ↔ 3FeO+CO2;
Fe3O4+H2 ↔ 3FeO+H2O.
Все рассмотренные методы – это автотермическое проведение реакций газификации, где в методе с CO2-акцептором осуществлён аллотермический подвод теплоты за счёт реакции СаО с двуокисью углерода. Далее, в регенераторе карбонат кальция разлагается термически:
CaO+CO2 ↔ CaCO3;
CaCO3 ↔ CaO+CO2.
Есть и классические процессы: Лурги, Копперс-Тотцека и Винклера.
Производство синтез-газа, в состав которого входят: водород, метан, окислы углерода и прочие газы – может быть также основано на переработке биомассы и промышленно-бытовых отходов, что одновременно способствует решению экологических проблем. Например, переработать отходы жизнедеятельности рогатого скота, да и вообще любого другого сельскохозяйственного животного.
При термохимической обработке биомассы её нагревают без доступа кислорода до температуры 500–800 градусов Цельсия, в результате чего образуются водород, метан и оксид углерода.
Для выделения водорода из синтез-газа используются разнообразные методы: адсорбция, абсорбция, диффузии через мембраны, электрохимическая конверсия, глубокое охлаждение, катализ.
Параметры методов газификации угля
Это основные, хорошо освоенные и изученные методы промышленного получения водовода. Однако все они дороги в сравнении с традиционной энергетикой. Водород – дорогое топливо. Поэтому его сегодня практически не используют (именно в качестве топлива).
Структура мирового производства (а) и потребления (б) водорода
Основными потребителями водорода являются химическая промышленность и нефтепереработка. Водород является ключевым элементом в производстве минеральных удобрений (получение аммиака).
Более половины потребляемого в мире водорода на сегодняшний день используется в качестве химического сырья. Раскисляющее действие водорода широко применяют в порошковой металлургии, металлообработке, производстве стекла, синтетических рубинов и т.п. Применение водорода в микроэлектронике, главным образом, связано с получением кремния путём восстановления SiCl4. Основным потребителем водорода как топлива является космонавтика. Комбинация «жидкий водород (топливо) — жидкий кислород (окислитель)» обеспечивает выделение максимального количества энергии на единицу веса, что является определяющим критерием для аэрокосмических приложений.
Существуют ли перспективные методы получения водорода, которые будут отличаться дешевизной и качеством? Такие существуют. И не только теоретические, но практические способы.
Например:
плазмохимический способ, который обещает быть в 15 раз дешевле электролизного;
хорошо проработанный способ получения водорода благодаря использованию ядерной энергетики (концепция атомно-водородной энергетики);
получение водорода с помощью альтернативных источников энергии;
усовершенствование методов электролиза воды;
способ использования вещества мантии Земли для получения водорода;
перспективы развития водородной энергетики на основе алюминия и т.д.
О некоторых перспективных способах поговорим в следующей статье.
Часть 3. Водородная энергетика: атомно-водородная технология
================================================================
P. S. Ссылки на источники теперь находятся в группе Вконтакте!
Часть 1. Водородная энергетика: когда наступит будущее?
Источник
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения – приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту – безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда – халат
- Наполняемость лабораторного лотка для ученика (13 шт.)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.
- Проблемно-поисковый.
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:

На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:
Ознакомление с планом урока. I.

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:

Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой

Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы

1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
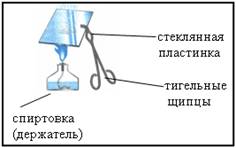
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
Что наблюдается?
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI. Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
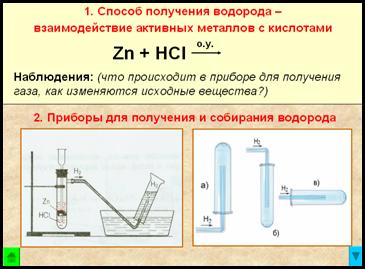
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q – при обычных условиях
Наблюдения:
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
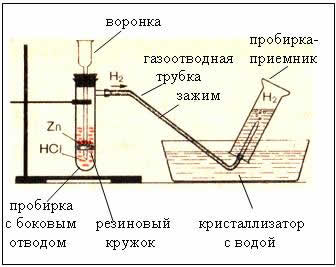
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
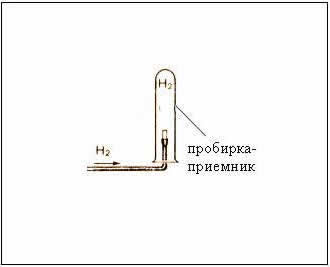
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
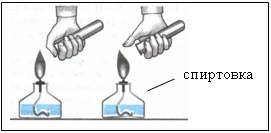
Наблюдения:
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
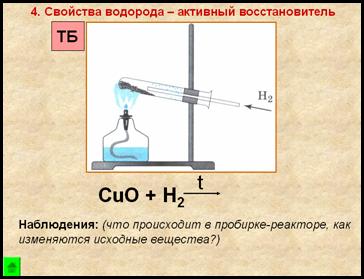
4. Свойство водорода – активный восстановитель
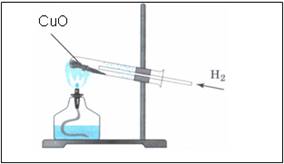
Наблюдения:
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Источник
