На каких свойствах основано применение водорода

 Водород при обыкновенной температуре — бесцветный газ, не имеющий запаха. При температуре ниже минус 240° водород под давлением может быть превращен в бесцветную жидкость.
Водород при обыкновенной температуре — бесцветный газ, не имеющий запаха. При температуре ниже минус 240° водород под давлением может быть превращен в бесцветную жидкость.
Если быстро испарять эту жидкость, то получается твердый водород в виде прозрачных кристаллов, плавящихся при минус 259,4°.
Водород самый легкий из всех газов, он почти в 141/2 раз легче воздуха. Литр водорода при нормальных условиях весит только 0,09 г.
В воде водород растворим очень мало, но растворяется взначительном количестве внекоторых металлах, например впалладии, платине и др. Один объем палладия может растворить до 900объемов водорода.
Рис. Схема строения молекулы водорода
Строение молекулы водорода
Молекула водорода состоит из двух атомов, связь между которыми осуществляется парой электронов, вращающихся вокруг ядер обоих атомов. Строение молекулы водорода (рис.) аналогично строению атома гелия, вследствие чего при обыкновенной температуре водород инертен. При более высоких температурах связь между атомами ослабляется и водород становится активным.
Из физических свойств водорода особенный интерес представляет его теплоемкость, которая при низких температурах значительно меньше, чем следовало бы ожидать на основании кинетической теории газов. Это явление объясняется существованием двух модификаций водорода, получивших название ортоводород и параводород.
Обе модификации состоят из одних и тех же молекул Н2 и имеют одинаковые химические свойства, но их физические свойства, как, например, удельная теплоемкость, точки плавления и кипения и др., несколько различны. Причина различия заключается в том, что водородные ядра (протоны), входящие в состав молекул Н2 и обладающие собственным вращением вокруг своих осей, трёх частей ортоводорода и одной части параводорода, находящихся в равновесии друг с другом.
Понижение температуры смещает равновесие в сторону образования параводорода, а так как его теплоемкость меньше теплоемкости ортоводорода, то с увеличением содержания параводорода в смеси общая ее темплоемкость уменьшается.Химические свойства водорода определяются способностью его атомов отдавать единственный имеющийся у них электрон и превращаться в положительно заряженные ионы.
Однако полностью такое превращение не происходит, так как даже при взаимодействии водорода с наиболее активными металлоидами образуются не ионные, а полярные ковалентные связи. Иногда атомы водорода сами присоединяют электроны, переходя в отрицательно заряженные ионы Н— с оболочкой инертного газа гелия. В виде таких ионов водород находится в соединениях с некоторыми наиболее активными металлами (К, Na, Са и др.).
Эти соединения называются гидридами металлов и, в отличие от газообразных соединений водорода с металлоидами, представляют собой твердые кристаллические вещества (подробнее о гидридах смотри при описании соответствующих металлов). Если к струе водорода, выходящей из какого-нибудь узкого отверстия, поднести зажженную спичку, то водород загорается и горит несветящимся пламенем. Продуктом горения является вода:
2Н2 + О2 = 2Н2О + 136,8 ккал
 Рис. 2. Горелка для гремучего газа
Рис. 2. Горелка для гремучего газа
При поджигании смеси двух объемов водорода с одним объемом кислорода соединение газов происходит почти мгновенно во всей массе смеси и сопровождается сильным взрывом. Поэтому такая смесь называется гремучим газом.
Вследствие выделения при горении водорода большого количества тепла температура водородного пламени довольно высока (~1000°).
Но особенно высокая температура, достигающая 2500—3000°, получается при введении в водородное пламя избытка кислорода. Для получения такого пламени пользуются специальной горелкой (рис. 2), состоящей из двух трубок разного диаметра, вставленных одна в другую. В пространство между стенками трубок впускают водород и зажигают его у выходного отверстия.
После этого по внутренней трубке начинают осторожно вводить в водородное пламя струю кислорода.Оба газа смешиваются у отверстия горелки и дают очень горячее пламя, в котором легко расплавляются почти все металлы, даже самые тугоплавкие. Железная или стальная проволока, внесенная в такое пламя, сгорает в нем, как в кислороде, разбрасывая во все стороны блестящие искорки.
Если направить пламя на кусок извести, то он накаливается добела и испускает ослепительно яркий свет. Водородно-кислородным пламенем пользуются для плавления тугоплавких металлов, для так называемой автогенной сварки, для резания и сверления металлов пламенем.
Реакция водорода с кислородом
При обыкновенной температуре водород с кислородом практически не взаимодействуют. Если смешать оба газа и оставить их в стеклянном сосуде, то и через несколько лет в сосуде нельзя обнаружить даже признаков воды.
Если же смесь водорода с кислородом поместить в запаянный сосуд и держать в нем при 300°, то уже через несколько дней образуется немного воды. При 500° водород полностью соединяется с кислородом за несколько часов, а при нагревании смеси до 700° происходит быстрый подъем температуры и реакция заканчивается мгновенно. Поэтому, чтобы вызвать взрыв смеси, нужно нагреть ее хотя бы в одном месте до 700°
Отсутствие заметной реакции между водородом и кислородом при обыкновенной температуре объясняется тем, что в этих условиях скорость реакции чрезвычайно мала. Принимая, что с понижением температуры на каждые 10° скорость реакции уменьшается в два раза, нетрудно рассчитать, что если при 300° заметное количество воды образуется лишь через 3 дня, то при обыкновенной температуре (20°) для этого потребовалось бы более двух миллионов лет.
Применение катализатора может сильно увеличить скорость взаимодействия водорода с кислородом. Внесем, например, кусочек платинированного (т. е. покрытого мелко раздробленной платиной) асбеста в смесь водорода с кислородом. Взаимодействие между газами настолько ускоряется, что через короткое время происходит взрыв.
При высокой температуре водород может отнимать кислород от многих соединений, в том числе от большинства металлических окислов, освобождая металл. Например, если пропускать водород над накаленной окисью меди, то происходит реакция
СuО + Н2 = Сu + Н2О
Процесс присоединения кислорода к металлу называется окислением, обратный же процесс, при котором от окисла отнимается кислород и таким образом снова освобождается металл, получил название восстановления.
Присоединение водорода к какому-нибудь веществу также называется восстановлением или гидрированием.
Не только водород, но и некоторые другие вещества, как, например, уголь, могут отнимать кислород от различных соединений. Все такие вещества называются восстановителями. Водород является одним из наиболее энергичных восстановителей.
Применение водорода
Водород используется при синтезе ряда важнейших химических продуктов. Его применяют в огромных количествах для синтеза аммиака, идущего в свою очередь на производство азотной кислоты и азотных удобрений, для получения синтетического моторного топлива, для так называемой гидрогенизации жиров (превращение жидких растительных жиров в твердые), для синтеза спиртов (метилового и др.).
Водород используют также для восстановления некоторых цветных металлов из их окислов и для наполнения аэростатов. Жидким водородом (точка кипения —252,7°) пользуются иногда для получения низких температур.
66 67 68
Вы читаете, статья на тему Свойства и применение водорода
Источник
Анонимный вопрос
16 декабря 2018 · 13,2 K
Получил математическое и богословское образование. Есть дети, соответсвенно и…
Водород широко применяется в нефтепереработке – с его помощью из различных нефтепродуктов удаляются соединения серы. Большой объём этого газа используется для получения аммиака (необходимого, например, для производства удобрений). Также реакция водорода с хлором даёт хлороводород, водный раствор которого известен нам как соляная кислота. С помощью водорода также осуществляется восстановление металлов из их оксидов. Этот газ – важная составляющая при производстве метилового спирта.
Водород используется и в пишевой промышленности – для производства маргарина из растительных масел.
Температура сгорания водорода в кислороде – около 3000 градусов, а в специальных горелках её можно довести и до 4000. Поэтому водород используется для сварки тугоплавких металлов. Также жидкий водород – ракетное топливо.
При сгорании водород образует безопасный водяной пар, поэтому в перспективе он может стать экологичным топливом для автомобилей. Правда в настоящий момент его использование невозможно из-за многих технических ограничений.
Применяется он очень широко, все и не описать. Большая часть (около 54%) уходит на проихводство аммиака и метанола, которые нужны для поизводства пластмасс, удобрений и взрывчатки. Еще 35% тратят при переработки нефти. Остальное приходится на: пищевую, косметическую, авиационную промышленность, производство электроники, охлаждение мощных электрогенера… Читать далее
Да знаю
Реально водородсодержащих газ можно получить в специализированной установке, автор которого изобретатель Г.Г.Аракелян. Он успешно эксплуатирует у себя на производстве сушки ЖБК эти установки. Смотрите в Ютубе
Широкого применения в РФ его изобретение не применяется по известной причине.
.
Как работает водородное топливо?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
В зависимости от того как его использовать, возможен вариант прямого сжигания водорода, тогда процесс представляет собой традиционную тепловую машину, удельная теплота сгорания водорода самая высокая из всех известных топлив: 140 и 120 МДж/кг верхняя и низшая соответственно (Для сравнения у метана – 50 МДж/кг).
Проблема в том, что окислителем все равно является кислород, и возможно образование гремучей смеси.
При комнатной температуре водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Как следствие низкий ресурс такой энергоустановки.
Другое применение – топливный элемент.
Там происходит прямое превращение энергии водорода в электрическую, причем в твердполимерных топливных элементах это происходит при температуре 40 – 60 градусов Цельсия.
Принципиальная схема представлена выше. В одну из камер подается водород (анодная камера) там происходит электроокисление водорода, при это электрон идет по внешней цепи, катион проходит через твердполимерный электролит, где в катодной камере (туда подают кислород) восстанавливается до воды. Реакции представлены ниже:
- на аноде: 2H2 – 4е → 4H+ ;
- на катоде: O2 + 4H+ + 4e— → 2H2O.
Суммарная реакция: 2H2 + O2 → 2H2O.
Недостатки таких систем: катализатором реакции окисления водорода являются металлы платиновой группы, а лучше всего сама платина, которая является весьма дорогой.
Такие энергоустановки не любят переменных графиков нагрузки, а сам водород должен быть высокой чистоты.
Правда ли, что водородные топливные ячейки – это тупиковая ветвь технологии, потому что у баллона с водородом слишком низкая удельная энергетическая ёмкость?
Researcher, Institute of Physics, University of Tartu
Правда то, что хранение водорода в баллонах – это тупиковая ветвь для водородных топливных ячеек 🙂 И даже не в связи с емкостью в расчете на вес баллона, а в связи с огромными проблемами с безопасностью. Если баллон, значит, забудьте о машинах, забудьте о жилых помещениях и бытовой технике и т.д.
В связи с этим, сейчас разрабатываются кучи технологий по а) способам получения водорода “на месте” из каких-то менее опасных реагентов, б) различным альтернативным способам хранения водорода. Ветвь исследований а) как самостоятельная сейчас несколько утратила популярность в связи с высокими энергозатратами на выделение водорода. В некоторой степени она слилась с ветокой б), поскольку точную грань между прочным физическим связыванием и химическим связыванием провести трудно. Таким образом, основная задача выглядит так: как найти способ хранения водорода а) безопасный, б) рециклируемый (чтобы можно было заряжать много раз), в) достаточно емкий, г) с низкими энергозатратами на извлечение водорода и во многих случаях – д) быстрой загрузкой водорода после разрядки.
Направления исследования – гидриды (металлов и неметаллов, например, бора), пористые матрицы типа цеолитов или аэрогелей, клатраты на основе льда или льдообразных материалов (достаточно экзотическая штука, но потенциально дают возможность 100% извлечения при комнатной температуре), полимерные матрицы и многое другое. Хорошего во всех отношениях решения на данный момент, насколько я знаю, нет, хотя есть уже даже промышленные технологии хранения на основе гидридов металлов и на основе пористых материалов. Там основная проблема, насколько я понимаю, высокая энергия извлечения и рециклируемость (в первый раз извлекаете 85%, второй 85% от 85% и т.д.).
Прочитать ещё 1 ответ
Есть ли будущее у автомобилей, работающих на водороде?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
Машины, работающие на водороде, называют Fuel Cell Electric Vehicles или FCEV, на автомобильном рынке уже представлено несколько подобных решений. Конкретные коммерческие модели: Toyota Mirai и Honda FCX Clarity. Такая машина имеет так называемый топливный элемент (электрохимический генератор), являющийся своеобразной “батарейкой”, в которую поступает водород, после чего он окисляется и в результате на выходе мы имеем чистый водяной пар с нулевым содержанием углекислого газа. В остальном здесь все практически так же, как в обычном электромобиле, но в случае с водородной установкой используется куда более компактная батарея – емкость литий-ионного аккумулятора в водородных автомобилях в 10 раз меньше, поскольку он используется только для холодного старта и буферизации энергии, полученной при рекуперативном торможении.
По оценкам Hydrogen council (совет по водородным технологиям), к 2050 году мировой рынок водорода будет составлять порядка 18% от общего спроса на электроэнергию. При этом в транспортном секторе количество легковых автомобилей на водородном топливе составит 400 млн, 15-20 млн грузовых и 5 млн автобусов.
Китай планирует к 2030 году установить 1000 водородных заправочных станций, обслуживающих более 1 млн FCEV.
Так же активно инвестируют в водородную инфраструктуру Южная Корея, ведь всю страну можно пересечь на одном баке водорода.
В следующем году в Токио будет проходить олимпиада, японское правительство пообещало, что вся инфраструктура будет обслуживаться исключительно водородным топливом, уже переданы первые два автобуса на с топливным элементом на борту.
Несмотря на дешевизну ископаемого топлива, многие страны обделены природными ископаемыми, это вынуждает их отказаться от экспортного ископаемого топливо во благо энергетической безопасности страны, тот же водород можно получать дорогим способом электролиза воды – разложением воды на водород и кислород
Так же в мире появляется все больше компаний, которые внедряют водородные технологии в промышленность, и даже в некоторых случаях (Твердооксидные топливные элементы) создаются целые электрические станции, работающие на водородном топливе.
Прочитать ещё 2 ответа
В каких сферах невозможно использование водородной энергетики?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
Невозможно в тех местах, где водород просто не откуда взять. Например, пустыня – там нет источников воды для электролиза, и по понятным причинам туда никто не будет тянуть газопровод для использования паровой конверсии (еще один процесс получения водорода)
А так водородная энергетика в наше время довольно дорогое удовольствие, и будет бесмысленно там где есть дешевый источник электрической энергии, я бы скорее рассматривал водородную энергетику в рамках России как Арктическую технологию, или автономный энергетический комплекс в тех местах где вообще ничего кроме воды нет
Почему до сих пор нет автомобилей на воде? Расщипляем воду на водород и кислород — водород жжём, а кислород в атмосферу.
урофренолог, селахиодермист
Тут есть две больших проблемы. Во-первых, кислородно-водородная связь в воде очень сильна, все известные методики разделения сопряжены с куда большими затратами энергии, чем получается при обратном сожжении.
Во-вторых, у водорода очень низкая плотность, это убивает всю выгоду. Электромобили до сих пор не прижились в первую очередь из-за крайне малой массовой эффективности. У бензина плотность энергии — 46 мегаджоулей на килограмм, а у лучших аккумуляторов — около единицы. То есть чтобы обеспечить тот же пробег на той же мощности — надо везти с собой в полсотни раз больше батареек, чем бензина. У водорода этот показатель намного хуже. Обычный баллон 50л/200бар весит около 90 килограмм, а входит в него менее 900 грамм водорода.
Кроме того, водород весьма взрывоопасен.
Источник
Современную промышленность сложно представить без применения технических газов на различных этапах производства. На сегодняшний день водород входит в тройку наиболее востребованных промышленностью газов, уступая лишь кислороду и азоту.
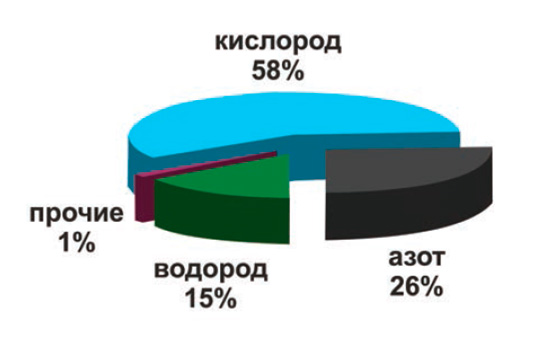 |
| Структура производства промышленных газов в России, % |
Водород относится к числу важнейших видов сырья химической и нефтехимической промышленности. Свойства этого газа обуславливают его применение и в других отраслях промышленности: металлургической, пищевой, стекольной, электронной, электротехнической.
Структура потребления водорода в России в 2013 г.
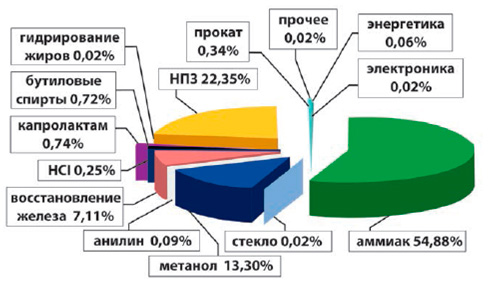
| Аммиак | 54,88% |
| Нефтеперерабатывающие заводы | 22,35% |
| Метанол | 13,30% |
| Восстановление железа | 7,11% |
| Капролактам | 0,74% |
| Бутиловые спирты | 0,72% |
| Прокат | 0,34% |
| HCl | 0,25% |
| Анилин | 0,09% |
| Энергетика | 0,06% |
| Гидрогенизация жиров | 0,02% |
| Электроника | 0,02% |
| Стекло и керамика | 0,02% |
| Прочее | 0,02% |
Перейти в раздел «Водородные компрессоры»
Химическая промышленность
В России основная область потребления водорода – производство химических продуктов, прежде всего аммиака и метанола.
Лидерами по потреблению водорода являются предприятия, производящие аммиак NH
3
. Сейчас на 28 предприятиях в России используется 2,46 млн.т. водорода в год.
Потребление водорода при синтезе метанола CH
3
OH составило 0,6 млн.т. в 2013 г.
Потребление водорода в остальных сегментах химической промышленности не превышает 90 тыс.т. – 3% от объема потребления.
Нефтеперерабатывающая промышленность
Повышается потребность НПЗ в водороде, необходимом для получения топлив из тяжелого высокосернистого сырья. Огромное количество водорода требуется для установок гидрообессеривания, гидрокрекинга дистиллятов, гидроочистки, изомеризации, производств смазочных материалов. Кроме того, водород на НПЗ используется для активации катализаторов риформинга и регенерации катализаторов изомеризации.
Металлургия
Основной областью применения водорода в металлургии является производство металлизированного сырья методом прямого восстановления железа. Сейчас в этом процессе потребляется около 320 тыс.т. водорода.
Значительные объемы водорода расходуются в технологических процессах прокатного производства (при термической обработке холоднокатаного проката). Потребление водорода – около 15 тыс.т. в год.
Водород на металлургических предприятиях используется также для создания защитной азотно-водородной атмосферы при термообработке труб.
Стекольная промышленность
В стекольной промышленности водород применяется при производстве листового стекла float-методом, а также для получения кварцевого стекла, которое изготавливают плавлением чистого горного хрусталя, кварца или синтетического оксида кремния в водородно-кислородном пламени.
Энергетика
В энергетике водород используется для охлаждения мощных турбогенераторов, благодаря его высокой теплопроводности и коэффициенту диффузии, а также нетоксичности. По оценкам, в энергетике на ТЭЦ, АЭС потребляется около 4-5 тыс.т. водорода в год.
Пищевая промышленность
В пищевой промышленности водород используется в процессах гидрогенизации масел и жиров при получении твердых жиров (маргарина). Объем потребления водорода масложировыми комбинатами оценивается на уровне 1,5 тыс.т. в год.
Среди прочих потребителей водорода – обогатительные комбинаты, заводы, занимающиеся фабрикацией ядерного топлива, предприятия электронной и электротехнической промышленности, транспортные и газовые компании, фармацевтика.
Источник
