Можно ли по физическим свойствам вещества определить какое строение

ГДЗ к § 08. Вещества молекулярного и немолекулярного строения
| 12.05.2019, 15:45 | |||||||
| Внимание! Если скачанный файл открывается с ошибкой, то попробуйте открыть его на другом устройстве или в облаке. Если ничего не помогло, то напишите нам. | |||||||
Подумай, ответь, выполни…
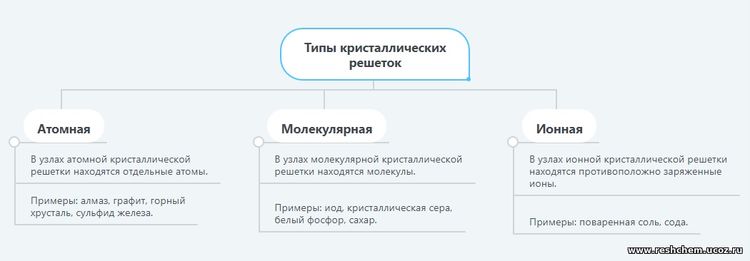
1. Приведите примеры веществ с молекулярным и немолекулярным строением. Как эти вещества различаются по свойствам? Вещества молекулярного строения: кислород, водород, азот, углекислый газ, вода, спирт, эфир, сера, белый фосфор. Вещества немолекулярного строения: сульфид железа, поваренная соль, алюминий, медь, железо. Вещества с молекулярным строением имеют низкие температуры плавления и кипения, часто летучи и имеют запах. При обычных условиях – это газы, жидкости или легкоплавкие твердые вещества. Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твердые, нелетучие и не имеют запаха. 2. Обсудите с соседом по парте вопрос, можно ли по физическим свойствам вещества определить, какое строение оно имеет – молекулярное или немолекулярное. По физическим свойствам вещества можно определить, какое строение оно имеет – молекулярное или немолекулярное. Если вещество имеет низкую температуру плавления и кипения, летучее или имеет запах, при обычных условиях является газом, жидкостью или легкоплавким твердым веществом, то, как правило, это вещество имеет молекулярное строение. Например, при обычных условиях аммиак – газ с резким запахом, спирт – летучая жидкость с характерным запахом, парафин и сахар – легкоплавкие твердые вещества. Следовательно, аммиак, спирт, парафин и сахар имеют молекулярное строение. Если вещество имеет высокую температуру плавления и кипения, является твердым, нелетучим и не имеет запаха, то, как правило, это вещество имеет немолекулярное строение. Например, поваренная соль, железо, графит – твердые тугоплавкие вещества, не имеющие запаха. Следовательно, поваренная соль, железо и графит имеют немолекулярное строение. 3. Какие типы кристаллических решеток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решетки. Составьте схему “Типы кристаллических решеток”.
4. Углекислый газ при нормальном давлении переходит в твердое состояние при температуре около -70 ºС, а речной песок (кремнезем) плавится при температуре около 1700 ºС. Какие выводы о строении этих веществ в твердом состоянии можно сделать? Так как углекислый газ при обычных условиях находится в газообразном состоянии, а в твердое состояние переходит при низкой температуре, следовательно, в твердом состоянии он имеет молекулярное строение. Так как оксид кремния при обычных условиях находится в твердом состоянии, а плавится при очень высокой температуре, следовательно, в твердом состоянии он имеет немолекулярное строение.
| |||||||
| Решебник: Рудзитис Г. Е., Фельдман Ф. Г. Химия. 8 класс: учебник | |||||||
| Просмотров: 1358 | |||||||
Онлайн всего: 2
Гостей: 2
Пользователей:
Источник
Вещества могут существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Например, существует водяной пар (вода в газообразном агрегатном состоянии), жидкая вода и лёд (вода в твёрдом агрегатном состоянии).
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. Частицы в газообразных веществах движутся с очень большими скоростями и неупорядоченно (хаотически).
В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. Скорость хаотического перемещения частиц в жидкостях намного меньше, чем в газах.
Частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Кристаллические вещества. Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Кристаллы соли, сахара, серы, горного хрусталя, алмаза также имеют геометрически правильную форму.
Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
В зависимости от того, какие частицы находятся в узлах этой решётки, различают атомные, молекулярные и ионные кристаллические решётки.
Атомные кристаллические решётки. В узлах атомных кристаллических решёток находятся отдельные атомы. Эти атомы могут располагаться в пространстве по-разному, поэтому и форма кристаллов бывает различной. Например, в узлах кристаллических решёток алмаза и графита находятся атомы углерода, но из-за различного расположения атомов кристаллы алмаза и графита имеют разную форму.
Молекулярные кристаллические решётки. В узлах молекулярных кристаллических решёток находятся молекулы. Например, в узлах кристаллической решётки иода находятся молекулы иода .
Ионные кристаллические решётки. Такие решётки характерны для ионных соединений. В узлах ионных решёток находятся противоположно заряженные ионы. Типичными представителями ионных соединений являются соли. Например, в узлах кристаллической решётки хлорида натрия (поваренной соли) находятся ионы натрия и хлорид-ионы .
В хлориде натрия ионы находятся на одинаковых расстояниях друг от друга, образуя кристаллы кубической формы. В кристаллах поваренной соли отдельных молекул хлорида натрия не существует.
Аморфные вещества. Существует достаточно много твёрдых веществ, частицы которых, подобно частицам в газах и жидкостях, расположены неупорядоченно (хаотически). Такие вещества называют аморфными. Свойства кристаллических и аморфных веществ существенно различаются. Например, если любое кристаллическое вещество имеет определённую температуру плавления, то аморфные вещества её не имеют.
Различить кристаллические и аморфные вещества можно, если их подвергнуть механическому воздействию: например, ударить молотком. Если аккуратно разбить кусочки поваренной соли, серы или графита, то можно заметить, что они раскалываются на мелкие кристаллы, имеющие определённую форму. Так ведут себя кристаллические вещества. Аморфные вещества, например стекло, при ударе рассыпаются на осколки, не имеющие определённой формы.
Вещества молекулярного и немолекулярного строения. Все вещества можно разделить на две большие группы: вещества, имеющие молекулярное строение, и вещества с немолекулярным строением.
Вещества, которые состоят из молекул, — это вещества МОЛЕКУЛЯРНОГО СТРОЕНИЯ.
Вещества, которые состоят из атомов или ионов, относят к веществам НЕМОЛЕКУЛЯРНОГО СТРОЕНИЯ.
Кристаллическая решётка хлорида натрия:
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах. Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Можно ли по физическим свойствам вещества определить, какое строение оно имеет — молекулярное или немолекулярное? Вещества с молекулярным строением при обычных условиях — это газы (кислород, водород, азот и др.), жидкости (вода, спирт, эфир и др.) или легкоплавкие твёрдые вещества, такие, как кристаллическая сера (температура плавления около 113 °C) или белый фосфор (температура плавления 44 °C).
Источник
Ê ôèçè÷åñêèì ñâîéñòâàì âåùåñòâà ïðèíÿòî îòíîñèòü òå, êîòîðûå ôèêñèðóþòñÿ íàáëþäåíèåì ëèáî èçìåðåíèåì, áåç ïåðåõîäà â èíîå âåùåñòâî.
Íàèáîëåå ñóùåñòâåííûå ôèçè÷åñêèå ñâîéñòâà âåùåñòâà:
– àãðåãàòíîå ñîñòîÿíèå ïðè îïðåäåëåííûõ òåìïåðàòóðå è äàâëåíèè;
– çàïàõ (èëè åãî îòñóòñòâèå);
– öâåò, áëåñê (èëè èõ îòñóòñòâèå);
– ïëîòíîñòü;
– òåïëîïðîâîäíîñòü;
– ýëåêòðîïðîâîäíîñòü (èëè íå ýëåêòðîïðîâîäíîñòü).
– ðàñòâîðèìîñòü (èëè íåðàñòâîðèìîñòü) â âîäå;
– òåìïåðàòóðà ïëàâëåíèÿ;
– òåìïåðàòóðà êèïåíèÿ;
Ñïèñîê ôèçè÷åñêèõ ñâîéñòâ òâåðäûõ âåùåñòâ ìîæíî óâåëè÷èòü äîáàâèâ òâåðäîñòü, ïëàñòè÷íîñòü (èëè õðóïêîñòü), à äëÿ êðèñòàëëè÷åñêèõ — äîïîëíèòåëüíî è ôîðìó êðèñòàëëîâ. Îïèñûâàÿ ñâîéñòâà æèäêîñòè, óêàçàòü ïîäâèæíàÿ îíà ëèáî ìàñëÿíèñòàÿ.
Âèçóàëüíî ïîëó÷èòñÿ îöåíèòü ñëåäóþùèå ôèçè÷åñêèå õàðàêòåðèñòèêè: öâåò, çàïàõ, âêóñ, ôîðìó êðèñòàëëîâ. Ïëîòíîñòü, ýëåêòðîïðîâîäíîñòü, òåìïåðàòóðó ïëàâëåíèÿ è êèïåíèÿ ôèêñèðóþò, âûïîëíèâ çàìåðû. Äàííûå î ôèçè÷åñêèõ ñâîéñòâàõ áîëüøèíñòâà âåùåñòâ ñèñòåìàòèçèðîâàíû â ïðîôèëüíûõ ñïðàâî÷íèêàõ.
Ôèçè÷åñêèå ñâîéñòâà âåùåñòâà îáóñëîâëåíû àãðåãàòíûì ñîñòîÿíèåì. Ê ïðèìåðó, ïëîòíîñòü ëüäà, âîäû è âîäÿíîãî ïàðà ðàçíûå âåëè÷èíû. Ó ãàçîîáðàçíîãî êèñëîðîäà öâåò îòñóòñòâóåò, à ó æèäêîãî îí ãîëóáîé.
Çíàíèå ôèçè÷åñêèõ ñâîéñòâ ñïîñîáñòâóåò îïðåäåëåíèþ íåìàëîãî ÷èñëà âåùåñòâ. Ê ïðèìåðó, óíèêàëüíîñòü ìåäè â òîì, ÷òî îíà åäèíñòâåííûé ìåòàëë êðàñíîãî öâåòà. Èñêëþ÷èòåëüíîñòü ïîâàðåííîé ñîëè – åå ñîëåíûé âêóñ. Öâåò òâåðäîãî éîäà áëèçîê ê ÷åðíîìó, ïðè íàãðåâå îí ñòàíîâèòüñÿ òåìíî-ôèîëåòîâûì ïàðîì.  ïðåîáëàäàþùåì ÷èñëå ñèòóàöèé äëÿ òîãî ÷òîáû «óãàäàòü» âåùåñòâà òðåáóåòñÿ àíàëèçèðîâàòü ñîâîêóïíîñòü õàðàêòåðíûõ îñîáåííîñòåé.
Êàëüêóëÿòîðû ïî ôèçèêå | |
| Ðåøåíèå çàäà÷ ïî ôèçèêå, ïîäãîòîâêà ê ÝÃÅ è ÃÈÀ, ìåõàíèêà òåðìîäèíàìèêà è äð. | |
| Êàëüêóëÿòîðû ïî ôèçèêå | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå âåùåñòâà | |
| Ìîëåêóëÿðíîå ñòðîåíèå âåùåñòâ, ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà âåùåñòâ, ñòðîåíèå âåùåñòâà. | |
| Õèìè÷åñêèå âåùåñòâà | |
Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó ôèçèêè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Âåùåñòâî. Õèìè÷åñêèå ñâîéñòâà. | |
| Õèìè÷åñêèå ñâîéñòâà — óìåíèå âåùåñòâ ( õèìè÷åñêèõ ýëåìåíòîâ , ïðîñòûõ âåùåñòâ è õèìè÷åñêèõ ñîåäèíåíèé ) âçàèìîäåéñòâîâàòü ñ èíûìè âåùåñòâàìè ëèáî âèäîèçìåíÿòüñÿ ïîä âîçäåéñòâèåì íåêîòîðûõ ôàêòîðîâ. | |
| Âåùåñòâî. Õèìè÷åñêèå ñâîéñòâà. | |
Источник
Об
атомах и химических элементах
Другого
ничего в природе нет
ни
здесь, ни там, в космических глубинах:
все
— от песчинок малых до планет —
из
элементов состоит единых.
С.
П. Щипачев, «Читая Менделеева».
В
химии кроме терминов “атом” и “молекула” часто
употребляется понятие “элемент”. Что общего и чем эти понятия различаются?
Химический
элемент – это
атомы одного и того же вида. Так, например, все атомы водорода –
это элемент водород; все атомы кислорода и ртути – соответственно элементы
кислород и ртуть.
В
настоящее время известно более 107 видов атомов, то есть более 107 химических
элементов. Нужно различать понятия “химический элемент”, “атом” и “простое
вещество”
Простые
и сложные вещества
По
элементному составу различают простые вещества, состоящие из атомов
одного элемента (H2, O2, Cl2, P4,
Na, Cu, Au), и сложные вещества, состоящие из атомов разных
элементов (H2O, NH3, OF2, H2SO4,
MgCl2, K2SO4).
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ | |
МЕТАЛЛЫ | НЕМЕТАЛЛЫ |
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ | |
Железо Fe, медь Cu, алюминий Al, ртуть Hg, золото Au, серебро Ag и другие | Уголь С, сера S, фосфор P, йод I2, кислород O2, водород H2 и другие. |
1. Твёрдое агрегатное состояние (исключение – ртуть) 2. Металлический блеск 3. Хорошие проводники тепла и электричества. 4. Пластичные и ковкие. | 1. Твёрдые (Уголь С, сера S, фосфор P, йод I2), жидкие (бром Br2) и газообразные (кислород O2, водород H2). 2. Металлическим блеском не обладают (исключение йод) 3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ. 4. Хрупкие |
На
2019 год в периодической таблице – 118 химических элементов, которые
образуют около 500 простых веществ.

Самородное
золото – простое вещество
Способность
одного элемента существовать в виде различных простых веществ, отличающихся по
свойствам, называется аллотропией. Например, элемент кислород O
имеет две аллотропные формы – кислород O2 и
озон O3 с различным числом атомов в молекулах. Аллотропные
формы элемента углерод C – алмаз и графит – отличаются строение их кристаллов. Существуют
и другие причины аллотропии.
| Название элемента | Аллотропные формы | Пример простого вещества |
| Углерод С | Графит
|
|
| Углерод С |
|
Сложные
вещества часто называют химическими соединениями, например, оксид
ртути(II) HgO (получается путем соединения атомов простых веществ – ртути Hg и
кислорода O2), бромид натрия (получается путем соединения атомов
простых веществ – натрия Na и брома Br2).
Итак,
подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые –
молекулы таких веществ состоят из атомов одного вида. В химических реакциях не
могут разлагаться с образованием нескольких более простых веществ.
2. Сложные –
молекулы таких веществ состоят из атомов разного вида. В химических реакциях
могут разлагаться с образованием более простых веществ.
Различие
понятий “химический элемент” и “простое вещество”
Отличить
понятия “химический элемент” и “простое вещество” можно
при сравнении свойств простых и сложных веществ. Например, простое вещество
– кислород – бесцветный газ, необходимый для дыхания,
поддерживающий горение. Мельчайшая частица простого вещества кислорода –
молекула, которая состоит из двух атомов. Кислород входит также в состав оксида
углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит
химически связанный кислород, который не обладает свойствами простого вещества,
в частности он не может быть использован для дыхания. Рыбы, например, дышат не
химически связанным кислородом, входящим в состав молекулы воды, а свободным,
растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических
соединений, следует понимать, что в эти соединения входят не простые вещества,
а атомы определенного вида, то есть соответствующие элементы.
При
разложении сложных веществ, атомы могут выделяться в свободном состоянии и
соединяясь, образовывать простые вещества. Простые вещества состоят из атомов
одного элемента. Различие понятий «химический элемент» и «простое вещество»
подтверждается и тем, что один и тот же элемент может образовывать несколько
простых веществ. Например, атомы элемента кислорода могут образовать
двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно
различные простые вещества. Этим объясняется тот факт, что простых веществ
известно гораздо больше, чем химических элементов.
Пользуясь
понятием «химический элемент», можно дать такое определение простым и сложным
веществам:
Простыми
называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными
называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие
понятий «смесь» и «химическое соединение»
Сложные
вещества часто называют химическими соединениями.
Осуществите
переход по ссылке и просмотрите опыт взаимодействия простых веществ железа и серы.
Попробуйте
ответить на вопросы:
1.Чем
отличаются по составу смеси от химических соединений?
2. Сопоставьте
свойства смесей и химических соединений?
3. Какими
способами можно разделить на составляющие компоненты смеси и химического
соединения?
4. Можно
ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная
характеристика смесей и химических
Вопросы для сопоставления смесей с химическими соединениями | Сопоставление | |
Смеси | Химические соединения | |
Чем отличаются по составу смеси от химических соединений? | Вещества можно смешивать в любых соотношениях, т.е. состав смесей | Состав химических соединений постоянный. |
Сопоставьте свойства смесей и химических соединений? | Вещества в составе смесей сохраняют свои свойства | Вещества, образующие соединения, свои свойства не сохраняют, так как |
Какими способами можно разделить на составляющие компоненты смеси и | Вещества можно разделить физическими способами | Химические соединения можно разложить только с помощью химических |
Можно ли судить по внешним признакам об образовании смеси и химического | Механическое смешивание не сопровождается выделением теплоты или | Об образовании химического соединения можно судить по признакам |
Задания
для закрепления
I.
Поработайте с тренажёрами
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
II.
Решите задание
Из предложенного списка веществ выпишите отдельно
простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3,
H3PO4, N2, Fe. Объясните ваш выбор, в каждом
из случаев.
III.
Ответьте на вопросы
№1. Сколько простых веществ записано в ряду
формул:
H2O, N2, O3, HNO3,
P2O5, S, Fe, CO2, KOH.
№2. К сложным относятся оба
вещества:
А) С (уголь) и S (сера);
Б) CO2 (углекислый газ) и H2O
(вода);
В) Fe (железо) и CH4 (метан);
Г) H2SO4 (серная кислота)
и H2 (водород).
№3. Выберите правильное
утверждение: простые вещества состоят из атомов одного вида.
А) Верно; Б) Неверно
№4. Для смесей характерно то, что
А) Они имеют постоянный состав;
Б) Вещества в составе “смеси” не сохраняют
свои индивидуальные свойства;
В) Вещества в “смесях” можно разделить
физическими свойствами;
Г) Вещества в “смесях” можно разделить при
помощи химической реакции.
№5. Для “химических соединений”
характерно следующее:
А) Переменный состав;
Б) Вещества, в составе “химического соединения
«можно разделить физическими способами;
В) Об образовании химического соединения можно
судить по признакам химических реакций;
Г) Постоянный состав.
№6. В каком случае идёт речь
о железе как о химическом элементе?
А) Железо – это металл, который притягивается
магнитом;
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) В состав сульфида железа входит один атом железа.
№7.
В каком случае идёт речь о кислороде как о простом веществе?
А) Кислород – это газ, поддерживает дыхание и
горение;
Б) Рыбы дышат кислородом, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.
Источник