Можно ли по физическим свойствам определить какое строение имеет вещество
ГДЗ к § 08. Вещества молекулярного и немолекулярного строения
| 12.05.2019, 15:45 | |||||||
| Внимание! Если скачанный файл открывается с ошибкой, то попробуйте открыть его на другом устройстве или в облаке. Если ничего не помогло, то напишите нам. | |||||||
Подумай, ответь, выполни…
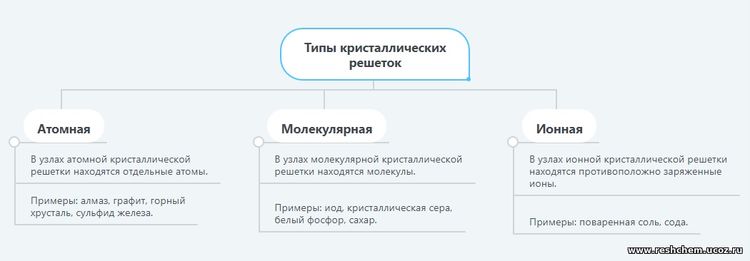
1. Приведите примеры веществ с молекулярным и немолекулярным строением. Как эти вещества различаются по свойствам? Вещества молекулярного строения: кислород, водород, азот, углекислый газ, вода, спирт, эфир, сера, белый фосфор. Вещества немолекулярного строения: сульфид железа, поваренная соль, алюминий, медь, железо. Вещества с молекулярным строением имеют низкие температуры плавления и кипения, часто летучи и имеют запах. При обычных условиях – это газы, жидкости или легкоплавкие твердые вещества. Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твердые, нелетучие и не имеют запаха. 2. Обсудите с соседом по парте вопрос, можно ли по физическим свойствам вещества определить, какое строение оно имеет – молекулярное или немолекулярное. По физическим свойствам вещества можно определить, какое строение оно имеет – молекулярное или немолекулярное. Если вещество имеет низкую температуру плавления и кипения, летучее или имеет запах, при обычных условиях является газом, жидкостью или легкоплавким твердым веществом, то, как правило, это вещество имеет молекулярное строение. Например, при обычных условиях аммиак – газ с резким запахом, спирт – летучая жидкость с характерным запахом, парафин и сахар – легкоплавкие твердые вещества. Следовательно, аммиак, спирт, парафин и сахар имеют молекулярное строение. Если вещество имеет высокую температуру плавления и кипения, является твердым, нелетучим и не имеет запаха, то, как правило, это вещество имеет немолекулярное строение. Например, поваренная соль, железо, графит – твердые тугоплавкие вещества, не имеющие запаха. Следовательно, поваренная соль, железо и графит имеют немолекулярное строение. 3. Какие типы кристаллических решеток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решетки. Составьте схему “Типы кристаллических решеток”.
4. Углекислый газ при нормальном давлении переходит в твердое состояние при температуре около -70 ºС, а речной песок (кремнезем) плавится при температуре около 1700 ºС. Какие выводы о строении этих веществ в твердом состоянии можно сделать? Так как углекислый газ при обычных условиях находится в газообразном состоянии, а в твердое состояние переходит при низкой температуре, следовательно, в твердом состоянии он имеет молекулярное строение. Так как оксид кремния при обычных условиях находится в твердом состоянии, а плавится при очень высокой температуре, следовательно, в твердом состоянии он имеет немолекулярное строение.
| |||||||
| Решебник: Рудзитис Г. Е., Фельдман Ф. Г. Химия. 8 класс: учебник | |||||||
| Просмотров: 2692 | |||||||
Онлайн всего: 3
Гостей: 3
Пользователей:
Источник
Ê ôèçè÷åñêèì ñâîéñòâàì âåùåñòâà ïðèíÿòî îòíîñèòü òå, êîòîðûå ôèêñèðóþòñÿ íàáëþäåíèåì ëèáî èçìåðåíèåì, áåç ïåðåõîäà â èíîå âåùåñòâî.
Íàèáîëåå ñóùåñòâåííûå ôèçè÷åñêèå ñâîéñòâà âåùåñòâà:
– àãðåãàòíîå ñîñòîÿíèå ïðè îïðåäåëåííûõ òåìïåðàòóðå è äàâëåíèè;
– çàïàõ (èëè åãî îòñóòñòâèå);
– öâåò, áëåñê (èëè èõ îòñóòñòâèå);
– ïëîòíîñòü;
– òåïëîïðîâîäíîñòü;
– ýëåêòðîïðîâîäíîñòü (èëè íå ýëåêòðîïðîâîäíîñòü).
– ðàñòâîðèìîñòü (èëè íåðàñòâîðèìîñòü) â âîäå;
– òåìïåðàòóðà ïëàâëåíèÿ;
– òåìïåðàòóðà êèïåíèÿ;
Ñïèñîê ôèçè÷åñêèõ ñâîéñòâ òâåðäûõ âåùåñòâ ìîæíî óâåëè÷èòü äîáàâèâ òâåðäîñòü, ïëàñòè÷íîñòü (èëè õðóïêîñòü), à äëÿ êðèñòàëëè÷åñêèõ — äîïîëíèòåëüíî è ôîðìó êðèñòàëëîâ. Îïèñûâàÿ ñâîéñòâà æèäêîñòè, óêàçàòü ïîäâèæíàÿ îíà ëèáî ìàñëÿíèñòàÿ.
Âèçóàëüíî ïîëó÷èòñÿ îöåíèòü ñëåäóþùèå ôèçè÷åñêèå õàðàêòåðèñòèêè: öâåò, çàïàõ, âêóñ, ôîðìó êðèñòàëëîâ. Ïëîòíîñòü, ýëåêòðîïðîâîäíîñòü, òåìïåðàòóðó ïëàâëåíèÿ è êèïåíèÿ ôèêñèðóþò, âûïîëíèâ çàìåðû. Äàííûå î ôèçè÷åñêèõ ñâîéñòâàõ áîëüøèíñòâà âåùåñòâ ñèñòåìàòèçèðîâàíû â ïðîôèëüíûõ ñïðàâî÷íèêàõ.
Ôèçè÷åñêèå ñâîéñòâà âåùåñòâà îáóñëîâëåíû àãðåãàòíûì ñîñòîÿíèåì. Ê ïðèìåðó, ïëîòíîñòü ëüäà, âîäû è âîäÿíîãî ïàðà ðàçíûå âåëè÷èíû. Ó ãàçîîáðàçíîãî êèñëîðîäà öâåò îòñóòñòâóåò, à ó æèäêîãî îí ãîëóáîé.
Çíàíèå ôèçè÷åñêèõ ñâîéñòâ ñïîñîáñòâóåò îïðåäåëåíèþ íåìàëîãî ÷èñëà âåùåñòâ. Ê ïðèìåðó, óíèêàëüíîñòü ìåäè â òîì, ÷òî îíà åäèíñòâåííûé ìåòàëë êðàñíîãî öâåòà. Èñêëþ÷èòåëüíîñòü ïîâàðåííîé ñîëè – åå ñîëåíûé âêóñ. Öâåò òâåðäîãî éîäà áëèçîê ê ÷åðíîìó, ïðè íàãðåâå îí ñòàíîâèòüñÿ òåìíî-ôèîëåòîâûì ïàðîì.  ïðåîáëàäàþùåì ÷èñëå ñèòóàöèé äëÿ òîãî ÷òîáû «óãàäàòü» âåùåñòâà òðåáóåòñÿ àíàëèçèðîâàòü ñîâîêóïíîñòü õàðàêòåðíûõ îñîáåííîñòåé.
Êàëüêóëÿòîðû ïî ôèçèêå | |
| Ðåøåíèå çàäà÷ ïî ôèçèêå, ïîäãîòîâêà ê ÝÃÅ è ÃÈÀ, ìåõàíèêà òåðìîäèíàìèêà è äð. | |
| Êàëüêóëÿòîðû ïî ôèçèêå | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå âåùåñòâà | |
| Ìîëåêóëÿðíîå ñòðîåíèå âåùåñòâ, ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà âåùåñòâ, ñòðîåíèå âåùåñòâà. | |
| Õèìè÷åñêèå âåùåñòâà | |
Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó ôèçèêè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Âåùåñòâî. Õèìè÷åñêèå ñâîéñòâà. | |
| Õèìè÷åñêèå ñâîéñòâà — óìåíèå âåùåñòâ ( õèìè÷åñêèõ ýëåìåíòîâ , ïðîñòûõ âåùåñòâ è õèìè÷åñêèõ ñîåäèíåíèé ) âçàèìîäåéñòâîâàòü ñ èíûìè âåùåñòâàìè ëèáî âèäîèçìåíÿòüñÿ ïîä âîçäåéñòâèåì íåêîòîðûõ ôàêòîðîâ. | |
| Âåùåñòâî. Õèìè÷åñêèå ñâîéñòâà. | |
Источник
Вещества могут существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Например, существует водяной пар (вода в газообразном агрегатном состоянии), жидкая вода и лёд (вода в твёрдом агрегатном состоянии).
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. Частицы в газообразных веществах движутся с очень большими скоростями и неупорядоченно (хаотически).
В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. Скорость хаотического перемещения частиц в жидкостях намного меньше, чем в газах.
Частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Кристаллические вещества. Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Кристаллы соли, сахара, серы, горного хрусталя, алмаза также имеют геометрически правильную форму.
Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
В зависимости от того, какие частицы находятся в узлах этой решётки, различают атомные, молекулярные и ионные кристаллические решётки.
Атомные кристаллические решётки. В узлах атомных кристаллических решёток находятся отдельные атомы. Эти атомы могут располагаться в пространстве по-разному, поэтому и форма кристаллов бывает различной. Например, в узлах кристаллических решёток алмаза и графита находятся атомы углерода, но из-за различного расположения атомов кристаллы алмаза и графита имеют разную форму.
Молекулярные кристаллические решётки. В узлах молекулярных кристаллических решёток находятся молекулы. Например, в узлах кристаллической решётки иода находятся молекулы иода .
Ионные кристаллические решётки. Такие решётки характерны для ионных соединений. В узлах ионных решёток находятся противоположно заряженные ионы. Типичными представителями ионных соединений являются соли. Например, в узлах кристаллической решётки хлорида натрия (поваренной соли) находятся ионы натрия и хлорид-ионы .
В хлориде натрия ионы находятся на одинаковых расстояниях друг от друга, образуя кристаллы кубической формы. В кристаллах поваренной соли отдельных молекул хлорида натрия не существует.
Аморфные вещества. Существует достаточно много твёрдых веществ, частицы которых, подобно частицам в газах и жидкостях, расположены неупорядоченно (хаотически). Такие вещества называют аморфными. Свойства кристаллических и аморфных веществ существенно различаются. Например, если любое кристаллическое вещество имеет определённую температуру плавления, то аморфные вещества её не имеют.
Различить кристаллические и аморфные вещества можно, если их подвергнуть механическому воздействию: например, ударить молотком. Если аккуратно разбить кусочки поваренной соли, серы или графита, то можно заметить, что они раскалываются на мелкие кристаллы, имеющие определённую форму. Так ведут себя кристаллические вещества. Аморфные вещества, например стекло, при ударе рассыпаются на осколки, не имеющие определённой формы.
Вещества молекулярного и немолекулярного строения. Все вещества можно разделить на две большие группы: вещества, имеющие молекулярное строение, и вещества с немолекулярным строением.
Вещества, которые состоят из молекул, — это вещества МОЛЕКУЛЯРНОГО СТРОЕНИЯ.
Вещества, которые состоят из атомов или ионов, относят к веществам НЕМОЛЕКУЛЯРНОГО СТРОЕНИЯ.
Кристаллическая решётка хлорида натрия:
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах. Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Можно ли по физическим свойствам вещества определить, какое строение оно имеет — молекулярное или немолекулярное? Вещества с молекулярным строением при обычных условиях — это газы (кислород, водород, азот и др.), жидкости (вода, спирт, эфир и др.) или легкоплавкие твёрдые вещества, такие, как кристаллическая сера (температура плавления около 113 °C) или белый фосфор (температура плавления 44 °C).
Источник
Основной структурной единицей веществ, имеющих молекулярное строение является молекула. Молекула состоит из ограниченного числа атомов, связанных друг с другом ковалентными химическими связями. Заряд молекулы также как и атома равен нулю.
Объединяясь в молекулу, атомы образуют определённую 2D или 3D-структуру (треугольник, квадрат, тетраэдр, октаэдр и т.д.).
Молекула – электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями и имеющая определённую пространственную структуру.
Отметим, что в некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь “молекулярное строение”, например, все инертные газы. Для инертных газов понятия атом и молекула пересекаются.
Ковалентные связи между атомами образуются в результате обобществления атомами валентных электронов.
Валентные электроны – это электроны, принимающие участие в образовании химических связей.
Валентные электроны в атомах элементов главных подгрупп находятся на внешнем электронном слое. В атомах элементов побочных подгрупп часть валентных электронов находится на внешнем электронном слое, их там как правило 2, а иногда 1, с учётом эффекта провала электрона, а оставшаяся часть на d-подуровне предвнешнего электронного слоя.
При обобществлении валентных электронов атомами возникают общие электронные пары. Поэтому более точно, ковалентная связь – это связь, возникающая за счёт общих электронных пар.
Общие электронные пары могут возникать двумя способами: в результате обобществления неспаренных валентных электронов (обменный или коллигативный механизм) и в результате обобществления неподелённой электронной пары одного из атомов (донорно-акцепторный механизм). Более подробно речь об этих механизмах пойдёт в соответствующей главе.
Обобществление неспаренных электронов атомов водорода (обменный механизм образования ковалентной связи)
Валентный штрих Купера, показывающий общую электронную пару
Количество общих электронных пар, образуемых атомом принято называть его валентностью.
Валентность – это количество ковалентных связей атома с другими атомами.
Особо отметим, что если связи между атомами ковалентные, то это не свидетельство того, что вещество имеет молекулярное строение, т.е. состоит из молекул. Например, связи между атомами кремния и кислорода в SiO2 являются ковалентными, но SiO2 имеет атомное строение.
Чтобы однозначно определить имеет ли вещество молекулярное строение, необходимо знать его физические свойства: температуру кипения, температуру плавления и т.д. Вещества, имеющие молекулярное строение, как правило легкоплавки, имеют относительно низкую температуру кипения, так как связи между молекулами (межмолекулярное взаимодействие) достаточно слабые, имеющие низкие значения энергии.
Молекулы всегда имеют постоянный состав, поэтому и вещества молекулярного строения имеют постоянный состав, т.е. являются дальтонидами. Дальтониды подчиняются закону постоянства состава – закону Пруста (Ж. Л. Пруст, 1801—1808 гг.).
Для того, чтобы отразить состав молекулы применяют условную запись под названием химическая формула.
Химическая формула – условная запись, отражающая качественный и количественный состав веществ, имеющих молекулярное строение (условная запись состава молекулы).
Если вещество имеет немолекулярное строение (атомное или ионное), то его состав отражает формульная единица.
К примеру, если хлорид натрия находится при стандартных условиях, то он имеет ионное строение, а значит запись NaCl для кристаллического хлорида натрия не является химической формулой, а является записью формульной единицы.
При достаточно высоких температурах хлорид натрия можно перевести в газообразное агрегатное состояние, в этом случае резко повышается степень ковалентности связи. Это значит, что в газовой фазе существуют молекулы состава NaCl. На сей счёт имеются экспериментальные доказательства. Действительно, подобные молекулы в настоящее время удаётся получить, изолировав их друг от друга в твёрдом аргоне при температуре -2630 С. В приведённом примере запись NaCl является химической формулой, отражающей состав молекулы.
Во многих пособиях и учебниках до сих пор встречается определение молекулы, как наименьшей частицы вещества, обладающей его химическими свойствами.
Отметим, что данное определение является устаревшим и неправильным. Так молекулу определял Канницаро в 1860 году.
Ошибочность определения заключается в следующем.
Молекула не является наименьшей частицей вещества, так как существуют вещества атомного строения.
Молекула не является носителем химических свойств вещества, свойства обусловлены не единичной частицей, а их совокупностью, характером их взаимодействия.
Одна молекула тринитротолуола не обладает свойством взрывчатости, как даже две, три и большее их количество. Свойством взрывчатости будет обладать совокупность громадного числа молекул тринитротолуола – вещество.
Состав и строение молекулы определяют свойства вещества, но не молекула является носителем этих свойств.
Для наглядного изображения пространственного строения молекул применяют различные модели: шаростержневая модель, полусферическая модель Стюарта-Бриглеба, модель Драйдинга.
Источник
