Kclo4 проявляет какие свойства

Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора. Эти соединения получают косвенным путем, т.к. хлор непосредственно с кислородом не соединяется. Все они более или менее неустойчивы.
Хлор образует ряд кислородных кислот (оксокислот). Эти кислоты и их соли являются сильными окислителями.
| Формула кислоты | Название кислоты | Константа диссоциации $K_textrm{д}$ | Кислотный остаток | Название солей |
|---|---|---|---|---|
| $HClO$ | хлорноватистая | $ 5cdot 10^{-8} $ | $ClO^-$ | гипохлорит |
| $HClO_2$ | хлористая | $5cdot 10^{-3} $ | $ClO_2^-$ | хлорит |
| $HClO_3$ | хлорноватая | $5cdot 10 $ | $ClO_3^-$ | хлорат |
| $HClO_4$ | хлорнуая | $1 cdot 10^3 $ | $ClO_4^-$ | перхлорат |
Активность кислородных кислот хлора возрастает от хлорноватистой к хлорной кислоте. Окислительная их активность увеличивается в обратном порядке — от хлорной к хлорноватистой, которая является наименее устойчивой. Обратите внимание на изменение свойств кислот с изменением степени окисления:
хлор в минимальной степени окисления дает сильную кислоту, но не окислитель;
с увеличением степени окисления увеличивается сила кислот и окислительные свойства
хлорноватистая кислота $HClO$
Степень окисления хлора +1.

Бесцветный раствор. Это очень слабая и неустойчивая кислота, существует только в виде разбавленных водных растворов. Слабый электролит. Ей соответствует кислотный оксид $Cl_2O$. Образует более устойчивые соли – гипохлориты ($ClO^-$).

Со щелочами дает соли – гипохлориты:
$HClO + KOH = KClO + H_2O$
Взаимодействует с галогеноводородами
$2HI + HClO = I_2 + HCl + H2O$
Хлорноватистая кислота – сильный окислитель:
$2HClO + H_2S = S + Cl_2uparrow + H_2O$
Получение
Хлорноватистая кислота образуется при растворении газообразного хлора в воде, поэтому эта реакция лежит в основе дезинфекции (обеззараживания) воды на водопроводных станциях.
$Cl_2 + H_2O = HCl + HClO$
$Cl_2O + H_2O = 2HClO$
В результате разложения хлорноватистой кислоты образуется свободный кислород, обладающий высокой окислительной способностью, за счет чего и убиваются болезнетворные бактерии:
$HClO = HCl + Ocdot$
Этот механизм действия аналогичен механизму действия перекиси водорода, при разложении которой также образуется атомарный кислород и вода.
Хлорирование воды является на сегодняшний день наиболее надежным способом обезвреживания воды, так как эффект продолжается длительное время и позволяет обезвреживать воду во время ее прохождения по системе водопроводов.
хлористая кислота $HClO_2$
Степень окисления хлора +3.

Бесцветная. Кислота средней силы. Неустойчивая. Проявляет окислительные свойства. Ей соответствует кислотный оксид $Cl_2O_3$.
Со щелочами образует соответствующие соли — хлориты:
$HClO_2 + KOH = KClO_2 + H_2O$
Неустойчива, при хранении разлагается
$4HClO_2 = HCl + HClO_3 + 2ClO_2 + H_2O$
Получение
Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертоллетовой соли и щавелевой кислоты в сернокислой среде:
$2KClO_3 + H_2C_2O_4 + H_2SO_4 = K_2SO_4 + 2CO_2 + 2ClO_2 + 2H2O$
$2ClO_2 + H_2O_2 = 2HClO_2 + O_2$
хлорноватая кислота $HClO_3 $
Степень окисления хлора +5.

В свободном виде она не получена, «живет» только в растворах. Сильное вещество как просто кислота, и как кислота-окислитель. Кислотный оксид — $Cl_2O_5$. Соли — хлораты ($ClO_2^-$).
Сильная кислота — окислитель:
$HClO_3 + S + H_2O= H_2SO_4 + HCl$
$6P + 5HClO_3 = 3P_2O_5 + 5HCl$
Со щелочами образует соответствующие соли — хлораты:
$HClO_3 + KOH = KClO_3 + H_2O$
Бертолетова соль (хлорат калия) $KClO_3$
Наиболее известным хлоратом является “бертолетова” соль – $KClO_3$. Впервые получена К. Бертолле в 1786 г. Бертоллетову соль получают при пропускании хлора через подогретый раствор KOH:
$3Cl_2 + 6KOH xrightarrow[]{t, ^circ C} 5KCl + KClO_3 + 3H_2O$
При температуре ~ $400^circ C$ хлорат калия разлагается с выделением кислорода с промежуточным образованием перхлората калия:
$4KClO_3 rightarrow 3KClO_4 + KCl hspace{1cm} t= 400^circ C$
$KClO_4 rightarrow KCl + 2O_2uparrow hspace{1cm} t=550—620^circ C$
Смеси хлората калия с восстановителями (фосфором, серой, органическими соединениями) взрывчаты и чувствительны к трению и ударам:
$2KClO_3 + 3S = 2KCl + 3SO_2$
$12P_{textrm{ (красн.)}} + 10KClO_3 = 3P_4O_{10} + 10KCl$
Чувствительность повышается в присутствии броматов и солей аммония. Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда хлорат калия используется в пиротехнике, как источник хлора для цветнопламенных составов, входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ
хлорная кислота $HClO_4$
Степень окисления хлора +7.

Одна из самых сильных кислот, одна из самых сильных окислителей. Взрывоопасна. Бесцветная, летучая, парит на воздухе. Кислотный оксид — $Cl_2O_7$. Соли — перхлораты.

Получение:
$KClO_4 + H_2SO_4 = KHSO_4 + HClO_4$
Взаимодействует со щелочами с образованием солей – перхлоратов:
$HClO_4 + KOH = KClO_4 + H_2O$
При нагревании хлорная кислота и ее соли разлагаются:
$4HClO_4 = 4ClO_2 + 3O_2 + 2H_2O$
$KClO4 = KCl + 2O_2$
Среди перхлоратов особенное значение имеет перхлорат аммония, используемый для изготовления бездымных взрывчатых веществ. Перхлораты тяжелых металлов и хлорную кислоту используют в качестве электролитов в гальванопластике, при цементации и др. Перхлораты применяют в производстве взрывчатых и пиротехнических материалов, а также для приготовления смесей, используемых, за счет их гигроскопичности, для регулирования атмосферных осадков.
ПРИМЕНЕНИЕ
Наиболее широкое применение имеют соли кислородных кислот хлора. Соли низших кислородных кислот хлора являются хорошими отбеливающими средствами вследствие их высокой окислительной активности. Основным отбеливающим и окислительным хлорным соединением является хлорная известь. В настоящее время для этих целей широко применяются также гипохлориты, хлориты и двуокись хлора.
Наибольшие количества хлорной извести потребляют в текстильной и бумажной промышленности для отбелки тканей и целлюлозы (хлорная известь часто называется белильной известью). Хлорную известь применяют в качестве окислителя в некоторых химических производствах (при получении хлороформа, хлорпикрина и других продуктов), для дезинфекции питьевых и сточных вод, для дезинфекции овощехранилищ. Ее используют также для очистки ацетилена и некоторых нефтепродуктов.
Источник
| Хлорат калия | |
|---|---|
| Систематическое наименование | Хлорат калия |
| Традиционные названия | Бертолетова соль |
| Хим. формула | KClO3 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 122.55 г/моль |
| Плотность | 2,32 г/см³ |
| Температура | |
| • плавления | 356 °C |
| • разложения | ~ 400 |
| Энтальпия | |
| • образования | -391,204 кДж/моль |
| Растворимость | |
| • в воде при 0°C | 3,25 г/100 мл |
| • в воде при 20°C | 7,3 г/100 мл |
| • в воде при 100°C | 56,2 г/100 мл |
| • в воде при 104,2°C | 61,5 г/100 мл |
| Рег. номер CAS | [3811-04-9] |
| PubChem | 6426889 |
| Рег. номер EINECS | 223-289-7 |
| SMILES | [O-]Cl(=O)=O.[K+] |
| InChI | InChI=1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 VKJKEPKFPUWCAS-UHFFFAOYSA-M |
| RTECS | FO0350000 |
| Номер ООН | 1485 |
| ChemSpider | 18512 |
| NFPA 704 | 2 3 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Хлорат калия (бертолетова соль[1], калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
История[править | править код]
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
Получение[править | править код]
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на хлорат калия и исходный хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем хлорат калия, и, таким образом, удобнее для фильтрации.
Химические свойства[править | править код]
- При температуре ~ 400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
- В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C).
- Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:
Применение[править | править код]
Взрывчатые вещества[править | править код]
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов и в зарядах хлопушек (взрыв происходит при протаскивании грубой нити через пиротехнический состав), входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине[править | править код]
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода[править | править код]
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.
Для получения диоксида хлора[править | править код]
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
Токсичность[править | править код]
Токсичен. Смертельная доза хлората калия составляет 1 г/кг[2].
Примечания[править | править код]
Литература[править | править код]
- Вуколов, С. П., Менделеев Д. И.,. Хлорноватые соли // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород
не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее – оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным
элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к
брому, и к йоду. Так например HBrO – бромноватистая кислота (соли гипобромиты), HIO – иодноватистая кислота (соли гипоиодиты).
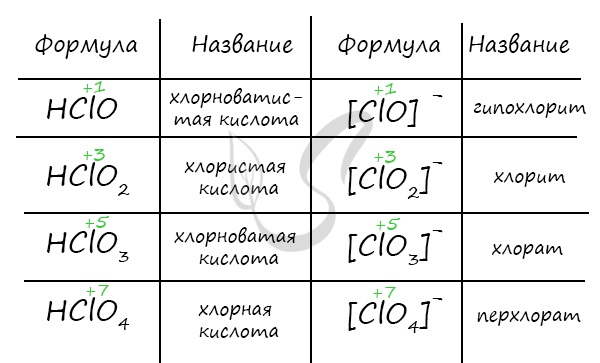
HIO3 – иодноватая кислота (соли иодаты), HBrO3 – бромноватая кислота (соли броматы). По аналогии несложно
составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
- Хлорноватистая кислота
- Хлористая кислота
- Хлорноватая кислота
- Хлорная кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
Cl2 + H2O ⇄ HCl + HClO

KClO + H2O + CO2 → KHCO3 + HClO
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO

Хлористая кислота может быть получена из собственных солей – хлоритов, а также в реакции с оксидом хлора IV.
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
H2SO4 + Ba(ClO3)2 → BaSO4↓ + HClO3
Самая сильная кислота в природе – хлорная кислота – может быть получена реакцией перхлората калия или натрия с концентрированной серной
кислотой.
KClO4 + H2SO4 → K2SO4 + HClO4

Химические свойства
- Кислотные свойства
- Разложение кислот и солей
- Окислительные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная – к сильным. Кислоты образуют соли в
реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
И кислоты, и их соли разлагаются схожим образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2

NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и
галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Некоторые химические свойства хлората калия (бертолетовой соли).
При температуре ~ 400°C диспропорционирует с образованием перхлората калия, при более сильном нагреве разлагается с выделением кислорода:
4KClO3 —> 3KClO4 + KCl (400°C)
KClO4 —> KCl + 2O2 (550—620°C)
В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200°C).
2KClO3 —>2KCl + 3O2 (150—300°C, кат. MnO2)
Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:
(NH4)2SO4 + 2KClO3 —> 2NH4ClO3 + K2SO4
#химия@chemzone #неорганика@chemzone
#наука@chemzone #хлор@chemzone
#chemzone@chemzone
Хорошо былобы раскрыть тему изготовления катализаторов.
Айат, для тебя проблема получить CuO, Fe2O3?
– Не совсем логично как то: “при темперптуре ~400°С разлагается с выделением кислорода с промежуточным образованием перхлората…”, в то же время, “KClO4 -> KCl + 3O2 (550-620°C)”…
– Где же логика?!. – Если автор и сам признаёт, что перхлорат разлагается при температурах порядка 550-620°С, с чем я лично, совершенно, согласен, то как же хлорат может “разлагаться” при 400°С, с “ПРОМЕЖУТОЧНЫМ” образованием перхлората?!.;)
Показать полностью…
Рецепт практического состава, воспламеняющегося от действия небольшого количества воды:
Хлорат калия 50 %, нитрат аммония 20 %, медный купорос прокаленный 10 %, магний 20 %
При воздействии на состав воды в нем протекают следующие реакции:
Показать полностью…
Самое главное – сразу возьмите реагентов по полкило))
Игорь, новенький редактор напутал сильно. Приносим извинения. Исправили. спасибо, что заметили.
Вадим, а бертолетову соль перетерали с сернокислой медью, одновременно, в одной ступке, вместе?!!!
И остались с руками и пальцами на месте?!.
Химия, но бертолетова соль, даже, и без катализатора, частично, способна давать кислород, в порядке одной из конкурирующих реакций разложения:
a) 2KClO3 -> 2KCl + 3O2;
b) 4KClO3 -> 3KClO4 + KCl;
что выражается в суммарной схеме реакции разложения бертолетовой соли, без катализатора:
2KClO3 -> O2 + KClO4 + KCl.
Причём, подчеркиваю: речь идет о разложении именно бертолетовой соли, а не образующегося перхлората.
Игорь, откуда такие познания?) после каждого химического постава Вы замечаете недостатки с точностью кошки)
Ввиду очень опасного опыта, предложенного выше Вадимом, который я бы не рекомендовал, никому, повторять, предлагаю более безопасные, занятные и познавательные опыты с бертолетовой солью:
1. – Горение металлической меди в бертоллетовой соли:
Показать полностью…
Александр, неконструктивный вопрос…
А, вообще, Химию очень люблю, просто)
Игорь, но одной любовью не наберёшь базу знаний) учились где?
Александр, не согласен) Истинная любовь к Химии сделала своё дело… + высоких старых авторов читал и почитаю.)
Схематизированной оглупляюшей современщине это не под силу)
Илья, получить оксид сжигая медь в среде кислорода не проблема,тока такой катализатор не обладает достаточной селективностью как окись полученый из корбонатов этих металлов.
Игорь, а можно поинтересоваться, какие книги?)
Александр, всего сейчас, уже, и не упомню…
Но могу сказать: самые знатные книги – старые! Они писались, добросовестно, с описанием деталей и особенностей, чего сейчас и нет.
Айат, и хорошо у Вас медь горела в кислороде?!.;)
Игорь, потому что я отсюда скачал книги по органике про строение и схемы образования связей и тд)
Александр, Вам нравятся современные книги по Химии?..)
Игорь, если бы я что-то знал про старые да и вообще про чтение химических книг)))
Я не могу назвать эту книгу современной, потому что она старше меня))))
А безопасно продемонстрировать взрывчатость хлорноватокислого аммония можно, осторожно, перетерев в стальной ступе пару крупинок соли аммония и бертолетовой соли, наблюдая микровзрывы, с характерным потрескиванием.
Александр, всю литературу, начиная со второй половины 80-х годов, считаю, непростительно, новой.
Лично я больше всего люблю советские издания 30-х-70-х годов…
Вот, где можно в Химии настоящей классической “искупаться”, насладившись первозданным “химизмом”, без “примесей” прикладнизмов, “физизмов” и “математизмов”)
Игорь, я в химии не так силен как вы мастер гуру ,,поэтому и интерессуюсь как получать хорошие окиси катализаторов .
Игорь, а что порошковая медь не горит в среде чистого кислорода?
Айат, ну, вот, Вы пробовали жечь медь, пусть, даже, в чистом кислороде???;)
Хотел бы посмотреть, как бы у Вас это получалось…)
Не очень то медь металлическая и склонна гореть в кислороде, насколько знаю…
А какое назначение катализатора? – Может, сумею подсказать…)
А медный порошок, конечно, можно попытаться зажечь в струе кислорода, но что то меня терзают смутные сомнения…
Игорь, заметное впечатление она произвела на Вас) тогда где найти такую литературу?)
Александр, ну, я бы рекомендовал начинать с самого простого – со Справочного руководства по хими, под ред. Ганса Кейне, в переводе с немецкого (- немцы, вообще, большущие умницы в классической “живой” химии!))
Хорош, также, “Спутник химика” 1932-го года…
Игорь, спасибо)) после прочтения их, я обращусь за новой)
Александр, и советую Вам сделать химический справочник своей настольной книгой, и не ленитесь листать его при каждом случае, по поводу и без повода…)
Игорь, прочел одну статью в тырнете “бензиновый заводик в сарае”и понял что основа этой установки катализаторы окиси разных метеллов
Игорь, ну вот я собираюсь поступать в Губкино в Москве, вот скачал книги, решил углубиться в изучении, потому что чувствую упущения в теории)
Айат, Вы имеете ввиду каталитическое окисление бензиновых топлив?
Я бы рекомендовал спутанную медную проволоку или медную губку, подвергнутую долговременному воздействию CrO2Cl2 (- Осторожно! Высоко токсичен!), в который проволоку надо погрузить и выдержать некоторое время, после чего извлеченную проволоку, без смывания удержавшегося на ее поверхности активирующего реагента, слабо прокалить.
Думаю, такой активированный моток медной проволоки сможет быть активен, в каталитичнском окислении бензинов и т.п.
Игорь, вообще не могу найти первую рекомендованную книгу) даже автора такого нет
Александр, Справочное руководстао по хими, Ганс Кейне, Лейпциг, 1973, – перевод с немецкого Гаврюченковой, 1976-го года.
Я бы сделал и отправил Вам фото разворота книги, но что то с памятью устройства.
Возможно, в этом “прикольно-покемонестом” интернете и нет такой литературы, а искать стоит в стареньких библиотеках.
Айат, CuCO3 + H2O2 = CuO + CO2+ H2O + O2 , вроде так, ты про это имел ввиду, когда говорил о получении из карбонатов?
Илья, я не химик но изучаю по немногу химию,да кажись этот метод получения окиси из корбонатов то что и нужно,окиси полученые из корбонатов обладают хорошей селективностью
Игорь, спасибо за рекомендацию но вижу что это не простая задача ,так как чтобы получить нужное вещество, нужно получить еще другое ,вот за это я и полюбил химию
Игорь, да я имею ввиду получения бензинов что используются в качестве топлива в машинах формула 1
Игорь, да я пробовал жечь металлы в окислительном пламени автогена и поверьте мне, горит нормально.
Показать следующие комментарии
Источник
