Каком веществе содержится ионы

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 мая 2020;
проверки требуют 6 правок.
У этого термина существуют и другие значения, см. Ион (значения).
Ио́н (др.-греч. ἰόν «идущее») — атом или молекула, которая имеет электрический заряд[1]. Если ион имеет положительный заряд, он называется катионом, а если отрицательный — анионом.
В виде самостоятельных частиц ионы встречаются во всех агрегатных состояниях вещества: в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме (в частности, в межзвёздном пространстве).
Описание[править | править код]
Понятие и термин «ион» ввёл в 1834 году Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов.
Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах электролитов ионы образуются в результате электролитической диссоциации и обуславливают многие их свойства.
Согласно химической номенклатуре, название катиона, состоящего из одного атома совпадает с названием элемента, например, Na+ называется ионом натрия, иногда добавляют в скобках степень окисления, например, название катиона Fe2+ — ион железа (II). Название аниона, состоящего из одного атома, образуется из корня латинского названия элемента и суффикса «-ид», например, F- называется фторид-ионом[2].
Классификация ионов[править | править код]
Ионы подразделяют на две большие группы – простые и сложные.
Простые (одноатомные[en]) ионы содержат одно атомное ядро.
Сложные (многоатомные[en]) ионы содержат не менее двух атомных ядер.
Отдельно выделяют ион-радикалы – заряженные свободные радикалы. Ион-радикалы в свою очередь подразделяют на катион-радикалы и анион-радикалы.
Катион-радикалы – положительно заряженные частицы с одним неспаренным электроном.
Анион-радикалы – отрицательно заряженные частицы с одним неспаренным электроном [3]
Строение простых ионов[править | править код]
Простые ионы состоят из одного атомного ядра и электронов. Атомное ядро состоит из протонов и нейтронов, неся практически всю (более 99,9%) массу иона и создаёт электрическое поле, которое удерживает электроны. Заряд атомного ядра определяется числом протонов, и совпадает с порядковым номером элемента в
периодической таблице Д.И. Менделеева.
Электроны заполняют электронные слои вокруг атомного ядра. Электроны с одинаковым значением главного квантового числа n образуют квантовый слой близких по размерам электронных облаков. Слои с n = 1,2,3,4… обозначаются соответственно буквами K, L, M, N… По мере удаления от атомного ядра ёмкость слоёв увеличивается и в зависимости от значения n составляет 2 (слой K), 8 (слой L), 18 (слой M), 32 (слой N)… электронов.
Исключением из общего правила является положительный ион водорода, который не содержит электронов и является элементарной частицей – протоном. В то же время отрицательный ион водорода содержит два электрона. Фактически гидрид-ион является системой из одного протона и двух электронов и изоэлектронен положительному иону лития, имеющему в электронной оболочке также два электрона.
Вследствие волнового характера движения электрона ион не имеет строго определённых границ. Поэтому точно определить размеры ионов невозможно. Кажущийся радиус иона зависит от того, какое физическое свойство рассматривается, и будет различным для разных свойств. Обычно используют такие ионные радиусы, чтобы сумма двух радиусов равнялась равновесному расстоянию между соседними ионами в кристалле. Такая полуэмпирическая таблица ионных радиусов была составлена Л. Полингом.[4]
Позднее была составлена новая система ионных радиусов на основе кристаллохимических исследований Г.Б. Бокия структур простейших бинарных соединений.[5]
Ионизация[править | править код]
Атомы и молекулы могут превращаться в положительно заряженные ионы в результате потери одного или нескольких электронов. Отрыв электрона от атома или молекулы требует затраты энергии, называемой энергией ионизации.
Положительно заряженные ионы также образуются при присоединении протона (положительно заряженного ядра атома водорода). Примером является молекулярный ион водорода, ион аммония, ониевые соединения.
Отрицательно заряженные ионы образуются в результате присоединения электрона к атому или молекуле. Присоединение электрона сопровождается выделением энергии.
Положительный ион водорода (H+ или протон, p) получается при ионизации атома водорода. Энергия ионизации в данном процессе имеет значение 13,595 эВ.
Для атома гелия энергия ионизации составляет 24,581 эВ и 54,403 эВ и соответствует отрыву первого и второго электронов. Получаемый ион гелия (He2+) в физике имеет название альфа-частица. Выброс альфа-частиц наблюдается при радиоактивном распаде некоторых атомных ядер, например 88Ra226.
Энергия отрыва первого электрона атома имеет явно выраженный периодический характер зависимости от порядкового номера элемента.
В связи с низкими значениями энергии ионизации щелочных металлов, их атомы легко теряют свои внешние электроны под действием света. Отрыв электрона производится в данном случае за счёт энергии поглощаемых металлом квантов света.
См. также[править | править код]
Примечания[править | править код]
Источники[править | править код]
- см. в Большая советская энциклопедия
- [www.xumuk.ru/encyklopedia/1752.html Ионы] на сайте XuMuk.ru
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Источник
Ион – это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона.
Отсюда следует, что в ионе количество протонов не равно количеству электронов.
После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также
Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr)
24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье
“электронная конфигурация атома”, каждый
электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный
заряд), схема для запоминания:
24Cr – e- = 24Cr + e+ = 24Cr+
24Cr – 3e- = 24Cr + 3e+ = 24Cr3+
Аналогично при присоединении электрона:
24Cr + e- = 24Cr – e+ = 24Cr-
24Cr + 3e- = 24Cr – 3e+ = 24Cr3-
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон “оторвётся” от атома. Чем ближе электрон
к ядру – тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва
электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть
найдены в различных справочниках.
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия
называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна
и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома
хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона
также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет
отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S2-
означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно,
если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H+.
Отрицательно заряженные атомы называются анионами, положительно заряженные атомы – катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора – 3.61 эВ, энергия ионизации – 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства – 0,78 эВ, потенциал ионизации – 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl-.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация – 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния – это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Вам понравилась статья? Да / Нет
Просмотров: 4 023
Источник
Частица, в которой содержится разное число протонов и электронов, называется ионом. Если количество протонов больше, ион приобретает положительный заряд и становится катионом. Ионы с отрицательным зарядом (преобладают электроны) называются анионами.

Общее описание
Впервые в химии понятие «ион» появилось в 1834 году благодаря экспериментам Майкла Фарадея. Учёный изучал электропроводность водных растворов кислот, солей, щелочей. Он предположил, что возможность проводить электричество обусловлена движением в растворе заряженных частиц – ионов.
Молекулы способны распадаться на ионы – атомы с недостатком или избытком электроном. Процесс распада называется электролитической диссоциацией, а образованный раствор или расплав – электролитом. Если опустить в раствор электролита электрод, катионы начнут двигаться к катоду – отрицательному полюсу, анионы – к аноду – положительному полюсу. Этим объясняется электропроводность электролитов.
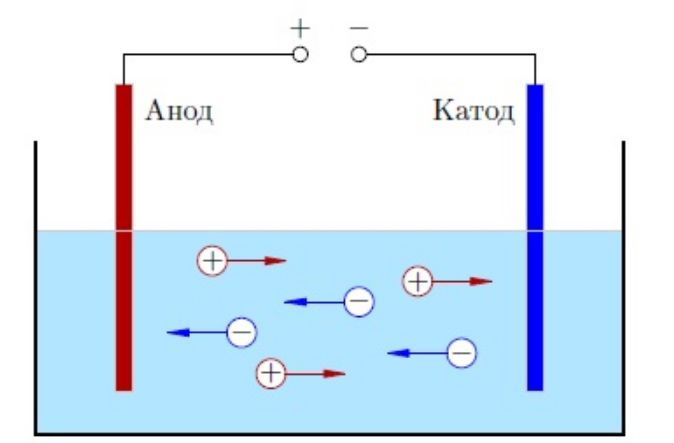
Рис. 1. Движение ионов под действием электрода.
В растворах или в расплавах ионы образуются под действием молекул воды или высокой температуры.
Строение
Ионы состоят из ядра и электронов, движущихся вокруг. Ядро образуют положительно заряженные частицы (протоны) и нейтральные частицы (нейтроны). Количество протонов совпадает с порядковым номером элемента. Количество нейтронов равно значению разницы между относительной атомной массой и количеством протонов.
Электроны располагаются на энергетических уровнях. Количество уровней совпадает с периодом, в котором находится элемент. На внешнем энергетическом уровне находятся валентные электроны, которые могут взаимодействовать с другими атомами. При отдаче валентных электронов атом превращается в катион, при присоединении дополнительного электрона становится анионом.
Например, если к атому хлора присоединить ещё один электрон он станет отрицательно заряженным ионом – анионом. А если у атома натрия отнять один электрон, он станет положительно заряженным ионом – катионом, т.к. количество протонов станет больше, чем отрицательных электронов.
Катионы в уравнениях отмечаются плюсом, а анионы – минусом. Например, Fe2+, Al3+, Na+, F–, Cl–. Цифра означает, сколько электронов отдал или принял атом, став ионом, т.е. показывает степень окисления. Количество катионов или анионов можно посмотреть по таблице растворимости веществ.

Рис. 2. Таблица растворимости.
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na+, Mg2+, Cl–. Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
- NH3 + H+ → NH4+;
- BF3 + F– → BF4–.
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH–), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
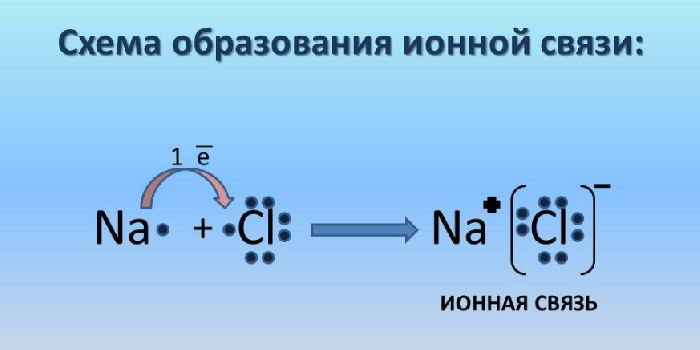
Рис. 3. Схема ионной связи.
Что мы узнали?
Из темы урока узнали, что такое ионы. Атом становится ионом при отщеплении или присоединении электронов. Если электронов становится меньше, то атом приобретает положительный заряд за счёт преобладания протонов и становится катионом. При увеличении количества отрицательно заряженных электронов атом становится анионом. Ионы способны передавать электричество и обязательно присутствуют в электролитах. Между ионами возникает ионная связь за счёт электростатического притяжения отрицательных и положительно заряженных частиц.
Тест по теме
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 250.
Источник
Анонимный вопрос
5 марта 2019 · 6,6 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Ионы-это атомы, у которых отобрали электроны, ну или подарили их????
Ионы различают
☘️По количеству элементов
????Простые. Они состоят из одного элемента )
Na+, K+, Cl-
????Сложные. У них несколько химических элементов
SO3 2-, OH-
☘️По заряду
????Катионы-это положительные ионы???? в них превратились атомы, у которых забрали электроны:(
K+, Na+, Ba2+
????Анионы-это отрицательные ионы???? это бывшие атомы, которым однажды подарили электрон
Cl-, SO42-, SO32-
Лия Менделеева (!! – такая фамилия) даёт такой ГЛУПЫЙ ответ. И даже не ответ, а скопированный текст из учебника… Читать дальше
Михаил Зарецкий, мне не понятно, почему вы связываете альфа-распад с “потерей электронов” у атомов. Поясните. И что вы понимаете под альфа-распадом. Нет такого в природе. Есть распад ядер и атомов. В процессе распада могут отрываться отдельные части и частицы атома. В том числе и альфа-частицы. Эту разницу вы улавливаете? Иван М.
Что такое ионный обмен, основные химические реакции?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Ионный обмен ????
Это химическая реакция ,которая протекает между ионами ,на которые диссоциируют электролиты в водном растворе
????Что же относится к электролитам?
-кислоты
-основания
-соли
????Для необратимости реакции ионного обмена необходимо,чтобы выделился газ, выпал осадок или образовалась вода
????Пример:
Молекулярное уравнение
MgSO₄+K₂CO₃➡MgCO₃+ K₂SO₄
????Запишем полное ионное уравнение,разложим на ионы соединения,которые диссоциируют в воде
MgCO₃- это осадок ,следовательно его нельзя разложить на ионы
????Затем запишем сокращённое ионное уравнение
Мы можем зачеркнуть одинаковые ионы,которые находятся в реагентах и продуктах
Прочитать ещё 2 ответа
Объясните простым языком, что такое ионизация и ион?
Инженер, немного пилот. Физик, химик, электронщик-любитель. Независимый звукореж…
Совсем простым языком. Ионизация это образование ионов – положительно или отрицательно заряженых частиц.
Как известно, атом состоит из положительно заряженого ядра и электронов несущих отрицательный заряд вокруг него. Причём количество электронов в атоме равно количеству протонов в его ядре и суммарный заряд атома равен 0.
Так вот, если у атома забрать один или несколько электронов (а число протонов останется прежним), то получится положительно заряженый ион (катион). Если же к атому присоединится один или несколько “лишних” электронов, то атом превратится в отрицательно заряженый ион или анион.
Аналогично, группы атомов как одно целое могут стать катионами и анионами, например, кислотные остатки в растворах являются отрицательно заряжеными ионами. А положительно заряженые ионы может образовать, например, аммоний.
Что такое радиация?
Эксперт TQ по темам: IT, телеком, телефония, базы данных, интеграционные…
Вспомни, как ты обычно рисуешь Солнце — кружок и лучики. Направление в котором выходят лучи называется радиальным, то есть из центра излучения прямо во все стороны. Так вот «радиация» — это общее название для разных невидимых лучей, которые исходят из какого-то источника излучения, как из Солнца, и распространяются во все стороны, радиально.
Теперь нам осталось понять две вещи: 1) из чего могут состоять эти невидимые лучи, и 2) что может быть источником радиации.
Эти невидимые лучи состоят из различных частиц: электронов, атомных ядер, а также отдельных протонов, нейтронов и некоторых других. Из «Денискиных рассказов» мы твёрдо усвоили, что «всё тайное становится явным», и этот закон позволяет нам разглядеть не только скрытую Дениской манную кашу, но и эту загадочную радиацию. В 1910 году Чарльз Вильсон собрал прибор, который может показывать, делать явным, туманный след, который оставляет пролетающая частица радиоактивного (ионизирующего) излучения. Этот прибор мы сегодня так и называем «камера Вильсона».
Вот видео, на котором показано, как работает камера Вильсона. Это точно похоже на маленькое живое Солнце!
Откуда берутся эти частицы? В опыте на видео источником является кусочек радиоактивного материала — урана. Уран можно добыть из-под земли где есть урановые месторождения. Добытый уран очищают от примесей, отделяют одни виды (то есть изотопы) урана от других, и из наиболее подходящего урана делают радиоактивное топливо для атомных электростанций. Уран и некоторые другие вещества имеют такую особую структуру атомов, что атомы время от времени самопроизвольно разрушаются и выстреливают из себя упомянутые выше частицы.
Однако и из без радиоактивных веществ в окружающем мире полно радиации. У поверхности Земли, где мы обитаем она ничтожна — космическую радиацию гасит (поглощает) атмосфера Земли. А вот весь космос буквально пронизан радиацией, распростаняющейся практичкески отовсюду. Каждая звезда, большая планета, компактный объект или диск вокруг чёрной дыры, всё это — источники радиации.
Если на поверхности Земли радиация мала и не мешает нашему существованию, то нахождение в космосе или вблизи радиоактивных веществ может быть опасным для здоровья человека. Заряженные частицы проникают внутрь и портят, буквально ломают, молекулы в клетках живых существ. Живые существа сопротивляются радиации — восстанавливают всё, что сломано. Но если ионизирующих частиц слишком много, то организм может не успеть справиться со всеми поломками, и тогда начинается лучевая болезнь. Опасность радиации в том, мы не ощущаем её воздействие. Контролировать уровень радиации люди могут с помощью специальных приборов; а защищаться — удаляясь от источников радиации на безопасное расстояние или используя защитные материалы, которые не пропускают ионизирующие частицы. Например, пластина из свинца или толстый слой асфальта могут быть хорошей защитой. Придуманы и гораздо более лёгкие защитные материалы, они используются для защиты космонавтов.
Прочитать ещё 4 ответа
Чем химический элемент отличается от вещества?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Чем отличается элемент от вещества ?????
✅Вещество- это то, из чего состоят физические тела.Является одной из форм материи
✅Выделяют простые вещества,состоящие из атомов одного элемента
Например, О2,Сl2,N2
И сложные вещества ,состоящие из атомов двух или более элементов
Например, Н2О,СО2,С6Н12О6
✅Элемент-это совокупность атомов с одинаковым зарядом атомных ядер
Элементы представлены в таблице Менделеева
✅Если сказать:«Кислород -это газ»,то здесь понятно,что это вещество
Если сказать: «Кислород входит в состав воды», то здесь можно сделать вывод о том,что кислород-это элемент
Прочитать ещё 2 ответа
Источник
