Какой закон лежит в основе расчетов калорийности продуктов питания гесса
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 ноября 2019;
проверки требуют 2 правки.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
- Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе (при p,T = const или V,T = const), всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Иными словами, закон Гесса есть утверждение о том, что тепловой эффект реакции (ΔQp = ΔHp,T или ΔQV=ΔUV,T) является функцией состояния. Тепловой эффект реакции (который определён только для изобарно-изотермического или для изохорно-изотермического процессов) нельзя путать с теплотой (Q), выделяемой или поглощаемой в ходе процесса или реакции. В общем случае теплота не является функцией состояния и не описывается законом Гесса.
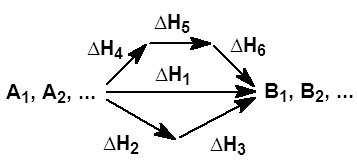
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1841 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Следствия из закона Гесса[править | править код]
- Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
- Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
- Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры
- Если начальное и конечное состояния химической реакции (реакций) совпадают, то их тепловой эффект равен нулю.
Примеры применения[править | править код]
Пример 1.
Вопрос:
- Найти энергию кристаллической решётки хлорида калия.
Дано:
- ΔHf, 298(KCl) = -435,56 kJ/mol
- ΔH298 атомизации(K (s)) = 128,74 kJ/mol
- ΔH298 ионизации(K (g)) = 418 kJ/mol
- ΔH298 диссоциации(Cl2 (g)) = 238,26 kJ/mol
Сродство хлора к электрону = -363,66 kJ/mol
По определению, каждая из указанных величин – точно так же, как изменения энтальпий реакций образования веществ (которые кратко на химическом профессиональном жаргоне называют “энтальпии веществ” или “энтальпии образования веществ”) и точно так же, как изменения энтальпий реакций сгорания веществ (на профессиональном жаргоне “энтальпии сгорания”) – точно так же и эти тепловые эффекты характеризуют каждый определённую реакцию. Для начала, выписываем эти реакции, закреплённые за названиями тепловых эффектов (для удобства реакции ниже будут пронумерованы):
ΔHf, 298(KCl) характеризует реакцию (№1) образования KCl из простых веществ, устойчивых при данных p, T:
- K (s) + 0,5Cl2 (g) → KCl (s)
ΔH298 атомизации(K (s)) характеризует реакцию (№2):
- K (s) → K (g)
ΔH298 ионизации(K (g)) характеризует реакцию (№3):
- K (g) → K+ + e–(g)
ΔH298 диссоциации(Cl2 (g)) характеризует реакцию (№4):
- Cl2 (g) → 2Cl (g)
Сродство хлора к электрону характеризует реакцию (№5):
- Cl (g) + e–(g) → Cl–(g)
Задача заключается в том, чтобы из этих уравнений реакций сложить заданное уравнение реакции – энергия кристаллической решётки KCl характеризует реакцию (№6):
- K+ + Cl–(g) → KCl (s)
Для этого возьмём реакции в такой комбинации: №6 = №1 + (–0,5)№4 + (–1)№5 + (–1)№2 + (–1)№3 = №1 – 0,5№4 – №5 – №2 – №3. При сложении уравнений реакций тепловые эффекты складываются (с теми же коэффициентами, на которые умножали реакции). То есть ΔH6 = ΔH1 – 0,5ΔH4 – ΔH5 – ΔH2 – ΔH3
- K (s) + 0,5Cl2 (g) → KCl (s)
- (K (s) → K (g))⋅(–1) = (K (g) → K (s))
- K+ + e–(g) →K (g)
- Cl–(g) → Cl (g) + e–(g)
- Cl (g) → 0,5Cl2 (g)
Сумма этих реакций:
- K (s) + Cl2 (g) + K (g) + K+ + e–(g) + Cl–(g) + Cl (g) → 0,5Cl2 (g) + Cl (g) + e–(g) + K (g) + K (s) + KCl (s)
После сокращения получаем:
- K+ + Cl–(g) → KCl (s)
Что и требовалось – значит, суммирование реакций произведено верно и полученный суммарный тепловой эффект характеризует именно искомую реакцию.
Пример 2.
Дано:
- B2O3 (s) + 3H2O (g) → 3O2 (g) + B2H6 (g) (ΔH = 2035 kJ/mol)
- H2O (l) → H2O (g) (ΔH = 44 kJ/mol)
- H2 (g) + (1/2)O2 (g) → H2O (l) (ΔH = -286 kJ/mol)
- 2B (s) + 3H2 (g) → B2H6 (g) (ΔH = 36 kJ/mol)
Найти ΔHf реакции:
- 2B (s) + (3/2) O2 (g) → B2O3 (s)
После умножения реакций на числа (в том числе на -1, то есть обращения реакций), а соответственно – и умножения на те же числа изменений энтальпии этих реакций, получаем:
- B2H6 (g) + 3O2 (g) → B2O3 (s) + 3H2O (g) (ΔH = -2035 kJ/mol)
- 3H2O (g) → 3H2O (l) (ΔH = -132 kJ/mol)
- 3H2O (l) → 3H2 (g) + (3/2) O2 (g) (ΔH = 858 kJ/mol)
- 2B (s) + 3H2 (g) → B2H6 (g) (ΔH = 36 kJ/mol)
После сложения этих уравнений реакций и приведения подобных членов получившегося уравнения, получаем:
- 2B (s) + (3/2) O2 (g) → B2O3 (s) (ΔH = -1273 kJ/mol)
Литература[править | править код]
- Карапетьянц М. Х. Введение в теорию химических процессов. — М.: Высшая школа, 1981. 304 с.
- Стромберг А. Г., Семченко Д. П. Физическая химия — М.: Высшая школа, 1999. 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия — М.: Мир, 1978. 645 с.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. — М.: Мир, 2002. 461 с.
- Борисов И. М. Основы электрохимии: учеб. пособие. -Уфа: Изд-во БГПУ, 2009.- 115 с.
Ссылки[править | править код]
- Открытый колледж. Химия — Закон Гесса
- Лекции по физхимии (ЮФУ) — Закон Гесса
Источник
1. Что изучает химическая термодинамика:
1) скорости протекания химических превращений и механизмы этих превращений;
2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу;
3) условия смещения химического равновесия;
4) влияние катализаторов на скорость биохимических процессов.
2. Открытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
3. Закрытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
4. Изолированной системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещен ной в термостат?
1) изолированной;
2) открытой;
3) закрытой;
4) стационарной.
6.К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле?
1) изолированной;
2) открытой;
3) закрытой;
4) стационарной.
7.К какому типу термодинамических систем принадлежит живая клетка?
1) открытой;
2) закрытой;
3) изолированной;
4) равновесной.
8. Какие параметры термодинамической системы называют экстенсивными?
1) величина которых не зависит от числа частиц в системе;
2) величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния системы;
4) величина которых зависит от времени.
9. Какие параметры термодинамической системы называют интенсивными?
!) величина которых не зависит от числа частиц в системе;
2) величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния;
4) величина которых зависит от времени.
10. Функциями состояния термодинамической системы называют такие величины, которые:
1) зависят только от начального и конечного состояния системы;
2) зависят от пути процесса;
3) зависят только от начального состояния системы;
4) зависят только от конечного состояния системы.
11. Какие величины являются функциями состояния системы: а) внутренняя энергия; б) работа; в) теплота; г) энтальпия; д) энтропия.
1) а, г, д;
2)6;
3) все величины;
4) а, б, в, г.
12. Какие из следующих свойств являются интенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
1) а, б, г;
2)в,д,е;
3) б, в, г, е;
4) а, в, д.
13.Какие из следующих свойств являются экстенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
1) в, д, е;
2) а, б, г;
3) б, в, г, е;
4) а, в, г.
14. Какие формы обмена энергией между системой и окружающей средой рассматривает термодинамика: а) теплота; б) работа; в) химическая; г) электрическая; д) механическая; е) ядерная и солнечная?
1)а,б;
2) в, г,д, е;
3) а, в, г, д, е;
4) а, в, г, д.
15.Процессы, протекающие при постоянной температуре, называются:
1) изобарическими;
2) изотермическими;
3) изохорическими;
4) адиабатическими.
16. Процессы, протекающие при постоянном объеме, называются:
1) изобарическими;
2) изотермическими;
3) изохорическими;
4) адиабатическими.
17. Процессы, протекающие при постоянном давлении, называются:
1) изобарическими;
2) изотермическими;
3) изохорическими;
4) адиабатическими.
18. Внутренняя энергия системы — это:
1) весь запас энергии системы, кроме потенциальной энергии ее положения и кинетической энергии системы в целом;
2) весь запас энергии системы;
3) весь запас энергии системы, кроме потенциальной энергии ее положения;
4) величина, характеризующая меру неупорядоченности расположения частиц системы.
19. Какой закон отражает связь между работой, теплотой и внутренней энергией системы?
1) второй закон термодинамики;
2) закон Гесса;
3) первый закон термодинамики;
4) закон Вант-Гоффа.
20. Первый закон термодинамики отражает связь между:
1) работой, теплотой и внутренней энергией;
2) свободной энергией Гиббса, энтальпией и энтропией системы;
3) работой и теплотой системы;
4) работой и внутренней энергией.
21. Какое уравнение является математическим выражением первого закона термодинамики для изолированных систем?
l)AU=0
2)AU=Q-p-AV
3)AG = AH-TAS
22. Какое уравнение является математическим выражением первого закона термодинамики для закрытых систем?
1)AU=0;
2)AU=Q-p-AV;
3) AG = AH – T*AS;
4) AS > 0.
23. Постоянной или переменной величиной является внутренняя энергия изолированной системы?
1) постоянной;
2) переменной.
24. В изолированной системе протекает реакция сгорания водорода с образованием жидкой воды. Изменяется ли внутренняя энергия и энтальпия системы?
1) внутренняя энергия не изменится, энтальпия изменится;
2) внутренняя энергия изменится, энтальпия не изменится;
3) внутренняя энергия не изменится, энтальпия не изменится;
4) внутренняя энергия изменится, энтальпия изменится.
25. При каких условиях изменение внутренней энергии равно теплоте, получаемой системой из окружающей среды?
1) при постоянном объеме;
2) при постоянной температуре;
3) при постоянном давлении;
4) ни при каких.
26. Тепловой эффект реакции, протекающей при постоянном объеме, называется изменением:
1) энтальпии;
2) внутренней энергии;
3) энтропии;
4) свободной энергии Гиббса.
27. Энтальпия реакции — это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотермических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотермических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
28.Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются:
1) эндотермическими;
2) экзотермическими;
3) экзэргоническими;
4) эндэргоническими.
29. При каких условиях изменение энтальпии равно теплоте, получаемой системой из окружающей среды?
1) при постоянном объеме;
2) при постоянной температуре;
3) при постоянном давлении;
4) ни при каких.
30. Тепловой эффект реакции, протекающей при постоянном давлении, называется изменением:
1) внутренней энергии;
2) ни одно из предыдущих определений неверно;
3) энтальпии;
4) энтропии.
31.Какие процессы называют эндотермическими?
1) для которых АН отрицательно;
2) для которых AG отрицательно;
3) для которых АН положительно;
4) для которых AG положительно.
32. Какие процессы называют экзотермическими?
1) для которых АН отрицательно;
2) для которых AG отрицательно;
3) для которых АН положительно;
4) для которых AG положительно.
33. Укажите формулировку закона Гесса:
1) тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции;
2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы;
3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системы;
4) тепловой эффект реакции не зависит от начального и конечного состояния системы, а зависит от пути реакции.
34.Какой закон лежит в основе расчетов калорийности продуктов питания?
1) Вант-Гоффа;
2) Гесса;
3) Сеченова;
4) Рауля.
35.При окислении каких веществ в условиях организма выделяется большее количество энергии?
1) белков;
2) жиров;
3) углеводов;
4) углеводов и белков.
36. Самопроизвольным называется процесс, который:
1) осуществляется без помощи катализатора;
2) сопровождается выделением теплоты;
3) осуществляется без затраты энергии извне;
4)протекает быстро.
37. Энтропия реакции — это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотермических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотермических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
38. Какой функцией состояния характеризуется тенденция системы к достижению вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц?
1) энтальпией;
2) энтропией;
3) энергией Гиббса;
4) внутренней энергией.
39. В каком соотношении находятся энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела:
I) S (г) > S (ж) > S (тв);
2)S(тв)>S(ж)>S(г);
3)S(ж)>S(г)>S(TB);
4) агрегатное состояние не влияет на значение энтропии.
40. В каком из следующих процессов должно наблюдаться наибольшее положительное изменение энтропии:
1) СН3ОН (тв) –> СН,ОН (г);
2) СH3OH (тв) –> СН3ОН (ж);
3) СН,ОН (г) -> CH3OH (тв);
4) СН,ОН (ж) -> СН3ОН (тв).
41. Выберите правильное утверждение: энтропия системы увеличивается при:
1) повышении давления;
2) переходе от жидкого к твердому агрегатному состоянию
3) повышении температуры;
4) переходе от газообразного к жидкому состоянию.
42.Какую термодинамическую функцию можно использовать, чтобы предсказать возможность самопроизвольного протекания реакции в изолированной системе?
1) энтальпию;
2) внутреннюю энергию;
3) энтропию;
4) потенциальную энергию системы.
43. Какое уравнение является математическим выражением 2-го закона термодинамики для изолированных систем?
1)AU=0;
2)AS>QT
3)AS<QT
4) АН = 0.
44. Если система обратимым образом получает количество теплоты Q при температуре Т, то об T;
2) возрастает на величину Q/T;
3) возрастает на величину, большую Q/T;
4) возрастает на величину, меньшую Q/T.
45. В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества продукта. Как изменяется энтропия такой системы?
1) увеличивается
2) уменьшается
3) не изменяется
4) достигает минимального значения
46. Укажите, в каких процессах и при каких условиях изменение энтропии может быть равно работе процесса?
1) в изобарных, при постоянных Р и Т;
2) в изохорных, при постоянных V и Т;
З) изменение энтропии никогда не равно работе;
4) в изотермических, при постоянных Р и Т
47. Как изменится связанная энергия системы TS при нагревании и при ее конденсации?
1) при нагревании растет, при конденсации уменьшается;
2) при нагревании уменьшается, при конденсации растет;
3) не происходит изменение T-S;
4) при нагревании и конденсации растет.
48. Какие параметры системы необходимо поддерживать постоянными, чтобы по знаку изменения энтропии можно было судить о направлении самопроизвольного протекания процесса?
1) давление и температуру;
2) объем и температуру;
3) внутреннюю энергию и объем;
4) только температуру.
49. В изолированной системе все самопроизвольные процессы протекают в сторону увеличения беспорядка. Как при этом изменяется энтропия?
1) не изменяется;
2) увеличивается;
3) уменьшается;
4) сначала увеличивается, а затем уменьшается.
50. Энтропия возрастает на величину Q/T для:
1) обратимого процесса;
2) необратимого процесса;
3) гомогенного;
4) гетерогенного.
51 Как изменяется энтропия системы за счет прямой и обратной реакции при синтезе аммиака?
1) прямая реакция идет с уменьшением энтропии, обратная — с увеличением;
2) прямая реакция идет с увеличением энтропии, обрат-лая __с уменьшением;
3) энтропия не изменяется в ходе реакции;
4) энтропия увеличивается для прямой и обратной реакции.
52. Какими одновременно действующими факторами определяется направленность химического процесса?
1) энтальпийным и температурным;
2) энтальпийным и энтропийным;
3) энтропийным и температурным;
4) изменением энергии Гиббса и температуры.
53.В изобарно-изотермических условиях максимальная работа, осуществляемая системой:
1) равна убыли энергии Гиббса;
2) больше убыли энергии Гиббса;
3) меньше убыли энергии Гиббса;
4) равна убыли энтальпии.
54. Какие условия необходимо соблюдать, чтобы максимальная работа в системе совершалась за счет убыли энергии Гиббса?
1) необходимо поддерживать постоянными V и t;
2) необходимо поддерживать постоянными Р и t;
3) необходимо поддерживать постоянными АН и AS;
4) необходимо поддерживать постоянными PиV
55. За счет чего совершается максимальная полезная работа химической реакции при постоянных давлении и температуре?
1) за счет убыли энергии Гиббса;
2) за счет увеличения энтропии;
3) за счет увеличения энтальпии;
4) за счет уменьшения энтропии.
56.За счет чего совершается максимальная полезная работа живым организмом в изобарно-изотермических условиях?
1) за счет убыли энтальпии;
2) за счет увеличения энтропии;
3) за счет убыли энергии Гиббса;
4) за счет увеличения энергии Гиббса.
57. Какие процессы называют эндэргоническими?
1)H<0;
2) AG < 0;
3)AH>0;
4) AG > 0.
58.Какие процессы называют экзэргоническими?
1)AH<0;
2) AG < 0;
3)AH>0;
4) AG > 0.
59.Самопроизвольный характер процесса лучше определять путем оценки:
1)энтропии;
3) энтальпии;
2) свободной энергии Гиббса;
4) температуры.
60. Какую термодинамическую функцию можно использовать для предсказания возможности самопроизвольного протекания процессов в живом организме?
1) энтальпию;
3) энтропию;
2) внутреннюю энергию;
4) свободную энергию Гиббса.
61. Для обратимых процессов изменение свободной энергии Гиббса…
1) всегда равно нулю;
2) всегда отрицательно;
3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
62. Для необратимых процессов изменение свободной энергии:
1) всегда равно нулю;
2) всегда отрицательно;
3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
63.В изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса:
1) не меняется;
2) увеличивается;
3) уменьшается;
4) достигает максимального значения.
64. Для некоторой химической реакции в газовой фазе при постоянных Р и TAG > 0. В каком направлении самопроизвольно протекает эта реакция?
1) в прямом направлении;
2) не может протекать при данных условиях;
3) в обратном направлении;
4) находится в состоянии равновесия.
65. Каков знак AG процесса таяния льда при 263 К?
1) AG > 0;
2) AG = 0;
3) AG < 0;
4) AG < 0.
66. В каком из следующих случаев реакция неосуществима при любых температурах?
1)AH>0;AS>0;
2)AH>0;AH<0;
3)A#<0;AS<0;
4)AH= 0;AS = 0.
67.В каком из следующих случаев реакция возможна при любых температурах?
1)ДH<0;ДУ>0;
2)AH<Q;AS<0;
3) AH > 0; AS > 0;
4)AH = 0;AS = 0.
68. Если АН < О и AS < О, то в каком случае реакция может протекать самопроизвольно?
1) [АН] > [T4AS];
2) при любых соотношениях АН и TAS;
3){AH]<[T4AS];
4) [АН] = [Т-А S].
69. При каких значениях по знаку АН и AS в системе возможны только экзотермические процессы?
1)AH>0,Д£>0;
2) АН< О, AS > 0;
3) AH#< 0, AS < 0;
4) AH > 0, AS < 0.
70.При каких соотношениях АН и T* AS химический процесс направлен в сторону эндотермической реакции:
1)AH<TAS,
2)АH> T-AS;
3)АH= TAS;
4)AHTAS.
71. При каких постоянных термодинамических параметрах изменение энтальпии может служить критерием направления самопроизвольного процесса? Какой знак DH в этих условиях указывает на самопроизвольный процесс?
1) при постоянных S и Р, АН < 0;
3) при постоянных Put, АН < 0;
2) при постоянных 5 и Р, АН > 0;
4) при постоянных Vn t, АН > 0.
72. Можно ли и в каких случаях по знаку изменения энтальпии в ходе химической реакции судить о возможности ее протекания при постоянных Т и Р1
1) можно, если ЛЯ » T-AS;
2) при данных условиях нельзя;
3) можно, если АН « T-AS;
4) можно, если АН = T-AS.
73. Реакция ЗН2 + N2 -> 2NH3 проводится при 110°С, так что все реагенты и продукты находятся в газовой фазе. Какие из указанных ниже величин сохраняются в ходе реакции?
1) объем;
2) энтропия;
3) энтальпия;
4) масса.
74. Какие из следующих утверждений верны для реакций, протекающих в стандартных условиях?
1) эндотермические реакции не могут протекать самопроизвольно;
2) эндотермические реакции могут протекать при достаточно низких температурах;
3) эндотермические реакции могут протекать при высоких температурах, если AS > 0;
4) эндотермические реакции могут протекать при высоких температурах, если AS <0.
75. Каковы особенности биохимических процессов: а) подчиняются принципу энергетического сопряжения; б) как правило обратимы; в) сложные; г) только экзэргонические (AG < 0); д) большинство необратимо.
1) а, б, в, г;
2) б, в, г;
3) а, 6, в;
4) в, д.
76. Экзэргонические реакции в организме протекают самопроизвольно, так как:
1) AG > 0;
реакции
2) AG <0;
реакции
У) AG =0;
реакции
4)AG > 0.
реакции
77. Эндэргонические реакции в организме требуют подвода энергии, так как:
1)AG >0;
реакции
2) AG <0;
реакции
3) AG = 0;
реакции
4) AG <0.
реакции
78. При гидролизе любого пептида АН < 0, AS > 0, будет ли данный процесс протекать самопроизвольно?
1) будет, так как AG > 0;
2) будет, так как AG < 0;
3) не будет, так как AG > 0;
4) не будет, так как AG < 0.
79. Калорийностью питательных веществ называется энергия:
1) выделяемая при полном окислении 1 г питательных веществ;
2) выделяемая при полном окислении 1 моль питательных веществ;
3) необходимая для полного окислении 1 г питательных веществ;
4) необходимая для полного окислении 1 моль питательных веществ.
80. Для процесса тепловой денатурации многих ферментов ЛЯ > 0 и AS > 0. Может ли данный процесс протекать самопроизвольно?
1) может при высоких температурах, так как T-AS > |АД];
2) может при низких температурах, так как T-AS < |AH);
3) не может, так как T-AS > |AH];
4) не может, так как T-AS < |AH|.
81. Для процесса тепловой гидратации многих белков АН < 0 и AS < 0. Может ли данный процесс протекать самопроизвольно?
1) может при достаточно низких температурах, так как |AH| > T-AS;
2) может при достаточно низких температурах, так как |АЯ| < |T-AH|;
3) может при высоких температурах, так как |АH) < | T-AS[;
4) не может ни при каких температурах.
82. Для процесса фотосинтеза — образование глюкозы из углекислого газа и воды, AH > 0 и AS < 0. Может ли данный процесс протекать самопроизвольно?
1) процесс неосуществим при любых температурах;
2) процесс осуществим при любых температурах;
3) процесс осуществим при высоких температурах.
4) процесс осуществим при низких температурах
Источник
