Какой тип реакции характерен для свойств алканов обусловленных
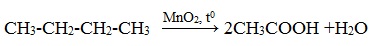
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
![]() Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
![]()
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
![]()
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
![]()
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

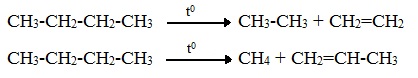
2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
![]()
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:![]()
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.

Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
![]()
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.

Источник
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Для определения химических свойств и химической активности алканов рассмотрим виды связей, образующих молекулы. С-С-связи в молекулах алканов – ковалентные неполярные, связи С-Н – ковалентные малополярные (разница в электроотрицательности составляет 0,4). Такие связи достаточно прочные, поэтому при комнатной температуре ни кислоты, ни щелочи, ни окислители на алканы не действуют.
Для алканов, как насыщенных УВ, не характерны реакции присоединения, но характерны реакции замещения, разложения (разрыва С-С связей), элиминирования (отщепления), изомеризации (в том числе циклизации) и окисления в жестких условиях.
1. Реакции радикального замещения $S_R$
В реакциях замещения алканов легче всего идет замещение при третичном атоме углерода, затем при вторичном, труднее всего – при первичном.
а) галогенирование.
Условием протекания реакции является УФ-освещение и нагревание. Скорость реакции зависит от активности галогена. Так, фтор не только замещает атомы водорода, но и разрушает углерод-углеродные связи, а иодирование протекает настолько медленно, что обычно не используется на практике. Чаще всего проводится хлорирование или бромирование алканов, которое протекает по гомолитическому (радикальному) механизму (см. тему”Типы и механизмы реакций в органической химии”). Галогенирование протекает в несколько стадий, в результате чего можно заместить все атомы водорода на атомы хлора. Для примера рассмотрим стадии хлорирования этана:

Стадия 1 называется стадией инициирования, стадии 2а и 2b – роста цепи. На стадиях 3a, 3b и 3с происходит обрыв цепи.
б) нитрование по Коновалову.
Условием протекания реакции является использование 13-15% азотной кислоты $HNO_3$ при температуре $130-140^0C$. Реакция протекает по свободно-радикальному механизму.

Также, как и при галогенировании алканов, образуется смесь продуктов с преимущественным образованием продуктов нитрования третичного атома углерода:

В более жестких условиях нитрование газообразных алканов может осуществляться оксидами азота или парами азотной кислоты при температуре $420^0-480^0C$ (нитрование по Гессу), при этом происходит разрыв С-С связей и образуется смесь нитроалканов:
В случае нитрования метана образуется нитрометан. Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе.
в) сульфирование
Сульфирование алканов проводится в жестких условиях и протекает с образование сульфокислот. Серная кислота при обыкновенной температуре не действует на парафины; при высокой температуре действует как окислитель. Парафиновые углеводороды с числом углеродных атомов более шести при нагревании до температуры кипения сульфируются олеумом (15% $SO_3$). При слабом нагревании дымящая серная кислота также может действовать на парафиновые углеводороды, особенно на углеводороды изостроения, образуя сульфокислоту и воду:
$C_6H_14 + H_2SO_4 +SO_3 longrightarrow C_6H_{13}-SO_3H + H_2O$
Прямое сульфинирование алканов протекает с трудом и сопровождается, как правило, окислением. Подобные реакции редко используют в лабораторном синтезе, но находят практическое применение для сульфинирования полимеров, например – полиэтилена, с целью их модификации. Значительно легче сульфируются углеводороды при совместном действии $SO_3$ и $O_2$ (сульфо-окисление), а также $SO_2$ и $Cl_2$ (сульфохлорирование). Обе реакции имеют радикальный характер и инициируются пероксидами, УФ или гамма – облучением:
2. Реакции окисления
Реакции окисления алканов включают два вида – полное окисление (сгорание) и неполное окисление в присутствии катализаторов или неорганических окислителей.
а) горение (полное окисление) (см. подробно тему “ОВР в органической химии”)
$2C_2H_6 +7O_2 longrightarrow 4CO_2 + 6H_2O +Q$
При недостатке кислорода образуется угарный газ или углерод:
$2C_2H_6 + 5O_2 longrightarrow 4CO + 6H_2O +Q$
$2C_2H_6 + 3O_2 longrightarrow 4C + 6H_2O +Q$
б) Неполное окисление
Способность низших парафинов к окислению зависит от длины цепи: с удлинением цепи температура окисления понижается. Окисление может протекать как с разрывом, так и без разрыва С-С связей. Условиями протекания реакции неполного каталитического окисления является температурный режим, повышенное давление и наличие катализатора. Чаще всего в качестве катализатора окисления алканов используют хлорид олова, соли кобальта. Продуктами, в зависимости от условий, могут быть спирты, альдегиды, кетоны или карбоновые кислоты

Окисление алканов также проводится в присутствии солей переходных металлов (Mn, Cr и др.), но протекает в жестких условиях с образованием преимущественно вторичных продуктов окисления – карбоновых кислот:
$2C_4H_{10} +5O_2 longrightarrow 4CH_3COOH +2 H_2O$
Подробно см. тему “ОВР в органической химии”
Запомнить! В обычных условиях алканы перманганатом калия не окисляются (не обесцвечивают раствор $KMnO_4$).
3. Термическая обработка
Термическая обработка алканов имеет промышленное значение, так как включает такие важные технологические процессы, как крекинг и пиролиз (подробно см. тему “Переработка нефти”). В результате каталитического крекинга получают ценные органические вещества: этилен, бутадиен, ароматические УВ, кокс. Кроме того, в результате изомеризации над окисью алюминия $Al_2O_3$ образуются изомерные алканы, которые повышают октановое число бензинов.
4. Реакции отщепления (элиминирования)
а) внутримолекулярное дегидрирование
Определение
Внутримолекулярное дегидрирование предельных УВ – это процесс отщепления молекул водорода у соседних атомов в углеводородной цепи, приводящий к образованию кратных связей или замыканию цикла (начиная с $С_5$).
В зависимости от условий, дегидрирование алканов может приводит к образованию одной или нескольких двойных связей:

Процессы циклизации гексана с последующим отщеплением трех молекул водорода лежат в основе получения бензола. Аналогично получаются и его производные:


б) межмолекулярное дегидрирование
Определение
Межмолекулярное дегидрирование – отщепления атомов водорода от двух молекул, приводящее к образованию непредельных УВ с более длинной цепью
В промышленности находит широкое практическое применение пиролиз метана, лежащий в основе получения ацетилена, протекающий по механизму межмолекулярного дегидрирования:
Дегидрирование проводится при повышенных температурах в присутствии катализаторов
Запомнить!
Ni, $Al_2O_3, Cr_2O_3, ZnO$ – катализаторы дегидрирования с образованием ациклических УВ.
Pt – катализатор процессов циклизации и ароматизации
Химические свойства циклоалканов
Циклоалканы имеют в своей структуре только одинарные связи, поэтому по своим свойствам сходны с алканами: малоактивны, горючи, атомы водорода в них могут замещаться галогенами. Химические свойства циклоалканов и их химическая устойчивость определяются размерами цикла, Поэтому циклоалканы с циклами, образованными пятью (циклопентан и его производные) и более атомами углерода, по химическим свойствам напоминают алканы, то есть являются насыщенными. Это значит, что для них будут также характерны реакции замещения, элиминирования, расщепления С-С связей. Наиболее устойчивыми являются шестичленные циклы (циклогексан и его производные), в которых отсутствуют угловое и другие виды напряжения
Малые циклы – трех- (циклопропан) и четырехчленный (циклобутан), являясь насыщенными, тем не менее, резко отличаются от предельных углеводородов. Напряженность таких циклов обусловлена малыми величинами валентных углов ($60^0$ и $90^0$ соответственно, по сравнению с углом $109^0$, характерным для предельных углеводородов ($sp^3$-гибридизация).
Атомы заместителей в циклоалканах с малыми циклами могут находится в цис- или транс-положениях относительно плоскости цикла, поэтому для таких циклоалканов, также как и для соединений с кратной связью, характерна геометрическая изомерия:

Как уже было сказано, по химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и циклобутан склонны к реакциям присоединения, протекающим с разрывом цикла, проявляя тем самым характер ненасыщенных соединений. то есть сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, поэтому вступают в реакции замещения.
Рассмотрим отдельно химические свойства для циклоалканов с малыми и с большими циклами.
Химические свойства циклоалканов с малыми циклами (С3-С4)
1. Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование).
Реакции гидрирования протекают достаточно легко и сопровождаются разрывом цикла:
Также, достаточно легко циклопропан и циклобутан присоединяют галогены и галогеноводороды:
Химические свойства циклоалканов с большими циклами (С5-С6)
1. Наиболее важное промышленное значение имеет реакция дегидрирования циклогексана, лежащая в основе процесса ароматизации при каталитическом крекинге (платформинге) нефти.

2. Галогенирование – (хлорирование, бромирование) протекают по радикальному механизму замещения атомов водорода:

3. Реакции окисления: циклы, как малые, так и большие, разрывается и концевые атомы углерода окисляются до карбоксильной группы -COOH:
$C_5H_{10} + [O] rightarrow HOOC-(CH_2)_3-COOH$
4. Горение: все как обычно — все органические веществ сгорают с образованием $CO_2$ и $H_2O$. В общем виде можно записать:
$С_nH_{2n} + 3n/2 O_2 = nCO_2 + nH_2O$
Источник
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт «Отношение метана к раствору перманганата калия и бромной воде»
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
![]()
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400оC.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
Хлорирование метана:
(hv — формула кванта света)
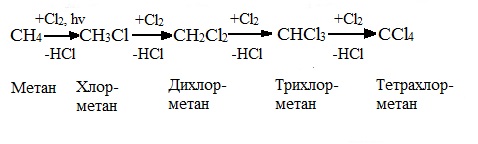
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:

Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
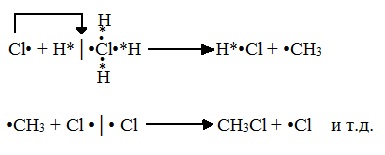
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
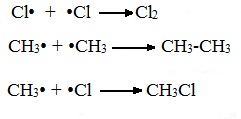
Монохлорирование метана
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле: 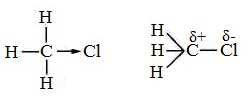
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
![]()
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт «Взаимодействие алканов с бромом при нагревании»
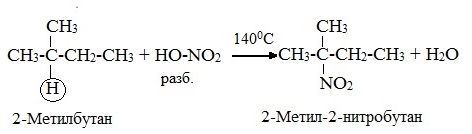
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 1400С и при повышенном или нормальном давлении – реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
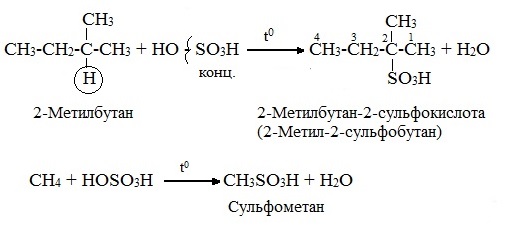
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
Реакции окисления
Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений. 
При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
![]()
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Сжиженная пропан-бутановая смесь, горение
Видеоопыт «Взрыв смеси метана с кислородом»
Видеоопыт «Горение жидких алканов»
Видеоопыт «Горение твердых углеводородов (на примере парафина)»
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
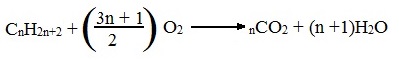
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
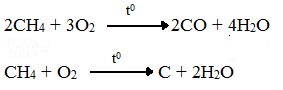
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:![]()
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
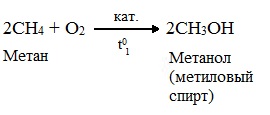
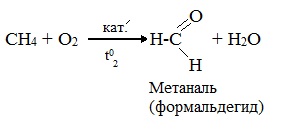
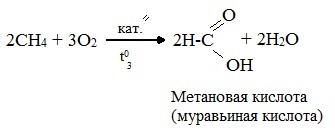
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Учебный фильм «Каталитическое окисление высших парафиновых углеводородов»
Термические превращения алканов (реакции разложения)
1. Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 7000С: