Какой продукт преимущественно образуется при присоединении одной

Реакции присоединения к сопряжённым диенам
Гидрирование (присоединение водорода)
При взаимодействии бутадиена-1,3 с водородом в момент выделения (например, в реакции натрия со спиртомC2H5OH + Na• → C2H5O–Na+ + H•) получается бутен-2, то есть происходит 1,4-присоединение. Формально этот процесс можно представить следующим образом: при действии реагента двойные связи разрываются, к крайним атомам углерода С(1) и С(4) присоединяются атомы водорода (H•), а свободные валентности (неспаренные электроны) образуют π-связь между атомами С(2) и С(3):

В присутствии катализатора Ni образуется продукт полного гидрирования:
 (н-бутан)
(н-бутан)
Изопрен реагирует аналогично:
CH2=С(CH3)–CH=CH2 + 2H (CH3)2C=CH–CH3 (2-метилбутен-2)
CH2=С(CH3)–CH=CH2 + 2H2 (Ni, t) (CH3)2CH–CH2–CH3 (2-метилбутан)
Галогенирование (присоединение галогенов)
Хлор и бром легко присоединяются к алкадиенам по электрофильному механизмуЭлектрофильный механизм характерен для реакций, в которых молекула органического вещества подвергается действию электрофильного реагента (электрофила) – частицы (катиона или молекулы), имеющей свободную орбиталь на внешнем электронном уровне и способной принять пару электронов при образовании ковалентной связи по донорно-акцепторному механизму. подобно алкенам.
При взаимодействии эквимолярных количеств бутадиена-1,3 и брома образуются продукты как 1,2-, так и 1,4-присоединения:

Примечание. По правилам систематической номенклатуры при составлении названий ненасыщенных галогеноуглеводородов нумерацию углеродной цепи начинают от конца, ближайшего к кратной связи. Именно поэтому продукт 1,2-присоединения в данной реакции имеет название 3,4-дибромбутен-1.
Cостав смеси образующихся продуктов зависит от температуры
При +40°C смесь продуктов реакции содержит 80% 1,4-дибромбутена-2 (1,4-присоединение) и 20% 3,4-дибром-бутена-1 (1,2-присоединение), а при -80°C соотношение продуктов 1,4- и 1,2-присоединения обратное (20% и 80%, соответственно).
реакции. При пониженной температуре преобладает продукт 1,2-присоединения, которое происходит с бóльшей скоростью, чем 1,4-присоединение.
Это объясняется тем, что образующиеся на лимитирующей стадии реакции промежуточные частицыО роли промежуточных частиц см. здесь.
– вторичные карбокатионы  (при 1,2-присоединении) более стабильны и поэтому легче образуются, чем первичные
(при 1,2-присоединении) более стабильны и поэтому легче образуются, чем первичные  (при 1,4-присоединении). Повышение температуры реакции смещает равновесие в сторону образования более термодинамически устойчивыхЧем больше заместителей при двойной связи, тем выше термодинамическая стабильность вещества:CH2=CHR 2C=CR2. продуктов 1,4-присоединения.
(при 1,4-присоединении). Повышение температуры реакции смещает равновесие в сторону образования более термодинамически устойчивыхЧем больше заместителей при двойной связи, тем выше термодинамическая стабильность вещества:CH2=CHR 2C=CR2. продуктов 1,4-присоединения.
Следует отметить, что 1,4-присоединение реагентов (кроме водорода) к бутадиену-1,3 приводит к образованию смеси цис- и транс-изомеров (например, изомеры 1,4-дибромбутена-2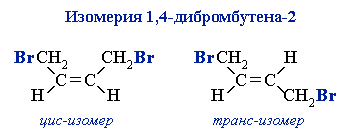 ).
).
В избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана1,2,3,4-Тетрабромбутан образуется в этой реакции в виде смеси стереоизомеров, так как в молекуле содержатся два асимметрических атома углерода: С(2) и С(3).:
CH2Br–CHBr–CHBr–CH2Br
В случае изопрена, кроме реакций 1,2- и 1,4-присоединения, возможно также 3,4-присоединение:
CH2=С(CH3)–CH=CH2 + Br2 CH2=С(CH3)–CHBr–CH2Br
При облучении УФ-светом или в присутствие соединений – источников свободных радикалов (например, пероксидов ROOR) галогены присоединяются к сопряжённым диенам по радикальному механизму с образованием 1,2- (3,4-), 1,4-дигалогеналкенов и 1,2,3,4-тетрагалогеналканов.
Гидрогалогенирование (присоединение галогеноводородов)
Присоединение HCl и HBr к сопряженным диенам происходит также в 1,2- (3,4-) и 1,4-положения и подчиняется тем же закономерностям: с повышением температуры увеличивается доля продукта 1,4-присоединения.

1,2-присоединение – кинетически контролируемая реакция;
1,4-присоединение – термодинамически контролируемая реакция.
Энергетическая диаграмма (интерактивная анимация)
Присоединение воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах). В реакциях несимметричных соединений соблюдается правило Марковникова.
Диеновый синтез (реакция Дильса-Альдера)
В органическом синтезе широко применяется реакция присоединения к сопряженным диенам соединений, содержащих кратные связи (так называемых диенофилов).
Реакция идет как 1,4-присоединение и приводит к образованию циклического продукта (такие реакции называют реакциями циклоприсоединения):
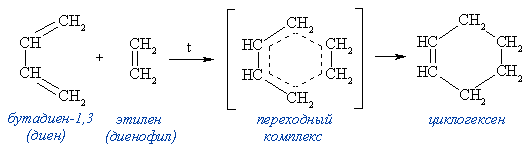
Этилен является слабым диенофилом и данная реакция идёт с невысоким выходом. Обычно в качестве диенофилов используют алкены и алкины, кратная связь у которых активирована электроноакцепторной группой (например, CH2=CHCOOH, CH2=CHCHO, CH2=CHCN, CH2=CHCOOR и т.п.), а также вещества, содержащие в молекуле группы —C=N, =C=N—, =С=О, — N=N—, =S=О и др.
К реакциям присоединения относится также характерная для диенов реакция полимеризации. Этот процесс имеет важное значение в производстве синтетических каучуковКаучуки – это эластичные высоко-молекулярные вещества (эластомеры), из которых путём вулканизации (например, нагреванием с серой) получают резину..
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n+2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода. Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С. Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2-гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Строение бутадиена-1,3 (дивинила)
Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
2-метилбутадиен-1,3
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Строение дивинила
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Например. Изомеры положения двойных связей с формулой С6Н10 – гексадиен-1,3 и гексадиен-2,4
Гексадиен-1,3
Гексадиен-2,4
Межклассовые изомеры – это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой – CnH2n-2.
Например.
Межклассовые изомеры с общей формулой С4Н6 – бутадиен-1,3, бутин-1, циклобутениклобутен
Изомеры состава С4Н6
Изомеры углеродного скелета отличаются строением углеродного скелета.
Например.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 – пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
Изомеры состава С5Н8
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Цис-транс-изомеры
Цискаридзе или транскаридзе?
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Например.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
CH2=CH–CH=CH2
Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
Тривиальные название алкадиенов
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей.
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода.
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
Гидрирование дивинила
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители – вода, CCl4).
При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2:
1,4-Бромирование дивинила
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
1,2-Бромирование дивинила
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
Полное бромирование бутадиена
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
Гидрохлорирование бутадиена
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
1.5. Полимеризация
Полимеризация – это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком.
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
Полимеризация бутадиена
При полимеризации изопрена образуется природный (натуральный) каучук:
Полимеризация изопрена
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
Мягкое окисление дивинила
Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь.
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей – карбоксильная группа СООН, четырех – углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
Продукты окисления фрагментов при двойной связи
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
Жесткое окисление дивинила
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания бутадиена:
2C4H6 + 11O2 → 8CO2 + 6H2O
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана – это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
Дегидрирование бутана
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
Получение изопрена
2. Синтез Лебедева
Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
Синтез Лебедева
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
Получение дивинила из бутандиола
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Получение дивинила из дихлобутана
Источник
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n+2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода. Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С. Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.

Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
![]()
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:

Сопряжение в молекуле алкадиенов можно также схематично изобразить так:

Изображение с сайта orgchem.ru
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4
| Гексадиен-1,3 | Гексадиен-2,4 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен | транс-Алкадиен |
 |  |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)

В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
![]()
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей.
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода.
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):

Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
![]()
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2:

Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:

При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:

1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
. 
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком.
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
![]()
При полимеризации изопрена образуется природный (натуральный) каучук:

2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.

Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь.
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:

2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания бутадиена:
2C4H6 + 11O2 → 8CO2 + 6H2O
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
![]()
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):

2. Синтез Лебедева
Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:

