Какой положительный и какой отрицательный заряд содержится в атоме

Все мы еще со школы знаем, что электрон имеет отрицательный заряд. Но почему?
Чтобы разобраться в этом вопросе сначала нам стоит понять, почему вообще у заряда существует положительный и отрицательный знак?
Все началось еще за долго до открытия электрона. Еще в конце 18 века Бенджамин Франклин занимался изучением атмосферного электричества. И тогда он заметил, что заряженные тела могут вести себя по-разному. Он первым обратил внимание на то, что наэлектризованные тела бывают двух типов. Тогда он и предложил называть их положительными и отрицательными. Именно в этот момент и появилось это разделение зарядов на положительные и отрицательные.
Начиная с этого времени, благодаря этим знаниям, было сконструировано множество источников электрического тока. Разрабатывалось множество электрических цепей. К ним применялось описание, которое использовало понятие о положительном и отрицательном контактах, об аноде и катоде. Хотя на тот момент люди еще не понимали природу и всю глубокую физику, которая кроется в электрическом токе. Тогда не было понятия о существовании таких маленьких частицах как электроны.
Ту идею, что электрический ток создается благодаря движению маленьких частичек, у которых имеется электрический заряд, предложит Джордж Стони в конце 19 века. Именно он ввел в науку такой термин как электрон.
Экспериментально обнаружить и описать электрон удалось Джону Томсону в 1897 году. Он обнаружил, что при облучении цинкового катода ультрафиолетовым светом, с этого катода уносится отрицательный заряд. Изначально он поставил цель нахождения и определения отношения массы и заряда частиц катодного луча, которые он называл корпускулами, но позже он начал использовать термин, предложенный Стони – электрон.
Установка, которую использовал Томсон в своем опыте, называется трубка Гейсслера. Электроны, вылетающие с катода в результате электронной фотоэмиссии, ускоряются в пространстве между катодом и анодом. Далее на их пути попадаются отклоняющие пластины.
Довольно точно измерить величину заряда электрона, в опыте с поляризацией капелек масла, удалось Милликену в 1909 году. Описывать этот опыт в статье я не вижу смысла, т.к. он довольно сложный и требует немалых выкладок формул. Так же в этом опыте было доказано, что электрический заряд дискретен.
Заряд электрона является элементарным, то есть наименьшим в природе. Но это не совсем так: в физике частиц существуют такие объекты, заряд которых меньше заряда электрона, и называются они кварками. Но вот дело в том, что они не способны существовать самостоятельно. Они могут существовать только в связи друг с другом. Если вам интересна тема кварков, то прошу в комментарии. Так, например, объединение двух верхних и одного нижнего кварка дает нам протон, заряд которого по модулю равен заряду электрона. А вот электрон, на данном этапе развития науки, представляется как элементарная и неделимая частица.
Итак, подытожим: придание заряду какого-либо знака, было необходимостью. Так как заряженные тела могут вести себя по-разному. И исторические предпосылки послужили тому, что у электрона оказался отрицательный знак. Если бы Франклин в свое время определил знаки заряда иначе, то электрон тогда был сейчас положительной частицей.
Открытие электрона – это одно из самых выдающихся и значимых достижений в истории науки. Благодаря этому, стало возможным развитие множества разделов физики. Например, физика твердого тела и вытекающая отсюда физика полупроводниковых устройств, на которых сегодня работает практически все электронные девайсы вокруг нас, начиная от микроволновки у вас на кухне, заканчивая космическими аппаратами. Не забывайте оценивать статью и подписываться на канал, дальше вас ждет много интересного!
Всего вам доброго и до скорых встреч!
Источник
С древних времён люди задавались вопросом: «Из чего состоит жизнь?». Философы Древней Греции и Индии предполагали, что мельчайшей частицей всякого вещества в мире, является атом, который, по их мнению, неделим. Истинная природа атома приоткрылась намного позже.
Чтобы понять, как организованы живые системы, мы должны узнать о природе атома, его устройстве, о том, как атомы собираются в молекулы и о способах, которыми эти молекулы соединяются в вещества. Только после этого можно будет говорить о структуре клеток, а затем и организмов. Поэтому знакомство с жизнью на Земле мы начинаем с вопросов биофизики и биохимии.
Во Вселенной любая субстанция, имеющая массу и занимающая место в пространстве, определяется как материя, существующая в форме вещества (физические тела) или в форме поля (свет, гравитация и т.д.). Вещество состоит из очень мелких частиц, называемых атомами. Атом – мельчайшая единица, на уровне которой совершаются основные химические реакции. Из-за их размеров атомы долгое время не могли изучать. Только в начале XVII века учёные смогли осуществить первые эксперименты, раскрывающие физическую природу атомов.
 Строение поваренной соли
Строение поваренной соли
Автор: OpenStax College, CC BY 3.0
Как устроен атом?
Объекты размером с атом можно «увидеть» только косвенно, используя сложную технологию, такую как туннельная микроскопия. Наглядно показав наличие электронов, Джозеф Джон Томсон впервые доказал, что атом состоит из субатомных частиц. В беседе он назвал модель атома «пудингом с изюмом», где роль изюминок выполняют электроны.
 Схема работы сканирующего туннельного микроскопа: control voltages of piezotube; piezoelectric tube with electrodes — трубка с электродами; tunneling current amplifier — амперметр для измерения величины туннельного тока; distance control and scanning unit — модуль для перемещения иглы и контроля расстояния игла-образец; tip — игла; sample — образец, карту рельефа которого требуется построить; tunneling voltage; data processing and display — модуль для обработки результатов измерений и вывода карты рельефа
Схема работы сканирующего туннельного микроскопа: control voltages of piezotube; piezoelectric tube with electrodes — трубка с электродами; tunneling current amplifier — амперметр для измерения величины туннельного тока; distance control and scanning unit — модуль для перемещения иглы и контроля расстояния игла-образец; tip — игла; sample — образец, карту рельефа которого требуется построить; tunneling voltage; data processing and display — модуль для обработки результатов измерений и вывода карты рельефа
Автор: Michael Schmid, CC BY-SA 2.0 at
Но эта точка зрения была опровергнута. Гипотеза, выдвинутая в 1913 году датским физиком Нильсом Бором, обеспечила хорошую отправную точку для понимания современной атомной теории.
Опираясь на модель Эрнеста Резерфорда, Бор предположил, что каждый атом обладает орбитальным облаком крошечных субатомных частиц, называемых электронами, вращающимися вокруг центра, как в миниатюрной Солнечной системе, и что они излучают и поглощают энергию, переходя с одного облака орбиты на другое.
 Электронная конфигурация атома углерода
Электронная конфигурация атома углерода
Автор: Alejandro Porto, CC BY-SA 3.0
В центре каждого атома – маленькое очень плотное ядро, сформированное из двух других видов субатомных частиц: протонов и нейтронов. Современные исследования доказали, что и протоны и нейтроны также не являются неделимыми. Они состоят из кварков.

Обзор физики элементарных частиц
Автор: Headbomb, Creative Commons Attribution-Share Alike 3.0 Unported
Атом и его заряд
Атомы различаются числом протонов в ядре, количество которых определяет атомный заряд, химические свойства и место элемента в периодической таблице Д. И. Менделеева. Внутри ядра скопление протонов и нейтронов удерживается силой, которая работает только на коротких субатомных расстояниях.
Каждый протон несёт положительный (+) заряд, а электрон – отрицательный (-), нейтрон же потому так и называется, что он нейтрален. Если количество электронов в атоме совпадает с количеством протонов, то атом в целом является электрически нейтральным. Химическое поведение атома обусловлено количеством и конфигурацией его электронов.
Атомная масса
Термины «масса» и «вес» часто используются как синонимы, но они имеют несколько разное значение. Масса относится к количеству вещества, а вес описывает силу тяжести, влияющую на субпозицию вещества. Объекты, имеющие одинаковую массу, находясь на Земле будут весить больше, чем если бы они были расположены на Луне, потому что гравитационная сила Земли больше, чем у Луны. Атомная масса равна сумме масс его протонов и нейтронов. Атомы, встречающиеся в природе Земли, содержат от 1до 92 протонов и до 46 нейтронов.
Масса атомов и субатомных частиц измеряется в единицах, называемых дальтонами (Да), или атомных единицах массы (а.е.м.), в химии – «моль». Они очень малы, 1 грамм содержит 602 миллиона миллионов миллиардов а.е.м. (6.02 × 10 23). Протон весит 1,007 Да, нейтрон – 1,009 Да. Электроны весят 1/1840 Да, поэтому они почти не влияют на массу атома.
 Сравнительный размер атома гелия и его ядра
Сравнительный размер атома гелия и его ядра
Автор: User:Murkt, CC BY-SA 3.0
Электроны
Положительные заряды ядра атома нейтрализуются или уравновешиваются отрицательно заряженными электронами, расположенными в облаках (орбиталях), лежащих на разном расстоянии вокруг ядра. Атомы с одинаковым числом протонов и электронов электрически нейтральны, то есть у них нет чистого заряда. Порядковый номер химического элемента в таблице Менделеева говорит о количестве электронов у его атома.
Электроны удерживаются на своих орбиталях притяжением положительно заряженного ядра. Иногда другие силы преодолевают это притяжение, и атом теряет один или несколько электронов. В других случаях атомы получают дополнительные электроны. Атомы, в которых число протонов не равно числу электронов, называются ионами – это заряженные частицы.
Атом, имеющий больше протонов, чем электронов, имеет положительный заряд и называется катионом. Для примера – атом натрия (Na), который потерял один электрон, становится ионом натрия (Na+) с зарядом +1. Атом, имеющий меньше протонов, чем электронов, несёт суммарный отрицательный заряд и называется анионом. Атом хлора (Cl), получивший один электрон, становится хлорид-ионом (Cl-) с зарядом -1.
Природа атома – изотопы
Хотя все атомы одного элемента имеют одинаковое количество протонов, они не могут иметь одинаковое количество нейтронов. Атомы одного элемента, которые обладают разным числом нейтронов, называют изотопами этого элемента.
Большинство элементов в природе существует в виде смеси различных изотопов. Например, углерод (C) имеет 3 изотопа, каждый из которых содержит 6 протонов. Более 99% углерода в природе существует как изотоп, содержащий 6 нейтронов. Общая масса этого изотопа составляет 12 Да (6 от протонов и 6 от нейтронов). Он называется углеродом-12 и обозначается 12 C.
Большая часть из оставшихся изотопов углерода естественного происхождения составляет углерод-13 – изотоп с 7 нейтронами. Редчайший изотоп углерода – углерод-14, с 8 нейтронами. В отличие от двух других изотопов углерод-14 нестабилен – это означает, что его ядро имеет тенденцию к распаду на элементы с более низкими атомными номерами.
Ядерный распад излучает значительное количество энергии и называется радиоактивным распадом, а изотопы, которые распадаются, называются радиоактивными изотопами. Некоторые радиоактивные изотопы более нестабильны, чем другие, они разлагаются легче. Однако любой изотоп распадается с постоянной скоростью. Обычно время распада выражается как период полураспада – время, необходимое для распада половины атомов в образце.
Углерод-14 часто используется для датировки ископаемых и других материалов, он имеет период полураспада в 5730 лет. Образец, содержащий 1 грамм углерода-14 сегодня, будет содержать 0,5 г углерода-14 через 5730 лет, 0,25 г через 11 460 лет, 0,125 г через 17 190 лет м и т. д.
 1: образование углерода-14 2: распад углерода-14 3: «равное» уравнение для живых организмов, а неравное-для мертвых организмов, в которых с-14 затем распадается
1: образование углерода-14 2: распад углерода-14 3: «равное» уравнение для живых организмов, а неравное-для мертвых организмов, в которых с-14 затем распадается
Автор: NikNaks, условия просмотра CC BY-SA 3.0
Соотнося различные изотопы углерода и другие элементы в биологических образцах и горных породах, учёные имеют возможность точно определять, когда эти материалы появились.
В современной биологии радиоактивность имеет широкое применение. Радиоактивные изотопы являются одним из способов метки или маркировки конкретной молекулы, чтобы исследовать её изменения, химические реакции в живых клетках и тканях. Недостаток этого метода в том, что энергетические субатомные частицы, испускаемые радиоактивными веществами, могут серьёзно повредить живой клетке, например, стать причиной её мутации, а в больших дозах и гибели. Поэтому доза безопасной радиации обязательно контролируется и регулируется.
Электроны определяют химическое поведение атомов
Ключ к химическому поведению атома лежит в числе и расположении на орбиталях его электронов. В модели Бора-Резерфорда показано, что отдельные электроны вращаются вокруг центрального ядра, но она не отражает реальности. Современная физика доказывает, что мы не можем точно определить положение любого отдельного электрона в заданное время.
 Форма и расположение в пространстве s-, p-, d- и f-орбиталей.
Форма и расположение в пространстве s-, p-, d- и f-орбиталей.
Автор: haade, CC BY-SA 3.0
На самом деле электрон может быть где угодно, как рядом с ядром, так и далеко от него. Но конкретный электрон вероятнее всего можно найти в определённой зоне атома. Орбиталь – это та область, где скорее всего содержится данный электрон. Некоторые электронные орбитали вблизи ядра сферические (S-орбитали), другие – в виде гантели (p-орбитали). Орбитали, более удалённые от ядра, могут иметь различную форму. Независимо от расположения, орбиталь не может содержать более 2 электронов.
Большая часть атома – пустое пространство. Если представить, что ядро размером с мяч для гольфа, то первый ближайший к нему электрон расположится не ближе чем 1,6 км. По этой причине ядра двух атомов никогда не подходят близко друг к другу. И электроны атома, а не его протоны и нейтроны определяют его химические свойства. Это объясняет, почему все изотопы элемента, имеющие одинаковое расположение электронов, химически ведут себя идентично.
Атом содержит дискретные энергетические уровни
Поскольку электроны притягиваются к положительно заряженному ядру, оно должно постоянно удерживать их на своих орбиталях, как нам нужно постоянно держать яблоко в кулаке, чтобы преодолевать силу притяжения Земли. Ядро атома содержит огромный потенциал, при его расщеплении высвобождается гигантское количество энергии, которую человек использует для работы атомных реакторов и атомного оружия.
Если мы отпустим яблоко, оно упадёт, так как уменьшится потенциал его энергии. Но если бы мы внесли яблоко на вершину здания, то увеличили бы потенциал энергии. Электроны тоже имеют потенциал собственной энергии, связанной с их положением. Противостоять притяжению ядра и переместить электрон на более отдалённую орбиту можно, только получив энергию от внешнего источника. В молекулах хлорофилла этим источником является энергия Солнца, она возбуждает электроны, и они отрываются от атома. Чем ближе электрон расположен к ядру, тем большая энергия ему понадобится для преодоления его силы тяжести.
Перемещение электрона в обратном направлении – ближе к ядру – имеет обратный эффект: энергия не поглощается, а выделяется в виде лучистой энергии (тепла и света), и электрону остаётся меньше потенциальной энергии.
 Испускание света
Испускание света
Автор: Volobuev Ilya, CC BY-SA 4.0
Таким образом, электроны в атоме имеют дискретные энергетические уровни. Эти уровни называют квантами (сингулярные, квантовые), означающими наличие определённого количества энергии. Если использовать аналогию с яблоком снова, то представьте, что оно может быть поднято только до определённого уровня этажей здания. Каждый атом демонстрирует лестницу потенциала – дискретный набор орбиталей с разным запасом энергии, зависящим от расстояния от ядра.
 Диаграмма атома фтора, показывающая степень эффективного ядерного заряда.
Диаграмма атома фтора, показывающая степень эффективного ядерного заряда.
Автор: Effective_Nuclear_Charge.svg, CC0
Электроны, которые расположены на одинаковом расстоянии от ядра, имеют одинаковую энергию, даже если они занимают разные орбитали. Говорят, что они занимают тот же энергетический уровень. Энергетические уровни обозначаются буквами К, L, М и т.д.
Когда электроны передаются от одного атома другому, они сохраняют свой потенциал энергии. В организмах химическая энергия хранится в высокоэнергетических электронах, которые передаются от одного атома к другому в реакциях, включающих окисление и восстановление. Чаще эти процессы соединены в комбинацию окислительно-восстановительной реакции.
Источник
1211. Укажите, какая часть атома несет положительный заряд, а какая — отрицательный.
Ядро — положительный, электроны — отрицательный.
1212. Во сколько раз масса ядра атома углерода больше массы ядра атома водорода?
В 12 раз (см. таблицу Менделеева).
1213. Вокруг ядра атома кислорода движется 8 электронов. Сколько протонов имеет ядро атома кислорода?
8 протонов.
1214. Шар, заряженный положительно, подвешен на шелковой нити. Изменилось ли число протонов, содержащихся в шаре, когда ему сообщили дополнительный положительный заряд? На этот вопрос были получены ответы: уменьшилось; увеличилось; не изменилось. Какой из этих ответов правильный? Ответ объясните.
Число протонов не изменится. Уменьшится число электронов.
1215. Может ли атом водорода или другого вещества лишиться заряда, равного 0,5 заряда электрона?
Нет, поскольку электрон обладает элементарным зарядом.
1216. Металлический шар, имевший положительный заряд, разрядили, и он стал электрически нейтральным. Можно ли сказать, что заряды в шаре исчезли?
Нет, но отрицательные и положительные заряды компенсируют друг друга.
1217. Два одинаковых металлических шара, заряженные по абсолютной величине одинаковыми, а по знак у разными зарядами, после соприкосновения оказались электрически нейтральными. Можно ли сказать, что заряды в шарах исчезли? Какие изменения произошли с ионной кристаллической решеткой металла шаров?
Заряды в шарах не исчезли. Электронные оболочки положительно заряженных ионов, содержащихся в положительно заряженном шаре, полностью заполнились за счет свободных электронов отрицательно заряженного шара.
1218. На рисунке 290 схематически изображены атом и ион водорода. На каком рисунке (а или б) изображен ион? Какой заряд представляет собой ион?
На рисунке «а» изображен ион водорода.
Его заряд q = 1,6 • 10 -19Кл.
1219. Что имеет большую массу: атом водорода или положительный ион водорода? Ответ обоснуйте.
Атом водорода, поскольку в нем есть электрон — частица, обладающая массой.
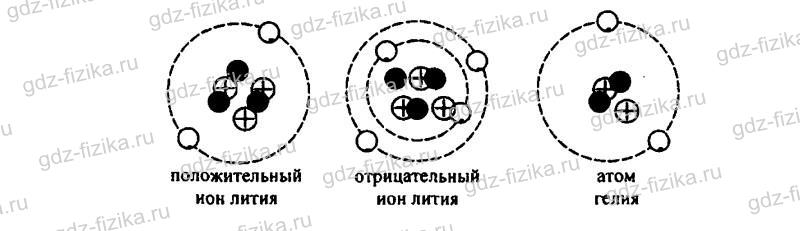
1220. Известно, что литий имеет три электрона. С учетом этого начертите схемы положительного и отрицательного ионов лития; гелия (имеющего два электрона).
1221. На рисунке 291, а схематически изображен атом гелия. Что изображено на рисунке 291, б?
На рисунке «б» изображен ион гелия.
1222. Алюминиевой палочке сообщили положительный заряд. Что произошло с некоторым числом атомов алюминия?
За счет потери электронов они превратились в положительно заряженные ионы.
1223. К незаряженным металлическим палочкам поднесли заряженные тела (рис. 292). Укажите знаки зарядов, которые возникнут на палочках.
На верхнем стержне — отрицательный, на нижнем — положительный. (Эти заряды возникнут на ближайших к телам концах стержней).
1224. К незаряженным металлическим палочкам поднесли заряженные шарики (рис. 293). Укажите знаки зарядов, которые возникнут на палочках.
Сверху вниз: слева –q; справа +q; слева и справа –q; посередине +q; слева и справа +q; посередине -2q; слева +q; справа -q.
1225. Подвешенная гильза вначале касалась незаряженной металлической палочки, но, когда к палочке поднесли заряженный шар, гильза заняла другое положение (рис. 294). Почему?
При поднесении к одному концу стержня заряда + q на другом его конце появляется положительный заряд, часть которого передается гильзе. Гильза отталкивается от стержня.
1226. Известно, что в состав атома лития входят 3 протона. Сколько всего частиц в атоме лития? Назовите их.
В атоме лития 10 частиц: 3 протона, 4 нейтрона, 3 электрона.
1227. Какое изменение произошло с атомом кислорода, если он превратился в положительный ион?
Он потерял один или несколько электронов.
1228. Чем положительный ион газа отличается от молекулы газа?
Он потерял один или несколько электронов.
Источник
