Какой оксид проявляет амфотерные свойства

Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]

4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Источник
Амфотерность – это очень важная тема школьного курса химии, которая очень часто бывает недопонята учениками старших классов. Если так происходит, в дальнейшем, это может привести к серьезным проблемам на уроках, так как в химии все новые темы базируются на предыдущих.
Сегодня, я хочу поговорить об амфотерности, наиболее простым и доступным языком. Надеюсь, что эта статья сможет стать полезна учащимся школ, проходящим эту тему, учителям при ее объяснение и всем, кто просто хочет разобраться в химии по каким либо причинам.
Начнем мы вот с чего. Есть такие версии Таблицы Менделеева, в которых химические элементы разделены по цветам. Например, периодическая система из школьных учебников по химии от автора О.С. Габриеляна выглядит так:
В ней, черным цветом обозначены знаки металлов, образующих основные оксиды и основания, красным – знаки неметаллов, зеленым – знаки металлов, обладающих амфотерными свойствами.
Теперь вспоминаем другое, когда мы проходили основания, мы должны были заметить, что их образует метал, которому соответствует основный оксид, например:
Na – Na2O – NaOH
K – K2O – KOH
Ca – CaO – Ca(OH)2
Все эти металлы, в периодической системе Д,И. Менделеева обозначены черным цветом.
Так же мы должны были заметить, что в основе кислот лежат неметаллы, которым соответствуют кислотные оксиды, например:
S – SO3 – H2SO4
N – N2O5 – HNO3
P – P2O5 – H3PO4
Cl – Cl2O7 – HCLO4
Все они обозначены в Таблице красным цветом.
Однако, у нас остаются еще и зеленые элементы, которые являются металлами, образующими амфотерные оксиды и гидроксиды. Что же это значит? Давайте начнем с определения амфотерных веществ.
Амфотерные вещества (от греч. Амфотеро – и тот, и другой) – это вещества, которые в зависимости от условий реакций проявляют основные или кислотные свойства.
Чтобы это понять, в школах часто предлагают провести такой эксперимент (или подобный). Возьмем любую водорастворимую соль цинка и добавим в нее немного щелочи, в результате реакции образуется осадок:
ZnCl2 + NaOH = NaCl + Zn(OH)2 (осадок)
Помимо прочего, этот осадок амфотерный гидроксид и сейчас мы это докажем.
Отфильтруем осадок и поместим небольшое его количество в две пробирки. В пробирку №1 добавим несколько миллилитров раствора серной кислоты. При этом осадок растворится, значит реакция будет идти:
Zn(OH)2 + H2SO4 (p-p) = ZnSO4 + 2H2O
В пробирку №2 с высушенным гидроксидом цинка добавим кристаллический гидроксид натрия и нагреем смесь. При этом мы будем наблюдать протекание химической реакции, которая записывается согласно следующей схеме:
Zn(OH)2 + 2NaOH =(сплавление)= Na2ZnO2(цинкат натрия) + H2O
При этом гидроксид цинка проявил свои кислотные свойства, поэтому реакция прошла так. Для простоты написания реакций мы даже можем представить амфотерные гидроксиды в их кислотной форме, например:
Zn(OH)2 – H2ZnO2
H2ZnO2 + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Кстати оксид цинка в точно таких же условиях, поведет себя как кислотный оксид:
ZnO + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Так же точно, дело будет обстоять и с другими амфотерными гидроксидами, например гидроксид алюминия можно представить в форме двух кислот:
Реакция гидроксида алюминия с кислотой будет протекать стандартно:
Al(OH)3 + 3HCL = AlCl3 + 3H20
Реакция гидроксида алюминия со щелочью, будет протекать по схеме:
Al(OH)3 + NaOH =(сплавление)= NaAlO2 + H2O
В данном случае берем остаток метаалюминиевой кислоты, так как очевидно, что при сплавление будет удаляться вода.
Стоит учесть, что в расплаве и растворе данные реакции будут протекать по разному.
Амфотерный гидроксид + Раствор щелочи = Комплексная соль
Al(OH)3 + NaOH → Na[Al(OH)4]
Реакция оксида алюминия и самого алюминия с раствором щелочи будет протекать по следующей схеме:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Точно такие же реакции будут давать другие амфотерные металы, их оксиды и гидроксиды с растворами щелочей, например цинк:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Все очень просто 🙂
Однако, не стоит забывать еще одно очень важное правило. Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Похожем образом дело обстоит и с другими элементами. Например, то же железо может проявлять степени окисления 2+, 3+ и 6+. Но зная правило, мы не растеряемся и отнесем гидроксид железа (II) к основаниям, а гидроксид железа (III) к амфотерным гидроксидам.
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Так как эти элементы могут проявляться в разных степенях окисления, их называют переходными элементами или переходными металлами.
Вот собственно и все.
До новых встреч, уважаемые читатели!
Источник
Понятие об
амфотерных оксидах и гидроксидах
Первоначальная классификация химических элементов на металлы и неметаллы является
неполной. Существуют химические элементы и соответствующие им вещества, которые
проявляют двойственную природу – амфотерные свойства. Могут
взаимодействовать как с кислотами и кислотными оксидами, так и с основаниями и
основными оксидами, например,
а)
2Al(OH)3 + 3SO3 = Al2(SO4)3 +
3H2O
Al2O3 + 3H2SO4 =
Al2(SO4)3 + 3H2O
б)
2Al(OH)3 + Na2O = 2NaAlO2 +
3H2O
Al2O3 + 2NaOH = 2NaAlO2 +
H2O
Al(OH)3 ↔ H3AlO3 (ортоалюминиеваякислота) –H2O↔ HAlO2 (метаалюминиеваякислота), здесь AlO2 (I) – одновалентныйкислотныйостатокметаалюминат
Так,
гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов
и оксидов, т.е. реагируют с кислотными гидроксидом и оксидом, образуя
соответствующую соль – сульфат алюминия Al2(SO4)3,
тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов
и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль –
метаалюминат натрия NaAlO2. Если указанные реакции протекают в
водном растворе:
Al(OH)3 + NaOH = Na[Al(OH)4]
Другой
пример,
а)
Zn(OH)2 + SO3 = ZnSO4 + H2O
ZnO + H2SO4 = H2O
+ ZnSO4
б)
Zn(OH)2 + Na2O = Na2ZnO2 +
H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
Zn(OH)2↔H2ZnO2,
здесь ZnO2(II) – двухвалентный кислотный остаток цинкат.
Оксиды и
гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют
амфотерными.
Химические
элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают
переходными химическими свойствами, не относящимися ни к металлам, ни к
неметаллам, их называют амфотерными.
Амфотерность (от греч. amphoteros
– и тот, и другой) – способность химических соединений проявлять и кислотные, и
основные свойства в зависимости от природы реагента, с которым амфотерное
вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и
гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные
свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным
оксидам соответствуют амфотерные гидроксиды, например,
ВeО – Вe(ОН)2,
Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми
кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и
гидроксиды металлов, в которых валентность металла III, IV иногда II.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3,
SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных
подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и
некоторые другие.
Оксиды и гидроксиды, в которых валентность металла III, IV, являются,
как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3
и Fe(OH)3. Однако последние элементы в декадах d–элементов
(например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях
окисления, например, ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
Амфотерный гидроксид | Кислотный остаток (А) | Оксид |
Zn(OH)2 | со щелочами проявляет кислотные H2ZnO2↔ZnO2 (II) кислотный остаток – цинкат | ZnO |
Al(OH)3 | со щелочами проявляет кислотные HAlO2↔AlO2 (I) кислотный остаток – метаалюминат | Al2O3 |
Be(OH)2 | со щелочами проявляет кислотные H2BeO2↔BeO2 (II) кислотный остаток – бериллат | BeO |
Cr(OH)3 | со щелочами проявляет кислотные HCrO2↔CrO2 (I) кислотный остаток – хромат | Cr2O3 |
1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Видео “Амфотерные свойства гидроксида алюминия”
Видео “Получение и химические свойства амфотерных
гидроксидов”
Тренажёр “Амфотерные свойства оксида алюминия”
Тренажёр – виртуальная лаборатория “Амфотерные свойства оксида алюминия”
Применение
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид
алюминия:
·
лекарственные препараты, приготовленные на
основе гидроксида алюминия, врач назначает при нарушении
кислотно-щелочного баланса в пищеварительном тракте;
·
в качестве антипирена (средства для
подавления способности гореть) вещество вводят в состав пластмасс и красок;
·
путём разложения гидроксида алюминия в
металлургии получают оксид алюминия (глинозём) — сырьё для получения
металлического алюминия.
Товары, в
производстве которых используется гидроксид алюминия: лекарственный препарат
«Алмагель» и металлургический глинозём
Гидроксид цинка в
промышленности служит сырьём для получения различных соединений этого металла,
в основном — солей.
Источник
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
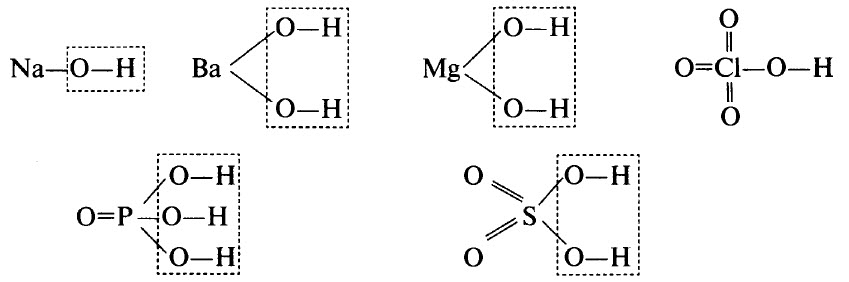
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Источник
Анонимный вопрос
30 мая 2019 · 32,9 K
Амфотерными называются элементы, которые в соединениях проявляют свойства металлов и неметаллов. К ним относятся элементы А-групп Периодической системы – Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп – Cr, Mn, Fe, Zn, Cd, Au и др.
Оксиды и гидроксиды этих соединений, соотвественно, будут амфотерными.
Сурьма, железо, висмут, марганец, не амфотерны, они относятся не к 4, а к 5 аналитической группе, их гидроксиды не… Читать дальше
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Амфотерные оксиды – это оксиды, у которых элемент в степени окисления +3 или +4
Например, Al2O3, ТiO2, Cr2O3, Fe2O3, PbO2
☘️Но☝️
ZnO, BeO тоже амфотерные, хотя Zn и Be в степени окисления +2. Это нужно запомнить)
☘️Гидроксиды, которые соответствуют амфотерными оксидам, тоже амофотерны ????
Какие вещества называют оксидами?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Оксиды это соединения различных химических элементов с кислородом. При этом кислород находистя в опредленной степени окисления. В реакцию с кислородом могут вступать и металлы, и неметаллы. Чаще всего в результате реакций с неметаллами образуются кислотные оксиды, а с металлами – основания.
С чем взаимодействуют кислоты?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
???? Растворы кислот кислые на вкус, изменяют окраску индикаторов:
???? лакмуса в красный цвет
????метилового оранжевого – в розовый
цвет фенолфталеина не изменяется
ХИМИЧЕСКИЕ СВОЙСТВА
???? Взаимодействуют с металлами
▫️Ca + 2HCl = CaCl2 + H2
⚠️ Металл должен стоять левее водорода в ряду напряжений
⚠️ Кислоты-окислители – азотная и серная конц., реагируют с металлами по-другому
????Реагируют с основными оксидами:
▫️CaO + 2HCl = CaCl2 + H2O
????С основаниями (реакция нейтрализации):
▫️H2SO4 + 2KOH = K2SO4 + 2H2O
????С солями (не обязательно растворимыми в воде):
▫️Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
⚠️ Реакция пойдёт только при условии выделения газа или выпадения осадка
???? У кислот есть и специфические свойства, которые связаны с окислительно-восстановительными реакциями
Прочитать ещё 1 ответ
Что реагирует с раствором гидроксида калия?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????химические свойства щелочей????
❗️С кислотами
KOH+HCl➡KCl+H2O
❗️С кислотными оксидами
2KOH+CO2➡️K2CO3+H2O
❗️С растворами солей(если есть осадок)
2KOH+CuSO4➡️Cu(OH)2+K2SO4
❗️С амфотерными металлами
2KOH+Zn+2H2O➡️K2[Zn(OH)4]+H2
Что такое декаданс?
Изначально это слово использовалось в оскорбительном и уничижительном ключе при попытке принизить французских писателей и поэтов-романтиков эпохи Теофиля Готье, Шарля Бодьера, Поля Верлена. Дословно обозначает регресс, культурный застой.
Для декаданса характерно пессемизм, смирение, тщетность, преобладание формы над содержанием. В искусстве это направление сопоставляют с символизмом, и обозначают как побочный продукт лени и вседозволенности.
Декадентов относят к маргинальной среде, заражающей общество “нравственным параличом”, духовной деградацией и склонностью к упадническим настроениям. Хотя, на мой взгляд, такое видение предвзято! Настоящий декадент – это моралист, наблюдатель катастрофы и неизбежного разложения, гипертрофированное зеркало своего времени. Ему нравится описывать события в мельчайших деталях, вплоть до крайности, и нравится увлечение слабостями.
Периодом “расцвета” отечественного декаданса называют Октябрьскую Революцию, когда народный раскол становится явным, и среди интеллигенции, презираемой и осуждаемой рабочим классом, формируется довольно плотная прослойка людей искусства, не желающая принимать участия в бурных социальных процессах.
Существуют ли современные примеры?
Да, сейчас мы все наблюдаем упадок иудеохристианской цивилизации.
Как найти высшей оксид и гидроксид Астата(At)?
Ну, если есть таблица Менделеева, то просто нужно посмотреть в самый низ группы Астата. Там будет формула высшего оксида
Высший гидроксид можно найти, исходя из высшей степени окисления вещества (как, собственно, и оксид). У Астата – 7 (номер группы). Итак, получается, что высший гидроксид – HAtO4
Источник
