Какой оксид марганца проявляет амфотерные свойства

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 января 2019; проверки требуют 18 правок.
Оксид марганца(IV) (диоксид марганца) — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Химические свойства[править | править код]
При обычных условиях диоксид марганца ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
.
С серной и азотной кислотами разлагается с выделением кислорода:
.
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений и :
.
Диоксид марганца проявляет амфотерные свойства. Так, в концентрированных сернокислых растворах образует сульфат марганца(IV):
.
А при сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли — манганиты:
.
Является катализатором разложения пероксида водорода:
.
При нагревании выше 530°C разлагается:
.
Получение[править | править код]
В лабораторных условиях получают термическим разложением перманганата калия:
.
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике образовавшийся каталитически разлагает пероксид водорода, вследствие чего реакция до конца не протекает.
.
При температуре выше 100°C восстановлением перманганата калия водородом:
.
Структура[править | править код]
Многие полиморфы диоксида марганца и гидратированных форм были предложены. Диоксид марганца, как и многие другие диоксиды, имеет кристаллическую структуру рутила (эта полиморфная форма называется) Способ кристаллизации, с трехкоординированным оксидом и октаэдрическим металлическим центром. Диоксид марганца является типичным некомпозитным соединением с вакансиями атомов кислорода. Это сложное твердое соединение относится к недавно полученному методу диоксида марганца в органическом синтезе. Следует отметить, что α-полиморф диоксида марганца имеет очень открытую структуру и имеет «каналы», в которых могут размещаться атомы металлов, такие как серебро или барий. После тесно связанных минералов,Его часто называют голландским.
Археология[править | править код]
- Красящие вещества, обнаруженные во время раскопок в пещере Ласко и образцы, взятые с некоторых наскальных изображений, соответствовали диоксиду марганца[1].
- Учёные определили, что кусочки чёрных камней из пещеры Пеш-де-Лазе на юге Франции, сложены исключительно из диоксида марганца. Возможно, неандертальцы использовали этот минерал в качестве окислителя и катализатора реакций окисления и горения[2].
Применение[править | править код]
- Применяется для промышленного производства марганца;
- Как деполяризатор в «батарейках» (сухих гальванических элементах);
- Компонент минеральных пигментов;
- Осветлитель стекла.
Примечания[править | править код]
- ↑ Chalmin E., Menu M., Pomiès M.-P., Vignaud C., Aujoulat N. et Geneste J.-M. Les blasons de Lascaux // L’Anthropologie, 2004. T. 108. Р. 571—592.
- ↑ Неандертальская химия
Литература[править | править код]
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Неорганическая химия под редакцией Ю. Д. Третьякова; Химия переходных элементов Кн. 1
- Полианит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник
Соединения марганца (II). Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца.
Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат.
В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха:
2Mn(OH)2(т) + 2Н2О(ж) + О2(г) → 2Mn(OH)4(т)
Марганец (II) образует комплексные соединения с координационным числом, равным шести. В водных растворах известны катионные комплексы в виде аквакомплекса [Mn(Н2О)6]2+ и аммиаката [Mn(NН3)6]2+ и анионные – тиоцианатные [Mn(NSC)6]4– и цианидные [Mn(CN)6]4-. Но комплексные соединения двухвалентного марганца неустойчивы и быстро разрушаются в водных растворах.
Соединения марганца (II) проявляют восстановительные свойства, окисляясь в нейтральной среде до марганца (IV), в сильнощелочной – до марганца (VI), а в кислой до марганца (VII):
3MnSO4(в) +2KClO3(в) +12KOH(в)→3K2MnO4(в) +2KCl(в) + 3K2SO4(в) + 6H2O(ж)
2MnSO4(в)+5PbO2(т)+6HNO3(в)→2HMnO4(в)+3Pb(NO3)2(в)+2PbSO4(в)+2H2O(ж)
Если in vitro Mn2+ проявляет восстановительные свойства, то in vivo Mn2+ восстановительные свойства выражены слабо за счёт стабилизирующего влияния биолигандов.
Соединения марганца (III). Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) – Mn2O3ּН2О или MnО(OH) встречается в природе в виде минерала манганита (бурая марганцевая руда). Искусственно полученный гидроксид марганца (III) применяют в качестве чёрно-бурой краски. Оксид марганца (III) при нагревании до температуры более 940 оС на воздухе или выше 1090 оС в токе кислорода переходит с смешанный оксид Mn3O4 устойчивого состава, что используется в весовом анализе.
Соединения марганца (IV). Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца. MnO2 и соответствующий ему гидроксид практически нерастворимы в воде.
MnO2 проявляет окислительно-восстановительную двойственность. В кислой среде он действует как сильный окислитель (+ 1,23 В), восстанавливаясь до Mn(II). На этом свойстве основан один из способов получения хлора:
MnO2(т) + 4HCl(в) → MnCl2(в) + Cl2(г) + 2H2O(ж)
В щелочной среде под действием окислителей Mn(IV) окисляется до Mn(VI).
Гидроксид марганца (IV) проявляет амфотерный характер – кислотный и основной в равной степени.
Соли марганца (IV) неустойчивы и разлагаются в водных растворах с образованием солей Mn(II).
Соединения марганца (VI). Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме:
3H2MnO4(в) → 2HMnO4(в) + MnO2(т) + 2H2O(ж) .
Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием:
3К2MnO4(в) + 2H2O(ж) → 2КMnO4(в) + MnO2(т) + 4КOH(в) .
Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде до Mn(II), а в нейтральной и щелочной средах – до MnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены до Mn(VII):
2К2MnO4(в) + Cl2(г) → 2КMnO4(в) + 2КCl(в).
При нагревании выше 500 оС манганат (VI) распадается на продукты:
манганат (IV) и кислород:
2К2MnO4(т) → К2MnO3(т) + О2(г).
Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия:
2KMnO4(т) + H2SO4(к) = K2SO4(в) + Mn2O7(ж) + H2O(ж).
Оксид марганца (VII) устойчив до 10 оС и разлагается со взрывом по схеме:
Mn2O7(ж) →2MnO2(т) + О3(г).
При взаимодействии Mn2O7 с водой образуется марганцовая кислота HMnO4, которая имеет фиолетово-красную окраску:
Mn2O7(ж) + H2O(ж) = 2HMnO4(в) (только в виде ионов MnO4– и Н+) .
Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм3 равна 93 %.
Марганцовая кислота – сильный окислитель. Еще энергичнее взаимодействует Mn2O7, горючие вещества при соприкосновении с ним воспламеняются.
Соли марганцовой кислоты называются перманганаты. Наиболее важным из них является перманганат калия, он является очень сильным окислителем. С его окислительными свойствами по отношению к органическим и неорганическим веществам часто приходится встречаться в химической практике.
Степень восстановления перманганат-иона зависит от характера среды:
кислая среда Mn (II) (соли Mn2+)
MnO4-+8H++5ē = Mn2++4H2O, Е0 = +1.51 B
Перманганат нейтральная среда Mn (IV) (оксид марганца (IV))
MnO4-+2H2O+3ē=MnO2 +4OH-,Е0 = +1.23 B
щелочная среда Mn (VI) (манганаты M2MnO4)
MnO4-+ē = MnO42-, Е0 = +0.56 B
Как видно, наиболее сильные окислительные свойства перманганаты проявляют в кислой среде.
Образование манганатов происходит в сильнощелочном растворе, обеспечивающем подавление гидролиза K2MnO4. Так как реакция обычно проходит в достаточно разбавленных растворах, конечным продуктом восстановления перманганата в щелочной среде, как и в нейтральной, является MnO2 (см. диспропорционирование).
При температуре около 250 оС перманганат калия разлагается по схеме:
2KMnO4(т) K2MnO4(т) + MnO2(т) + O2(г)
Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
2KMnO4+5Н2О2+6СН3СООН →2Mn(СН3СОО)2+2СН3СООК +8Н2О+ 5O2
Марганец – биологически активный микроэлемент, содержащийся в живых организмах. В организме человека содержится около 12 мг марганца, причём 43% этого количества находится в костях, а остальное – в мягких тканях. Он входит в состав ряда ферментов. Двухвалентный марганец усиливает каталитическую активность большого числа ферментов различных классов – трансфераз, гидролаз, изомераз. Фермент глутаминсинтетаза, содержащий марганец, катализирует биосинтез глутамина из глутаминовой кислоты и аммиака с участием АТФ. Ионы Mn2+стабилизируют конформацию нуклеиновых кислот, участвуют в процессах репликации ДНК, синтезе РНК и белка. Ионы Mn3+ совместно с Fe3+ входит в состав трансферина, супероксиддисмутазы и кислотной фосфатазы – в состав типичных металлопротеинов.
Марганец влияет на кроветворение, рост, размножение, минеральный, липидный и углеводный обмен, развитие скелета.
В токсикологии перманганат калия используется для качественного обнаружения метанола, новокаина, кокаина.
Раствор перманганата калия применяется качестве титранта при количественном определении восстановителей: Fe2+, C2O42-, поли- и оксикарбоновых кислот, альдегидов, муравьиной, мочевой, аскорбиновой кислот методом прямого титрования и ряда окислителей (например, нитратов и нитритов)– методом обратного титрования.
Соединения марганца являются сильными ядами, действующими на центральную нервную систему, поражающими почки, лёгкие, сердце.
Источник
| Оксид марганца IV | |
|---|---|
| Систематическое наименование | Диоксид марганца |
| Хим. формула | MnO2 |
| Состояние | черные тетрагональные кристаллы |
| Молярная масса | 86,9368 г/моль |
| Плотность | 5,026 г/см³ |
| Температура | |
| • разложения | 535 °C |
| Энтальпия | |
| • образования | -521,5 кДж/моль |
| Растворимость | |
| • в воде | нерастворим |
| Рег. номер CAS | [1313-13-9] |
| PubChem | 14801 |
| Рег. номер EINECS | 215-202-6 |
| SMILES | O=[Mn]=O |
| InChI | 1S/Mn.2O NUJOXMJBOLGQSY-UHFFFAOYSA-N |
| RTECS | OP0350000 |
| ChEBI | 136511 |
| Номер ООН | 1479 |
| ChemSpider | 14117 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид марганца IV (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Химические свойства
При обычных условиях диоксид марганца ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
4 HCl + MnO2 ⟶ MnCl2 + Cl2 ↑ + 2 H2O
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
2 MnO2 + 2 H2SO4 ⟶ 2 MnSO4 + O2 ↑ + 2 H2O
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn7+ и Mn6+:
3 MnO2 + KClO3 + 6 KOH ⟶ 3 K2MnO4 + KCl + 3 H2O
Диоксид марганца проявляет амфотерные свойства. Так, в концентрированных сернокислых растворах образует сульфат марганца IV:
MnO2 + 2 H2SO4 ⟶ Mn(SO4)2 + 2 H2O
А при сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли — манганиты:
MnO2 + CaO ⟶ CaMnO 3
Является катализатором разложения пероксида водорода:
2 H2O2 →MnO2 2 H2O + O2 ↑
При нагревании выше 530°C разлагается:
4 MnO2 →530∘C 2 Mn2O3 + O2
Получение
В лабораторных условиях получают термическим разложением перманганата калия:
2 KMnO4 →t K2MnO4 + MnO2 + O2 ↑
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике образовавшийся MnO2 каталитически разлагает пероксид водорода, вследствие чего реакция до конца не протекает.
2 KMnO4 + H2O2 ⟶ 2 KOH + 2 MnO2 + 2 O2 ↑
При температуре выше 100°C восстановлением перманганата калия водородом:
2 KMnO4 + 2 H2 →t K2MnO4 + MnO2 + 2 H2O
Археология
- Красящие вещества, обнаруженные во время раскопок в пещере Ласко и образцы, взятые с некоторых наскальных изображений, соответствовали диоксиду марганца.
- Учёные определили, что кусочки чёрных камней из пещеры Пеш-де-Лазе на юге Франции, сложены исключительно из диоксида марганца. Возможно, неандертальцы использовали этот минерал в качестве окислителя и катализатора реакций окисления и горения.
Применение
- Применяется для промышленного производства марганца;
- Как деполяризатор в «батарейках» (сухих гальванических элементах);
- Компонент минеральных пигментов;
- Осветлитель стекла.
Соединения марганца | |
|---|---|
| |
Источник
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 –
амфотерные, +6, +7 – кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 – пиролюзит
- MnO(OH) – бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 – браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца II
Для соединений марганца II характерны основные свойства. Оксид марганца II может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца IV до оксида марганца II.
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца II.
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца II на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца IV.
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца II проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца II получается при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца IV проявляют амфотерный характер. Оксид марганца IV можно получить разложением нитрата марганца II.
Mn(NO3)2 = (t) MnO2 + NO2 + O2

В реакциях с щелочами марганец переходит в СО +6, в кислой среде – принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца VI – MnO3, H2MnO4 – неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли – манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца VII – неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 – проявляют
кислотные свойства. Соли марганцовой кислоты – перманганаты.
В различных средах – кислотной, нейтральной и щелочной – марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
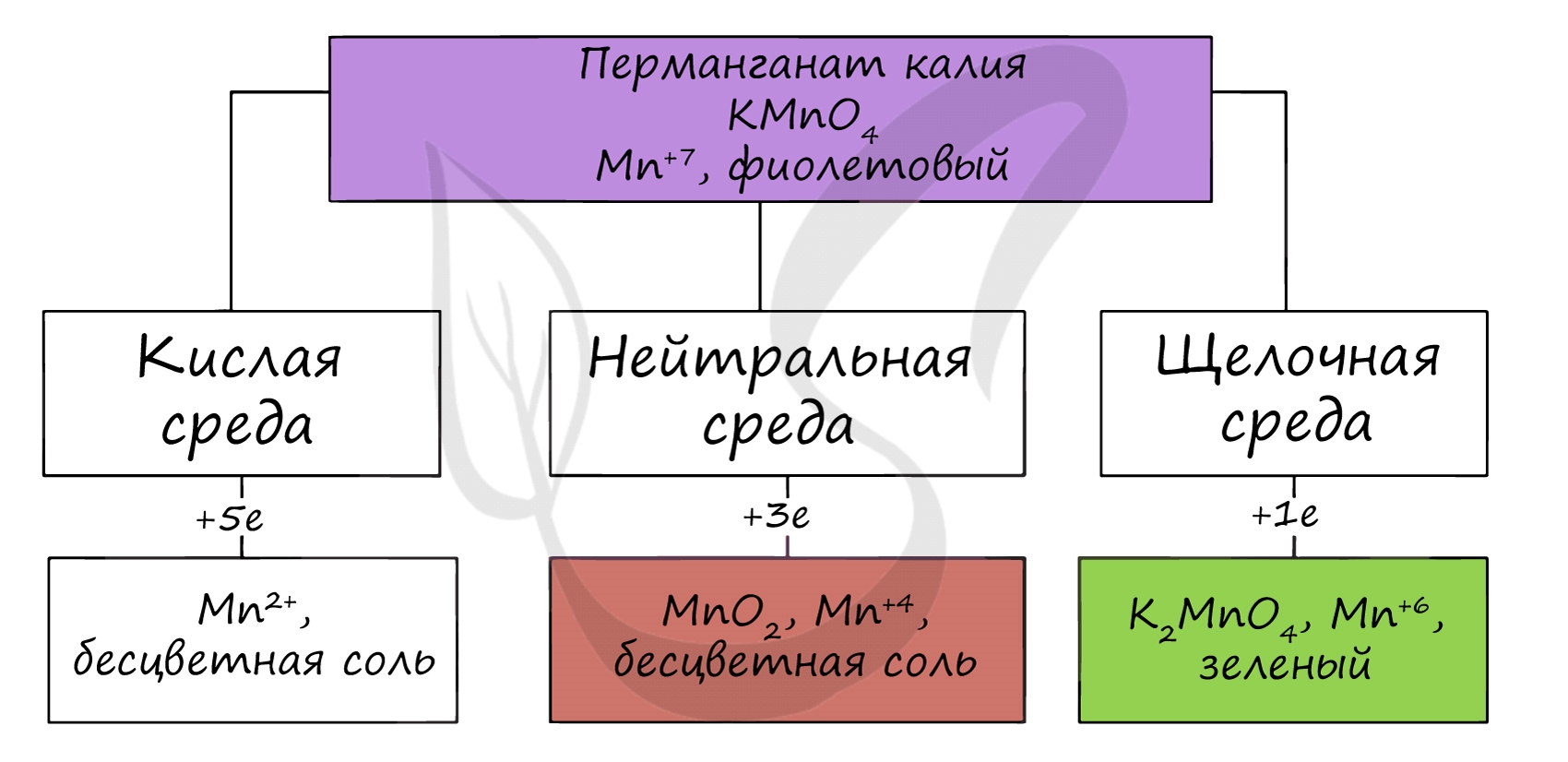
Оксид марганца VII получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4
При растворении оксида марганца VII (кислотного оксида) в щелочи образуются соли марганцовой кислоты – перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца II.
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту – марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) – Mn2+, в щелочной – Mn6+.
KMnO4 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke – зубец. С древнейших времен известен сплав
меди с цинком – латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS – цинковая обманка, сфалерит
- ZnO – цинкит
- ZnCO3 – симсонит, цинковый шпат
- 2ZnO*SiO2*H2O – гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком 🙂
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка II
Эти соединения обладают амфотерными свойствами. Оксид цинка II можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка II проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка II может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка II получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка II обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра – аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
