Какой низкомолекулярный продукт выделяется при образовании пептидной связи
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Что такое пептидная связь?
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
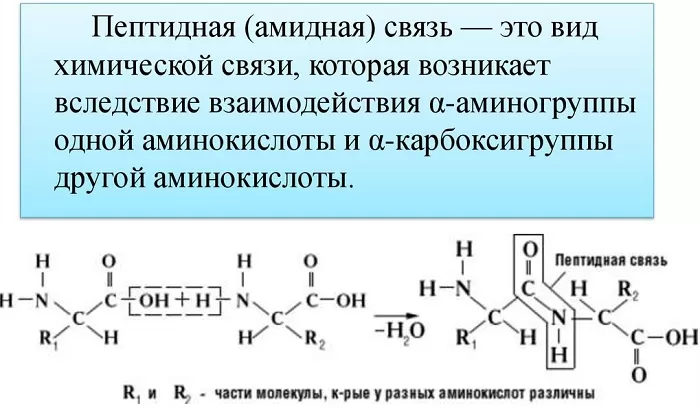
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование пептидной связи
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
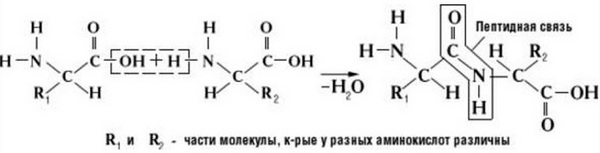
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение пептидной связи
В чем особенности строения пептидной связи? В амидной группе –CO-NH- углеродный атом существует в форме sp2-гибридизации. К примеру, электронная пара атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом. Тогда электронная плотность пептидной группы сместится к кислороду. В результате подобного сопряжения выровняются длины связей внутри радикала.
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения пептидных связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
- Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983″. European Journal of Biochemistry. 138 (1): 9–37. 1984. doi:10.1111/j.1432-1033.1984.tb07877.x. ISSN 0014-2956.
- Muller, P (1994-01-01). “Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077. ISSN 1365-3075.
- Watson J, Hopkins N, Roberts J, Agetsinger Steitz J, Weiner A (1987) [1965]. Molecualar Biology of the Gene (hardcover) (Fourth ed.). Menlo Park, CA: The Benjamin/Cummings Publishing Company, Inc. p. 168. ISBN 978-0805396140.
- Miller BR, Gulick AM (2016). “Structural Biology of Nonribosomal Peptide Synthetases”. Methods in Molecular Biology. 1401: 3–29. doi:10.1007/978-1-4939-3375-4_1. ISBN 978-1-4939-3373-0. PMC 4760355. PMID 26831698.
- Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). Protein synthesis. An Introduction to Genetic Analysis (7th ed.). New York: W. H. Freeman. ISBN 978-0716735205.
Пептидная связь, видео

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
 Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
Молекула, содержащая пептидную связь, называется амидом.
Четырехатомная функциональная группа –C(=O)NH– называется амидной группой или, когда речь идет о белках, пептидной.
Пептидные связи чаще всего встречаются в природе в составе пептидов [1] и белков [2], соединяющих между собой остатки аминокислот [3]. Пептидные связи также является основой пептидной нуклеиновой кислоты (ПНА). Полиамиды, такие как нейлон и арамид, являются синтетическими молекулами (полимерами), которые также содержат пептидные связи.
Образование пептидной связи
Образование пептидной связи происходит в результате реакции конденсации между карбоксильной и аминогруппой. При этом аминогруппа играет роль нуклеофила [4], замещая гидроксил карбоксильной группы.
Поскольку –OH является плохой уходящей группой, реакция конденсации протекает достаточно тяжело. Обратная реакция – разрушение пептидной связи – называется реакцией гидролиза. При стандартных условиях, химическое равновесие смещается именно в сторону гидролиза, с образованием свободных аминокислот (либо других мономерных единиц). Пептидная связь метастабильна, несмотря на то, что при его гидролизе выделяется порядка 10 кДж / моль энергии, этот процесс без наличия катализатора гидролиза протекает чрезвычайно медленно: время жизни пептида в водном растворе составляет около 1000 лет.
В живых организмах, реакции гидролиза ускоряются ферментами.
Реакция конденсации, в результате которой осуществляется формирование пептидной связи, требует свободной энергии Гиббса [5]. Как в химическом синтезе, так и в биосинтезе белков, реакция обеспечивается активацией карбоксильных групп, в результате чего отхождение гидроксильной группы облегчается.
Резонансные формы пептидных связей
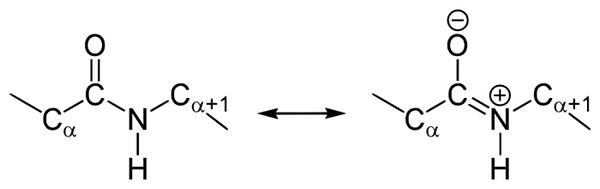
 В 1930-1940-х годах Лайнус Карл Полинг (Linus Carl Pauling) и Роберт Кори (Robert Brainard Corey) проводили рентгеноструктурный анализ нескольких аминокислот и дипептидов. Им удалось выяснить, что пептидная группа имеет жесткую планарную структуру, в которой шесть атомов лежат в одной плоскости: ^5,-атом углерода и C=O группа первой аминокислоты, и N-H группа и ^5,-атом углерода второй аминокислоты. Полинг объяснил данный факт существованием двух резонансных форм пептидной группы, на что указывала меньшая длина C-N связи в пептидной группе (133 пм), в сравнении с той же связью у простых аминов (149 пм). Вследствие частичного разделения электронной пары между карбонильным кислородом и амидным азотом, пептидная связь на 40% имеет двойные свойства.
В 1930-1940-х годах Лайнус Карл Полинг (Linus Carl Pauling) и Роберт Кори (Robert Brainard Corey) проводили рентгеноструктурный анализ нескольких аминокислот и дипептидов. Им удалось выяснить, что пептидная группа имеет жесткую планарную структуру, в которой шесть атомов лежат в одной плоскости: ^5,-атом углерода и C=O группа первой аминокислоты, и N-H группа и ^5,-атом углерода второй аминокислоты. Полинг объяснил данный факт существованием двух резонансных форм пептидной группы, на что указывала меньшая длина C-N связи в пептидной группе (133 пм), в сравнении с той же связью у простых аминов (149 пм). Вследствие частичного разделения электронной пары между карбонильным кислородом и амидным азотом, пептидная связь на 40% имеет двойные свойства.
 Резонансные формы типичной пептидной группы. Незаряженная единичная форма (около 60%) показана слева, заряженная двойная форма (около 40%) справа.
Резонансные формы типичной пептидной группы. Незаряженная единичная форма (около 60%) показана слева, заряженная двойная форма (около 40%) справа.
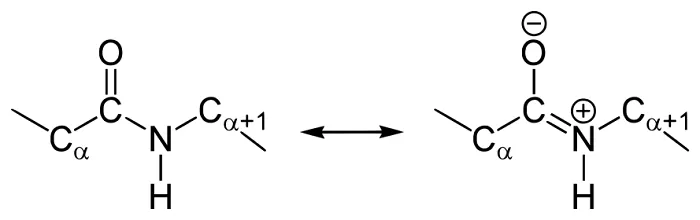
В пептидных группах вращения вокруг C-N связи не происходит вследствие ее частичной двойственности. Вращение возможно только вокруг связей С—С^5, и N—С^5,. В результате остов пептида может быть представлен в виде серии полей, разделенных совместными точками вращения (С^5, атомы). Данная структура ограничивает количество возможных конформаций [6] пептидных цепей.
Кроме того, эффект резонанса стабилизирует группу, добавляя энергию примерно 84 ккал / моль, что делает ее менее химически активной, в сравнении с подобными группам (например, эфирами). Данная группа не имеет заряда с точки зрения физиологических значений pH, однако вследствие существования двух резонансных форм, карбонильный кислород несет частично отрицательный заряд, а амидный азот – частично положительный. Таким образом, возникает диполь с дипольным моментом, около 3,5 Дебай (0,7 электрон-ангстрем). Указанные дипольные моменты могут ориентироваться параллельно в определенных типах вторичной структуры (например ^5,-спирали).
Конфигурации пептидной связи
Для планарной пептидной связи возможны две конфигурации:
- Транс-конфигурация,
- Цис-конфигурация.
В транс-конфигурации ^5,-атомы углерода и боковые цепи расположены по разные стороны пептидной связи, в то время как в цис-конфигурации – с одной и той же. «Транс» – форма пептидных связей значительно более широко распространена (встречаясь в 99,6% случаев), нежели «цис», из-за того, что в последнем случае велика вероятность пространственного столкновения между боковыми группами аминокислот.
Исключением является аминокислота пролин [7], если она будет соединена через аминогруппу с какой-либо другой аминокислотой. Пролин – единственная из протеиногенных аминокислот, содержащих около C^5,не первоначальную, а вторичную аминогруппу. В ней атом азота связан с двумя атомами углерода, а не с одним, как у других аминокислот. У пролина, включенного в пептид, заместители при атоме азота отличаются не так сильно, как в других аминокислотах. Поэтому разница между «транс» и «цис» конфигурациями весьма незначительна, ни одна из них не имеет энергетического преимущества.
Возможные конформации
Конформация пептида определяется тремя двугранными углами, отражающими вращения вокруг трех последовательных связей в пептидной остове: `8, (пси) – вокруг C^5,1—С, `9, (омега) – вокруг С-N, и `6, (фи) – вокруг N—С^5,2.
Вращения вокруг собственно пептидной связи не происходит, так как `9, угол всегда имеет значение около 180 ° у транс-конфигурации, и 0 °, – у значительно более редкой цис-конфигурации.
Поскольку связи N—С^5,2 и C^5,1—С по обе стороны от пептидной являются обычными одинарными связями, вращения вокруг них неограниченно, в результате чего пептидные цепи могут принимать самые разнообразные пространственные конформации. Однако возможны далеко не все комбинации двугранных углов, при некоторых из них происходит пространственное столкновения атомов. Допустимые значения визуализируют на двухмерном графике, именующемся диаграммой Рамахандрана.
Методы определения пептидных связей
Методы определения пептидных связей основаны на том, что пептидная группа имеет характерную полосу поглощения в диапазоне 190-230 нм.
Качественной реакцией на пептидную связь является биуретовая реакция с концентрированным раствором меди (II) сульфата (CuSO4) в щелочной среде. Продуктом является комплексное соединение сине-фиолетовой окраски между атомом меди и атомами азота.
 Биуретовая реакция может быть использована для колориметрического измерения концентрации белков и пептидов, однако из-за низкой чувствительности этого метода значительно чаще используются его модификации. Одной из таких модификаций является метод Лоури [8], в котором биуретовая реакция сочетается с окислением остатков ароматических аминокислот.
Биуретовая реакция может быть использована для колориметрического измерения концентрации белков и пептидов, однако из-за низкой чувствительности этого метода значительно чаще используются его модификации. Одной из таких модификаций является метод Лоури [8], в котором биуретовая реакция сочетается с окислением остатков ароматических аминокислот.
Примечания
Примечания и пояснения к статье «Пептидная связь».
При написании статьи о пептидных связях, в качестве источников, использовались материалы информационных и медицинских интернет-порталов, сайтов новостей Nature.com, ScienceDaily.com, Википедия, а также следующие печатные издания:
- Валькович Э. И. «Общая и медицинская эмбриология: учебное пособие для медицинских вузов». Издательство «Фолиант», 2003 год, Санкт-Петербург,
- Лебедев А. Т., Артеменко К. А., Самгина Т. Ю. «Основы масс-спектрометрии белков и пептидов». Издательство «Техносфера», 2012 год, Москва.

Загрузка…
Источник
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.

Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами – строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
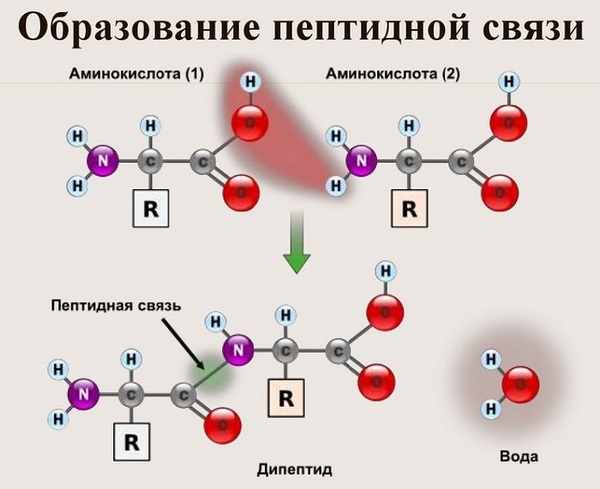
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
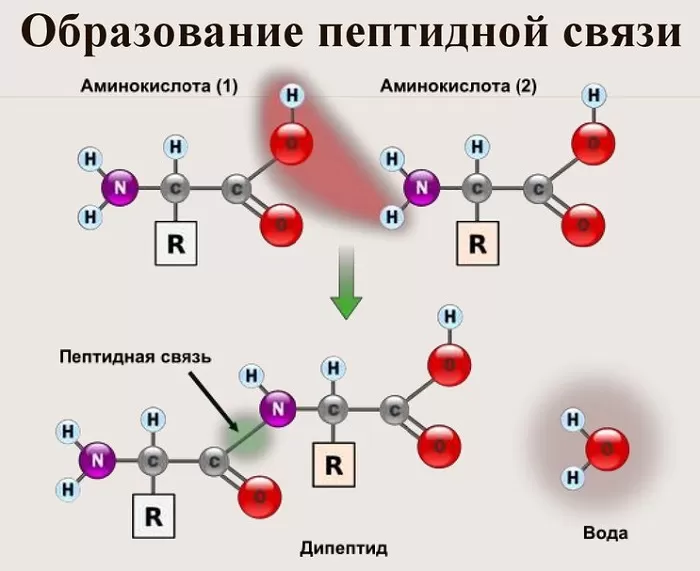
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
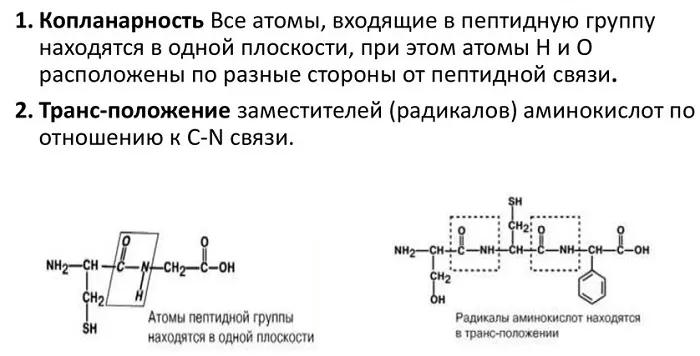
Свойства:
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
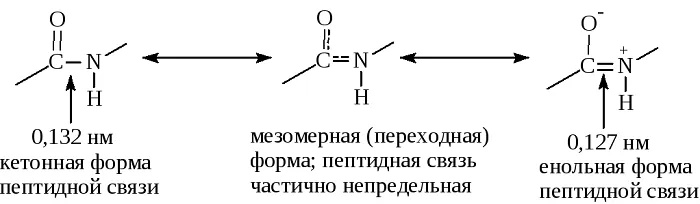
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В амидной группе -СО-NH- углеродный атом существует в форме sp2-гибридизации. Неподеленная пара электронов атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом.
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
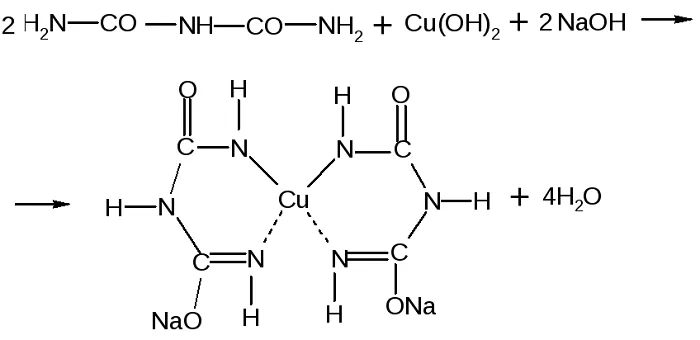
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Источник
Образование пептидной связи
Пепти́ды (греч. πεπτος «питательный») — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Обычно подразумеваются пептиды, состоящие из α-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот[1].
Пептиды, последовательность которых короче примерно 10—20 аминокислотных остатков, могут также называться олигопепти́дами (от др.-греч. ὀλίγος «малочисленный»); при большей длине последовательности они называются полипепти́дами (от греч. πολυ- «много»); полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки. Белка́ми обычно называют полипептиды, содержащие, примерно, от 50 аминокислотных остатков[2] с молекулярной массой более 5000[3], 6000[4] или 10000[5][6]дальтон.
В 1900 году немецкий химик-органик Герман Эмиль Фишер выдвинул гипотезу о том, что пептиды состоят из цепочки аминокислот, образованных определёнными связями, и уже в 1902 году он получил неопровержимые доказательства существования пептидной связи, а к 1905 году разработал общий метод, при помощи которого стало возможным синтезировать пептиды в лабораторных условиях. Постепенно учёные изучали строение различных соединений, разрабатывали методы разделения полимерных молекул на мономеры, синтезировали всё больше и больше пептидов.
Олиго- и полипептиды, белки[править | править код]
Грань между олигопептидами и полипептидами (тот минимальный размер, при котором молекула пептида перестаёт считаться олигопептидом и становится полипептидом) достаточно условна. Источники, разграничивающие олиго- и полипептиды, как правило, определяют границу между олигопептидами и полипептидами как 10 (согласно Химической Энциклопедии[4]) или 10—20 (согласно определению ИЮПАК[1]) аминокислотных остатков. Иногда четкая грань не проводится вообще (так, например, согласно учебнику Ленинжера[6], размер олигопептидов — несколько, а полипептидов — много аминокислотных остатков), и формально олигопептидная молекула окситоцин, состоящая из 9 аминокислотных остатков, может упоминаться как полипептид.
Белками можно считать пептиды, масса которых превышает 5000—10 000, и(или) длина превышает 50—90 аминокислотных остатка. Эта граница тоже условна, однако в основных источниках справочной информации, где эта граница обозначена (включая ИЮПАК), она лежит в указанных пределах. Диапазон масс согласуется с диапазоном размеров подстановкой средней массы аминокислотного остатка (110 Да).
История[править | править код]
Пептиды впервые были выделены из гидролизатов белков, полученных с помощью ферментирования.
- Термин пептид предложен Э. Фишером, который к 1905 г. разработал общий метод синтеза пептидов.
В 1953 В. Дю Виньо синтезировал окситоцин, первый полипептидный гормон. В 1963 г., на основе концепции твердофазного пептидного синтеза (P. Меррифилд) были созданы автоматические синтезаторы пептидов.
Использование методов синтеза полипептидов позволило получить синтетический инсулин и некоторые ферменты.
На сегодняшний день известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
Панкреатические молекулы полипептидного характера[править | править код]
- en:NPY
- Пептид YY
- APP Avian pancreatic polypeptide
- en:HPP Human pancreatic polypeptide
Свойства пептидов[править | править код]
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Классификация пептидов и строение пептидной цепочки[править | править код]
Молекула пептида — это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид.
Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
- олигопептиды — молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
- полипептиды — молекулы, в состав которых входит более десяти аминокислот…
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном.
По качественному составу различают:
- гомомерные пептиды — соединения, состоящие только из аминокислотных остатков;
- гетеромерные пептиды — вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
- гомодетные — пептиды, аминокислотные остатки которых соединены только пептидными связями;
- гетеродетные пептиды — те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
Цепочка повторяющихся атомов называется пептидным остовом: (—NH—CH—OC—).
Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—OC—), называемое аминокислотным остатком.
N-концевой аминокислотный остаток имеет свободную α-аминогруппу (—NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC—).
Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку.
Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про — несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства[источник не указан 603 дня].
Пептидная связь[править | править код]
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный pH) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Значение[править | править код]
Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при патологии возникает дефицит пептидов, который существенно ускоряет износ тканей, что приводит к старению всего организма.
Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный пул клетки восполняют синтезированными в лабораторных условиях короткими пептидами.
Синтез пептидов[править | править код]
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза — несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов.
Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
Биологически активные пептиды[править | править код]
Пептиды, обладая высокой физиологической активностью, регулируют различные биологические процессы.
По биорегуляторному действию пептиды принято делить на несколько групп:
- соединения, обладающие гормональной активностью (глюкагон, окситоцин, вазопрессин и др.);
- вещества, регулирующие пищеварительные процессы (гастрин, желудочный ингибирующий пептид и др.);
- пептиды, регулирующие аппетит (эндорфины, нейропептид-Y, лептин и др.);
- соединения, обладающие обезболивающим эффектом (опиоидные пептиды);
- органические вещества, регулирующие высшую нервную деятельность, биохимические процессы, связанные с механизмами памяти, обучения, возникновением чувства страха, ярости и др.;
- пептиды, которые регулируют артериальное давление и тонус сосудов (ангиотензин II, брадикинин и др.).
- пептиды, которые обладают противоопухолевым и противовоспалительным свойствами (Луназин)
Однако такое деление условно, так как действие многих пептидов не ограничивается каким-либо одним направлением. Так, например, вазопрессин, помимо сосудосуживающего и антидиуретического действия, улучшает память.
Пептидные гормоны[править | править код]
Пептидные гормоны — это многочисленный и наиболее разнообразный по составу класс гормональных соединений, представляющий собой биологически активные вещества. Их образование происходит в специализированных клетках железистых органов, после чего активные соединения поступают в кровеносную систему для транспортировки к органам-мишеням. По достижении цели гормоны специфически воздействуют на определённые клетки, взаимодействуя с соответствующим рецептором.
Нейропептиды[править | править код]
Нейропептиды — соединения, синтезируемые в нейронах, обладающие сигнальными свойствами.
Действие нейропептидов на ЦНС очень разнообразно. Они воздействуют непосредственно на мозг и контролируют сон, влияют на память, поведение, процесс обучения, обладают обезболивающим действием.
Тахикининовые пептиды (Tachykinin peptides)[править | править код]
- Субстанция Р
- en:Kassinin
- Нейрокинин А (en:Neurokinin A)
- en:Eledoisin
- Нейрокинин В (en:Neurokinin B)
Пептиды иммунологического действия[править | править код]
Наиболее изученные пептиды, участвующие в иммунном ответе — тафцин, тимопотин II и тимозин α1. Их синтез в клетках организма человека обеспечивает функционирование иммунной системы.
Терминология по теме[править | править код]
- Полипептиды — пептиды, с числом аминокислотных остатков больше 10-20
- Олигопептиды — пептиды с числом аминокислот в цепи до 10-20
- Дипептиды
- Трипептиды
- Гексапептиды
- Нейропептиды пептиды, ассоциированные с нервной тканью
- Пептидные гормоны — пептиды с Гормональной активностью
См. также[править | править код]
- Белки
- Аминокислоты
- Рибосома
Примечания[править | править код]
- ↑ 1 2 IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: https://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.P04898.
- ↑ IUPAC. Biochemical Nomenclature and Related Documents, 2nd edition, (the «White Book») p. 48 Portland Press, 1992. Edited C Liebecq. [ISBN 1-85578-005-4]
https://www.chem.qmul.ac.uk/iupac/AminoAcid/A1113.html#AA11 - ↑ Белки // «Химическая энциклопедия», изд. «Советская энциклопедия», М., 1988
- ↑ 1 2 Пептиды // «Химическая энциклопедия», изд. «Советская энциклопедия», М., 1988
- ↑ UPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: https://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.P04898.
- ↑ 1 2 David L. Nelson, Michael M. Cox Lehninger Principles of Biochemistry. — 4. — W. H. Freeman, 2004. — 85 с.
Источник
