Какой элемент имеет более выраженные неметаллические свойства чем кремний
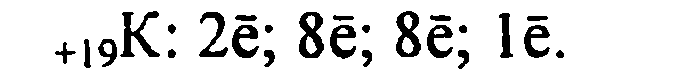
А2 Закономерности изменения химических свойств
элементов и их соединений по периодам и группам.
1. В ряду : Na → Mg → Al → Si
1) увеличивается число энергетических
уровней в атомах
2) усиливаются металлические свойства
элементов
3) уменьшается высшая степень окисления
элементов
4) ослабевают металлические свойства
элементов
2. У элементов подгруппы углерода с увеличением
атомного номера уменьшается
1) атомный радиус 2) заряд
ядра атома 3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов
азот – кислород – фтор возрастает
1) валентность по водороду 2)
число энергетических уровней
3) число внешних электронов 4)
число неспаренных электронов
4. В ряду химических элементов бор
– углерод – азот возрастает
1) способность атома отдавать электроны 2)
высшая степень окисления
3) низшая степень окисления 4)
радиус атома
5. Какой элемент имеет более
выраженные неметаллические свойства, чем кремний?
1) углерод
2) германий
3)
алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 → P2O5
→ As2O5 → Sb2O5
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы
расположены в ряду:
1) O,N,C,B 2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления
металлических свойств элементы расположены в ряду:
1) А1,Са,К
2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1 2)
O,S,Se,Te 3) At,I,Br,Cl 4) Mg,Al,Si, P
10. Какой
элемент образует
газообразное водородное
соединен
соответствующее
общей формуле RH2?
1) бор
2) калий
3) сера
4) хром
11. В
главных подгруппах периодической
системы восстановительная способность
атомов химических элементов растет с
1) уменьшением радиуса
атомов 2) увеличением числа энергетических уровней в
атомах 3) уменьшением числа протонов в
ядрах атомов 4) увеличением числа валентных электронов
12. В какой группе
периодической системы находится элемент Э, входящий в состав
кислоты НЭО4: 1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 – Р2О5
– SO2 – Cl2O7 кислотные
свойства:
1) возрастают 2)убывают 3)не изменяются
4) сначала
уменьшаются, потом увеличиваются
14. В каком ряду
простые вещества расположены в
порядке усиления
металлических
свойств?
1) Mg, Ca, Ва 2) Na, Mg,
A1 3) K,Ca,Fe 4) Sc, Ca, Mg
15. По периоду слева направо
уменьшается(-ются)
1) атомный
радиус элементов 2) число
валентных электронов в атомах
3)
электроотрицательность элементов 4)
кислотные свойства гидроксидов
16. В порядке увеличения
электроотрицательности химические элементы расположены
в ряду: 1) С, N,
О
2) Si.Al.Mg 3) Mg,Ca,
Ва 4) Р, S, Si
17. Химический элемент
расположен в IV
периоде, IA группе.
Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
18. Электроотрицательность
химических элементов с возрастанием заряда ядра атома
1)
увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в
группах уменьшается
4) уменьшается в
периодах, а в группах увеличивается
19. В каком ряду химические
элементы расположены в порядке возрастания их атомного
радиуса? 1) Rb,K,Na,Li
2) Na,Mg,Al, S 3) О, S,
Se, Те 4) C,N, О, F
20. Среди элементов третьего
периода наименьший атомный радиус имеет
1) натрий 2) алюминий 3) фосфор 4) сера
21. В главных
подгруппах периодической системы
восстановительная способность
атомов химических элементов растет с
1)
уменьшением радиуса атомов
2)
увеличением числа энергетических уровней в атомах
3)
уменьшением числа протонов в ядрах атомов
4) увеличением
числа валентных электронов
22. По периоду слева направо
уменьшается
1) число
валентных электронов в атомах 2)
атомный радиус элементов
3)
электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание
образует:
1) цезий
2)
натрий
3} литий
4) цинк
24. Оксид с наиболее выраженными
кислотными свойствами образует
1) кремний
2) фосфор
3)
сера
4) хлор
25. Наиболее сильное основание
образует
1) магний
2) стронций 3)
барий
4) кадмий
26. Кислотный характер наиболее
выражен у высшего оксида, образованного элементом:
1) Sn
2)
А1
3)
С
4} S
27. Кислотный характер наиболее выражен у
высшего оксида, образованного
1)
бериллием 2)
бором
3) фосфором 4)
кремнием
28. Сила бескислородных кислот
неметаллов VIIА группы
соответственно возрастанию
заряда ядра
атомов элементов
1) увеличивается 2) уменьшается 3) не изменяется 4) изменяется периодически
29. Одинаковое значение
валентности в водородном соединении и высшем оксиде имеет
элемент: 1) хлор 2) германий 3) мышьяк
4) селен
30. Кислотные свойства оксидов в
ряду SiO2
–> P2O5 –>SО3
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
31. Газообразные водородные
соединения состава ЭН3 образуют
1) Be, Ca,
Sr 2) P, As,
Sb 3)
Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
Cl → S → P → Si
1) уменьшается
число электронных слоев в атомах
2) увеличивается
число внешних электронов в а томах
3) возрастают
радиус атомов 4) усиливаются
неметаллические свойства
33. Неметаллические свойства
наиболее выражены у
1)
серы 2)
кислорода 3) кремния 4)
фосфора
34. Наибольший радиус имеет атом: 1) олова 2}
кремния 3) свинца 4}
углерода
35. В ряду химических элементов Na –>Mg
–> Al –> Si
1)
увеличивается число валентных электронов в атомах
2)
уменьшается число электронных слоев а атомах
3)
уменьшается число протонов в ядрах атомов
4)
увеличиваются радиусы атомов
36.Наибольший радиус имеет атом: 1) брома 2)
мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+
2) А13+
3) K+
4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее
активного металла?
1) 1s22s22p1 2) 1s22s22p63s1 3)
1s22s2 4) 1s22s22p63s23p1
Ответы 1-4,
2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1,
16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1,
29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2.
Источник
В предыдущих частях мы, во-первых, ввели понятие атомного радиуса, к которому не раз сегодня обратимся. Во-вторых, ввели понятие о металлических и неметаллических свойствах. И, в-третьих, научились отличать металлы от неметаллов по таблице Менделеева.
Сегодня поговорим о том, какие закономерности можно выделить в рамках таблицы Менделеева благодаря всем вышеперечисленным знаниям.
Обо всём по порядку
Напомню:
Атомный радиус – условная величина, характеризующая удалённость электронов на внешнем энергетическом уровне от ядра атома.
Условное изображение атомного радиуса атома не примере атома углерода
Металлические свойства – способность атомов химических элементов отдавать электроны
Неметаллические свойства – способность атомов химических элементов эти электроны принимать.
Выделять закономерности в пределах таблицы Менделеева мы будем в двух направлениях:
В пределах подгруппы (сверху – вниз)
Сделаю акцент на том, что работать мы будем исключительно в пределах главных подгрупп
О том, почему атомный радиус в пределах подгруппы (сверху вниз) возрастает, мы говорили здесь.
- А почему же в пределах подгруппы (сверху вниз) усиливаются металлические свойства?
Дело в том, что с в пределах подгруппы с увеличением атомного радиуса возрастает удалённость электронов на внешнем энергетическом уровне от ядра, а чем более электроны удалены от ядра, тем выше запас их свободной энергии, тем менее прочно они связаны с ядром (об этом здесь) – это значит, что тем проще эти электроны будет отдать! А металлические свойства как раз-таки характеризуют способность атомов химических элементов отдавать электроны.
Ещё раз. Чем больше электроны удалены от ядра, тем менее прочно они связаны с ядром, тем проще их оказывается отдать. Я думаю, Вы интуитивно чувствуете эту простую логику, согласно которой прочность связи обратно пропорциональна расстоянию.
- Почему же в пределах подгруппы (сверху вниз) неметаллические свойства ослабевают?
Всё очень просто, неметаллические свойства – прямо противоположное понятие металлическим свойствам, и если одно усиливается, то другое ослабевает.
Как можно проследить данные закономерности? Посмотрим в таблицу Менделеева, а именно в главную подгруппу четвёртой группы.
Белый, зелёный – металлы, красный – неметаллы.
В пределах главной подгруппы четвёртой группы мы видим, как неметаллы углерод (C) и кремний (Si) в какой-то момент сменяет металл германий (Ge), и это неслучайно! Мы знаем, что металлические свойства в пределах подгруппы усиливаются, а неметаллические – ослабевают, и именно поэтому в какой-то момент при движении в пределах подгруппы сверху вниз металлические свойства усилились настолько, а неметаллические свойства ослабли настолько, что неметаллы в какой-то момент уступают место металлам.
И данную закономерность Вы можете пронаблюдать в пределах главной подгруппы любой группы!
Почему именно главные подгруппы? Дело в том, что классический вариант таблицы Менделеева, с которым мы чаще всего и работаем, в угоду компактности размещает элементы побочных подгрупп, которые, мы знаем, являются исключительно металлами, таким образом, что они, кажется, игнорируют рассматриваемые нами закономерности, то есть, попросту говоря оказываются исключениями. Ради интереса можете посмотреть на развёрнутый вариант таблицы.
В пределах периода (слева – направо)
Здесь попроще. здесь никаких подгрупп.
Итак, мы знаем, что в пределах периода (слева направо) атомный радиус убывает (об этом здесь). Так что же из этого вытекает?
А то, что металлические свойства будут убывать, а неметаллические – возрастать! Судите сами:
чем меньше атомный радиус, тем ближе электроны на внешнем энергетическом уровне оказываются к ядру, то есть тем более прочно эти электроны оказываются связаны с ядром и тем труднее их оказывается отдать, то есть тем менее выражены оказываются металлические свойства и более выражены неметаллические.
Мы легко можем проследить данную закономерность по таблице Менделеева, пользуясь тем же способом размышления, что и выше:
Белый, зелёный – металлы, красный – неметаллы.
В переделах любого периода (слева – направо) металлы закономерно начинают сменяться неметаллами, так как металлические свойства ослабевают, а неметаллические – возрастают.
Осталось сделать последний штрих – ввести понятие электроотрицательности.
Электроотрицательность – способность атомов химических элементов оттягивать на себя электронную плотность.
Электроотрицательность – понятие тождественное по смыслу неметаллическим свойствам и используется для характеристики неметаллических свойств атома. Оно даже изменяется в пределах таблицы Менделеева аналогичным образом! То есть, в пределах подгруппы (сверху вниз) убывает, а в пределах периода (слева – направо) возрастает.
Таблица электроотрицательности по Полингу
А на этом у меня всё. В следующий раз продолжим обозревать типы химической связи. Спасибо. Пока.
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник

ГОТОВИМСЯ К ЕГЭ по ХИМИИ https://maratakm.
АХМЕТОВ М. А. УРОК 3. ОТВЕТЫ НА ЗАДАНИЯ.
Выбрать другой урок
Периодический закон и периодическая система химических элементов . Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
1. Расставьте следующие химические элементы N, Al, Si, C в порядке увеличения их атомных радиусов.
ОТВЕТ :
N и C расположены в одном периоде. Правее расположен N. Значит азот меньше, чем углерод.
С и Si расположены в одной группе. Но выше С. Значит С меньше чем Si.
Si и Al расположены в одном третьем периоде, но правее находится Si, значит Si меньше чем Al
Порядок увеличения размеров атомов будет таким: N, C, Si, Al
2. Какой из химических элементов фосфор или кислород проявляет более выраженные неметаллические свойства? Почему?
ОТВЕТ:
Более выраженные неметаллические свойства проявляет кислород, так как он расположен в периодической системе элементов выше и правее.
3. Как изменяются свойства гидроксидов IV группы главной подгруппы при движении сверху вниз?
ОТВЕТ:
Свойства гидроксидов изменяются от кислотных к основным. Так H2CO3 – угольная кислота, как следует из ее названия, проявляет кислотные свойства, а Pb(OH)2 – основание.
ОТВЕТЫ НА ТЕСТЫ
А1. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1) | увеличивается |
2) | уменьшается |
3) | не изменяется |
4) | изменяется периодически |
ОТВЕТ: 1
Речь идет о кислотах HF, HCl, HBr, HI. В ряду F, Cl, Br, I происходит увеличение размеров атомов. Следовательно, увеличивается межъядерное расстояние H–F, H–Cl, H–Br, H–I. А раз так, значит, энергия связи ослабевает. И протон легче отщепляется в водных растворах
А2. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) | хлор |
2) | германий |
3) | мышьяк |
4) | селен |
ОТВЕТ: 2
Конечно, речь идет об элементе 4 группы (см. период. с-му элементов)
А3. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) | Mg, Ca, Ba |
2) | Na, Mg, Al |
3) | K, Ca, Fe |
4) | Sc, Ca, Mg |
ОТВЕТ: 1
Металлические свойства в группе элементов, как известно, увеличиваются сверху вниз.
А4. B ряду Na ® Mg ® Al ®Si
1) | увеличивается число энергетических уровней в атомах |
2) | усиливаются металлические свойства элементов |
3) | уменьшается высшая степень окисления элементов |
4) | ослабевают металлические свойства элементов |
ОТВЕТ: 4
В периоде слева-направо неметаллические свойства усиливаются, а металлические ослабевают.
А5. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) | атомный радиус |
2) | заряд ядра атома |
3) | число валентных электронов в атомах |
4) | электроотрицательность |
ОТВЕТ: 4.
Электроотрицательность – это способность смещать к себе электроны при образовании химической связи. Электроотрицательность практически напрямую связана с неметаллическими свойствами. Уменьшаются неметаллические свойства, уменьшается и электроотрицательность
А6. В ряду элементов: азот – кислород – фтор
возрастает
1) | валентность по водороду |
2) | число энергетических уровней |
3) | число внешних электронов |
4) | число неспаренных электронов |
ОТВЕТ: 3
Число внешних электронов равно номеру группы
А7. В ряду химических элементов:
бор – углерод – азот
возрастает
1) | способность атома отдавать электроны |
2) | высшая степень окисления |
3) | низшая степень окисления |
4) | радиус атома |
ОТВЕТ: 2
Число электронов во внешнем слое равно высшей степени окисления за исключением (F, O)
А8. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) | углерод | 2) | германий | 3) | алюминий | 4) | бор |
ОТВЕТ: 1
Углерод расположен в той же группе, что и кремний, только выше.
А9. Химические элементы расположены в порядке возрастания их атомного радиуса в ряду:
1) | Be, B, C, N |
2) | O, S, Se, Te |
3) | Rb, K, Na, Li |
4) | Mg, Al, Si, Р |
ОТВЕТ: 2
В группах химических элементов атомный радиус увеличивается сверху вниз
А10. Наиболее выражены металлические свойства у атома:
1) лития 2) натрия
3) калия 4) кальция
ОТВЕТ: 3
Среди указанных элементов ниже и левее расположен калий
А11. Наиболее выражены кислотные свойства:
1) HF 2) HCl
3) HBr 4) HI
Ответ: 4 (см. ответ на А1)
А12. Кислотные свойства оксидов в ряду SiO2 ® P2O5 ®SО3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
ОТВЕТ: 2
Кислотные свойства оксидов, как и неметаллические свойства, в периодах усиливаются слева-направо
А13. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 ® P2O5 ®As2O5 ® Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
ОТВЕТ: 1
В группах сверху вниз кислотные свойства, как и неметаллические, ослабевают
А14. Кислотные свойства водородных соединений элементов VIA группы с увеличением порядкового номера
1) усиливаются
2) ослабевают
3) остаются неизменными
4) изменяются периодически
ОТВЕТ: 3
Кислотные свойства водородных соединений связаны с энергией связи H–El. Эта энергия сверху-вниз ослабевает, значит, кислотные свойства усиливаются.
А15. Способность отдавать электроны в ряду Na ® К ® Rb ®Cs
1) ослабевает
2) усиливается
3) не изменяется
4) изменяется периодически
ОТВЕТ: 2
В этом ряду увеличивается число электронных слоев и отдаленность электронов от ядра, следовательно, повышается способность отдавать внешний электрон
А16. В ряду Al ®Si ®P ®S
1) увеличивается число электронных слоев в атомах
2) усиливаются неметаллические свойства
3) уменьшается число протонов в ядрах атомов
4) возрастают радиусы атомов
ОТВЕТ: 2
В периоде с возрастанием заряда ядра неметаллические свойства усиливаются
А17. B главных подгруппах периодической системы восстановительная способность атомов химических элементов растет c
1) | увеличением числа энергетических уровней в атомах |
2) | уменьшением радиуса атомов |
3) | уменьшением числа протонов в ядрах атомов |
4) | увеличением числа валентных электронов |
ОТВЕТ: 1
С возрастанием числа электронных уровней усиливается отдаленность и экранированность внешних электронов от ядра. Следовательно, возрастает способность к их отдача (восстановительные свойства)
А18. Согласно современным представлениям свойства химических элементов находятся в периодической зависимости от
1) | массы ядра атома |
2) | атомной массы химического элемента |
3) | заряда атома |
4) | заряда ядра атома |
ОТВЕТ: 3
А19. Атомы химических элементов, имеющие одинаковое число валентных электронов расположены
1) | по диагонали |
2) | в одной группе |
3) | в одной подгруппе |
4) | в одном периоде |
ОТВЕТ: 2
А20. Элемент с порядковым номером 114 должен обладать свойствами, сходными с
1) | ртутью |
2) | платиной |
3) | свинцом |
4) | таллием |
ОТВЕТ: 3. Этот элемент будет находиться в клетке, соответствующей той, что занимает свинец в VI группе
А21. B периодах восстановительные свойства химических элементов справа-налево
1) | увеличиваются |
2) | уменьшаются |
3) | не изменяются |
4) | изменяются периодически |
ОТВЕТ: 1
Уменьшается заряд ядра.
А22. Электроотрицательность и энергия ионизации в ряду О–S–Se–Te, соответственно
1) | возрастает, возрастает |
2) | возрастает, уменьшается |
3) | уменьшается, уменьшается |
4) | уменьшается, возрастает |
ОТВЕТ: 3
Электроотрицательность уменьшается с увеличением числа заполненных электронных слоев. Энергия ионизации – это энергия, которая требуется для удаления электрона из атома. Она тоже уменьшается
А23. В каком ряду знаки химических элементов расположены в порядке увеличения атомных радиусов?
1) | C ® N ® O ® F |
2) | Sr ® Ca ® Mg ® Be |
3) | Na ® Al ® P ® Cl |
4) | Si ® Al ® Mg ® Na |
ОТВЕТ: 4
Источник
