Какой из элементов литий или калий обладает более выраженными металлическими свойствами
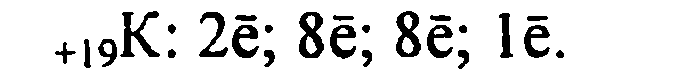
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Анонимный вопрос
26 июля · < 100
Варианты ответа:
(1) Ge. Кремний. C.
(2) Литий. Натрий. Калий.
(3) Барий. Магний. Кальций.
(4) O. N. C.
ПОИСК РЕШЕНИЯ
—
- Одной из важнейших задач школьного курса общей химии является формирование представления о периодическом изменении металлических свойств в Периодической таблице. Принципиальным металлическим свойством является способность соответствующего простого вещества отдавать электроны при химическом взаимодействии с неметаллическими элементами. В контексте Периодической системы понятия «металл» и «неметалл» не абсолютны. Целесообразно говорить о более или менее металлических элементах. Элементы, представляющие группы с меньшими порядковыми номерами, являются металлами, тогда как элементы из групп с большими порядковыми номерами являются неметаллами. Элементы, имеющие большее главное квантовое число для своих валентных электронов, обладают более выраженными металлическими свойствами, чем элементы вверху Периодической системы. Так, цезий более металличен по сравнению с натрием, а натрий более металличен по сравнению с алюминием. Схожие тренды можно проследить и во многих других случаях.
—
- Уверенное владение навыком определения свойств простых веществ в зависимости от расположения в Периодической таблице соответствующих им элементов является необходимым и непременным условием для получения удовлетворительного балла на внешнем оценочном тестировании.
—
- Рассмотрим предложенные триады элементов и укажем на характер изменения металличности слева направо, если таковое имеет место. Первая триада включает элементы 4 группы в порядке уменьшения номера периода. Таким образом, металлические свойства элементов ослабевают. Вторая триада содержит элементы первой группы в порядке увеличения номера периода. Увеличение номера периода свидетельствует об усилении металлических свойств, тогда как на качественном уровне химические свойства элементов одной группы весьма схожи. Следующая триада (барий, магний и кальций) представляет группу щелочно земельных металлов, однако в невнятном порядке. Металлические свойства ослабевают от бария к магнию, но усиливаются от магния к кальцию. В данном случае о тренде металличности в заданной триаде говорить не приходится. Наконец, последний вариант содержит элементы второго периода в порядке уменьшения номера группы. Уменьшение номера группы однозначно говорит об ослаблении металлических свойств.
—
Верный ответ: вариант 1.
Можно ли считать, что мы живём в эпоху ностальгии и повтора? И что все произведения искусства в какой-то мере вторичны?
Есть несколько современных теоретиков искусствоведения, достаточно популяризированных, которые утверждают, не прямо но, опираясь на косвенные признаки формирования социальной ценности того или иного произведения искусства, что процесс возникновения того или иного направления и стилистики, формирования чего-то в рамках вкусовой моды поколения – процесс линейный и цикличный.
Так что, не смотря на казалось бы простоту, Ваш вопрос достаточно глубок и в какой-то мере злободневен. Характерной чертой данного феномена (цикличности в актуальности того или иного направления в искусстве) является индуктивность характеристик отдельного продукта творчества. Т.е., проще говоря, процесс идет от сложного к простому, поначалу как бы спуск с горы готовой скульптуры Роденом (чтобы отпало все ненужное) а затем редукция до признания индивидуальности творческой натуры без самой демонстрации продукта творчества, как это было с французскими модернистами начала прошлого века.
Однако, на мой взгляд, все-таки, процесс развития искусства и его трансформаций не линеен. К примеру, параллельно с вышеупомянутыми французами был Мунк… и это был уже другой взгляд на искусство в целом.
Хотя с цикличностью я наверное соглашусь. Просто хронолигически цикл в искусстве достаточно долог. К примеру, редуцированная на сегодняшний день до минимума музыкальная попкультура (яркий пример последний призер американской престижной премии в музыке, не помню название, уж простите – девушка с апломбом тонатостической лирики) – это не что иное как однооктавное и трехнотное отображения ритмичных первобытных пристрастий в получении звукового наслаждения. Т.е. на данный момент – цикл завершен (по крайней мере в развитии музыки). Можно еще примеров поискать. Но, мне честно говоря лень. Да и не особый я специалист в искусствоведении. Так, отметил для себя ряд моментов, как характерных признаков для динамики.
Прочитать ещё 4 ответа
Какое место занимают неметаллы в периодической системе?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Неметаллы в периодической системе расположены в начале главных подгрупп, начиная с третьей группы и конце периодов, т. е. в правой верхней части периодической системы.
Что будет, если соединить все элементы таблицы Менделеева?
Мамкин дизайнер, тот самый парень, который в твоем классе выводил учителей из…
«Первые два ряда можно собрать без проблем. Собирая третий ряд, вы сгорите. Собирая четвертый, вы погибнете, потому что отравитесь токсичным дымом. Пятый ряд сделает с вами то же самое и еще облучит вас радиацией. Шестой ряд взорвется и превратит здание, в котором вы находитесь, в радиоактивное и токсичное облако из пыли и огня. Не пытайтесь собрать седьмой ряд»
В книге “What If” Рендалла Монро есть целая статья на эту тему, с подробным описанием каждого шага и последствий. К сожалению, в открытом доступе конкретно этой статьи нет.
Коротко говоря: вам моментально придет п#здец
Прочитать ещё 7 ответов
Что чаще применяется в жизни человека, металлы или неметаллы. почему?
IT, Web, игры и масса других интересов
И металлы, и неметаллы очень важны. Каждый элемент вносит огромный вклад в жизнь человека, поэтому говорить про частоту тут очень сложно. Судите сами. Метллы встречаются в любой сфере деятельности людей, оглянитесь, даже сейчас они вокруг Вас. Без неметаллов тоже никуда не деться. Различные макро- и микроэлементы очень важны для жизни, а без кислорода мы вообще не сможем жить.
Почему таблица химических элементов Менделеева выглядит именно так и почему ее создание было так важно?
Отличник, спортсмен, просто красавец
Идеи периодической системы химических элементов возникали и до Менделеева, но то были не более чем красивые представления списка этих самых элементов, и их свойства просто описывались на основе эмпирических данных. Уникальность варианта Менделеева в том, что он построен на валентности этих элементов, которая раньше не учитывалась, а ищо можно предсказывать их свойства (об этом чуть позже).
[ниже пойдет крайне упрощенное объяснение для тех, кому необязательно знать и объяснять это подробно]
Суть в том, что все атомы стремятся к полному заполнению своих орбиталей – чтобы не оставалось лишних электронов. Те, что уже их заполнили – ,благородные (инертные) газы (гелий, неон, аргон и так далее) – они уже живут хорошо, и потому в реакции вступать не любят, потому и инертные. А вот остальные стремятся к конфигурации инертных газов. Почему именно так – это частично объясняется в квантовой теории, частично постулируется.
Тем, что в правой части (неметаллы), до полного заполнения нужно еще несколько электронов. К примеру, возьмем хлор. По таблице видно, что электронов у него на один меньше, чем у аргона и на семь больше, чем у неона. Даже на основе бытовых представлений понятно, что один электрон передать легче, чем семь – поэтому атом хлора в степени окисления -1 Cl(-1) [атом хлора плюс один электрон] встречается куда чаще, чем в степени окисления +7 (например, оксид хлора (VII) Cl2O7), ведь отодрать семь электронов у атома, который сам хочет себе один, очень сложно. А еще можно посмотреть на фтор – у него электронов еще меньше -> расстояние до положительно заряженного ядра меньше -> электроны притягиваются сильнее, чем к хлору -> получаем, что нет такого элемента, который мог бы забрать электроны у фтора без дополнительного приложения энергии извне.
А тем, что в левой части (металлы), для конфигурации инертного газа проще отдать электроны, чем забрать. Возьмем натрий – ему стоит отдать всего лишь один электрон, чтобы получить конфигурацию неона! А когда вокруг столько всяких хлоров, он легко отдает его и переходит в ион Na+.
Ну вот реагируют они и реагируют, а при чем тут таблица-то? И валентность? А при том, что без них никуда в химичеких расчетах. Кроме того, периодическая таблица – это еще и справочник величин (атомные массы, заряды, вот это все). Знание периодического закона – это вообще знание чуть ли не половины неорганической химии. При понимании периодического закона можно предсказывать свойства элементов, даже еще не открытых (что Менделеев, собственно, и сделал, и это добавило его творению еще больше авторитета).
А еще таблица Менделеева – это таблица не совсем Менделеева, и до него, и во время него вроде как были именно такие. Поэтому в иностранных вариантах ее называют просто Periodic Table.
Источник
