Какое значение имеет свойство воды растворять вещества

А. де Сент-Экзюпери: «Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты необходима для жизни! Ты сама жизнь! Ты наполняешь нас радостью, которую не объяснить нашими чувствами. С тобой возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь начинают бурлить высохшие родники нашего сердца. Ты самое большое богатство не свете… » «Вода – самое драгоценное минеральное сырье, это не только средство для развития промышленности и сельского хозяйства, вода – это действительный проводник культуры, это живая кровь, которая создает жизнь там, где ее не было» (академик А. П. Карпинский) .
В воде растворяются твердые, жидкие и газообразные вещества. Вещества бывают хорошо растворимые, малорастворимые и практически нерастворимые
Роль воды в клетке обусловлена ее химическими свойствами. наиболее важное свойство воды – растворять органические и неорганические вещества.
Свойство воды растворять газы очень важно для жизни на Земле. Растворенный в водах Океана углекислый газ усваивается водорослями, которые взамен выделяют кислород. Этим кислородом Океан обогащает воздух. Поэтому Океан называют «голубыми легкими» Земли.
Максимальное содержание в воде растворенного вещества зависит от температуры воды. Чем теплее вода, тем больше вещества в ней может раствориться. Раствор, в котором при данной температуре содержится наибольшее количество вещества, называют «насыщенным» . Стоит его охладить, и растворенное вещество начинает выпадать в осадок. Именно так откладываются на дне морей слои соли.
Проникновение веществ в клетку и выведение из нее продуктов жизнедеятельности возможно только в растворенном виде. Вода участвует в явлениях осмоса, обеспечивающего поддержание постоянства химического состава клетки.
осмосом называется проникновение молекул растворителя через полупроницаемую мембрану в раствор какого-либо вещества. Вода поступает в клетку именно путем осмоса.
На явлениях осмоса основаны движения воды по проводящей системе зеленых растений от корней к листьям. Вода, всасываемая корневыми волосками растений, содержит мало растворенных веществ. Проникая в клетки через мембраны и создавая в них повышенное давление, вода придает упругость листьям, лепесткам цветков, стеблям трав.
Не менее важна для живой природы и чисто химическая роль воды. Под действием специальных ферментов она вступает в реакции гидролиза, т. е. в реакции, при которых к свободным валентностям различных молекул присоединяются ионы ОН– и Н+ воды, при этом образуются новые вещества, необходимые для жизни клетки. С появлением жизни на Земле круговорот воды стал сложнее, так как к физическим явлениям испарения и конденсации добавились более сложные процессы, связанные с жизнедеятельностью живых организмов. Все более значительной становится роль человека в этом круговороте. Деятельность человека порой приводит к загрязнению природных вод.
Один из основных загрязнителей воды – нефть и нефтепродукты, которые могут попадать в воду из естественных источников, при нефтедобыче, транспортировке, переработке и использовании в качестве топлива и промышленного сырья.
Из других загрязнителей необходимо назвать металлы (например, ртуть, свинец, цинк, медь, хром, олово, марганец) , радиоактивные элементы, ядохимикаты, поступающие с сельскохозяйственных полей, и стоки животноводческих ферм. Из металлов наибольшую опасность для водной среды представляют ртуть, свинец и их соединения. Накопление в водоемах органических веществ приводит к эвтрофикации – обогащению их биогенными элементами, следствием чего являются уменьшение содержания кислорода, обеднение фауны и флоры, неприятный запах.
Источник
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
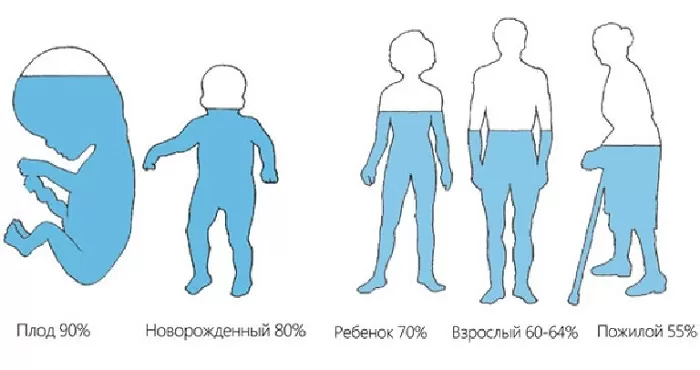
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
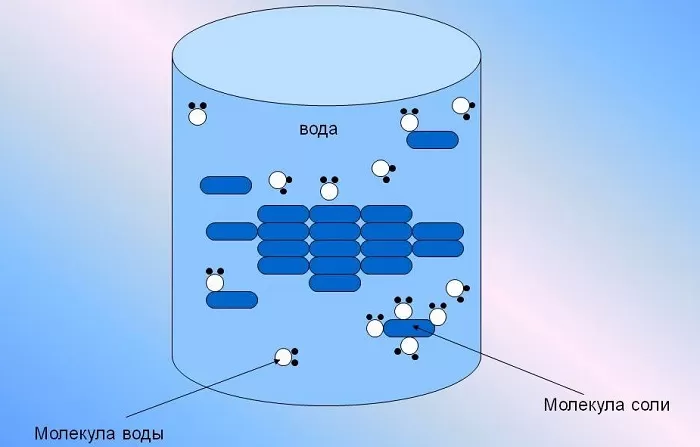
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.

Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.

Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.

В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.

Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник
Каждый живой организм на Земле состоит из воды более, чем
наполовину. На самой планете 70% поверхности занимает Мировой океан. И эта
цифра не включает источники рек, озер, подземных вод и льда. Вода необходима
для нормальной жизнедеятельности человека, животных и растений. При этом ее
природный круговорот позволяет говорить о неисчерпаемости ресурса. Однако
современные ученые всерьез озабочены проблемой загрязнения питьевой воды.
Проводятся многочисленные опыты с целью получить идеально чистую воду. К сожалению,
даже полученная дистиллированная вода при открывании сосуда сразу же
превращается в раствор, вбирая в себя газы из атмосферы и мельчайшую пыль,
содержащуюся в воздухе.
Казалось бы, что может быть загадочного в этом веществе?
Однако ее физические и химические свойства не дают покоя великим умам уже много
десятилетий. Способность пребывать в трех агрегатных состояниях,
дезинфицировать или заряжать энергией, закипать при 100 градусах и замерзать
при 0, отлично проводит электричество и почти не проводит тепло, но одна из
самых удивительных ее способностей – растворять в себе практически любые
элементы, то есть вода представляет универсальный растворитель.
О том, каково значение воды, как растворителя, лучше всего
расскажет функция, которую она выполняет в живых существах. Вода, составляющая
значительную часть внутренних условий организмов, участвует в протекании
всасывания и перемещения питательных веществ или продуктов распада. При
окислении глюкозы вода становится конечным элементов ее распада с выделением
большого количества энергии, необходимой для совершения каких-либо действий.
В организме человека содержится около 20 аминокислот,
которые принимают участие в процессе метаболизма. Эти аминокислоты растворимы в
воде по-разному. Например, являющиеся солями обладают хорошей растворимостью,
такой раствор имеет нейтральную реакцию.
Что такое раствор
По определению раствором является однородная смесь, в
которой присутствуют молекулы растворителя и растворяемого вещества. При их
взаимодействии возникают химические и физические процессы.
Растворы могут находится в трех состояниях: твердом, жидком
и газообразном. По количеству растворяемого вещества выделяют концентрированные
и разбавленные системы. Существует еще одна классификация растворов, зависящая
от долей субстанции, которые растворяются в воде: ненасыщенные, насыщенные и
перенасыщенные.
Как это происходит
Как происходит растворение веществ в воде можно рассмотреть
на кулинарном примере. Соль, высыпанная в кипящую воду, тает быстро, тогда как
специя, помещенная в воду с комнатной температурой, поддается растворению с
трудом. Химическая наука объясняет это тем, что при попадании в жидкость
верхние молекулы соляных кристаллов образуют водородные связи с молекулами
воды, причем на 1 молекулу растворяемого вещества приходится несколько частиц
растворителя. Тепловое движение ускоряет этот процесс.
Подобным же образом происходит растворение других веществ,
если они обладают каким-либо цветом, жидкость вберет его в себя, вот почему
мутнеет вода – от растворенных в ней непрозрачных веществ.
Какие вещества растворяются в воде, а какие нет
В большинстве случаев растворимость веществ в воде очень
хорошая. В идеально чистой на вид жидкости растворены атмосферные газы: азот,
аргон, углекислота, азот и другие. В водах Мирового океана по данным ученых
содержится почти более 80 химических элементов периодической таблицы, включая
некоторые радиоактивные. Среди них называют бром, калий, натрий, хлор, магний,
сера, кальций, углерод, стронций, бор и даже золото!
Вещества, хорошо растворимые в воде, называются
гидрофильными, то есть теми, что «любят» жидкость. Хлорид натрия, или кухонная
соль, сахар, крахмал, сода, сок из вишни – примеры субстанций, которые нельзя
отделить из раствора с помощью фильтра. Кроме твердых и жидких веществ в воде
могут растворяться газы: хлористый водород или аммиак.
Довольно легко определить, какие вещества не растворяются в
воде из личного опыта. Среди них можно назвать песок, глину, цемент, стекло,
драгоценные и обычные металлы, жидкости – растительное масло и керосин,
некоторые инертные газы. Такие материи носят название гидрофобных.
Между двумя полюсами располагается «золотая середина» –
субстанции малорастворимые: гипс, бертолетова соль, сульфаты, бензол и
некоторые другие.
Во время растворения кристаллогидратов в воде происходит
выделение тепла. Объясняется это тем, что на первом этапе взаимодействия
материй образуются новые связи, но, когда начинается разрушение кристалла, эта
энергия используется для разрывания молекулярных соединений. Таким образом, в
зависимости от того, на каком этапе нужно больше энергии, раствор на выходе
может или нагреться, или, наоборот, остыть. Обычно изменение температуры
проходит без видимых признаков из-за малого количества опытных образцов, но в
некоторых случаях эффект заметен без измерительного прибора: вода закипает или
сосуд покрывается холодными капельками.
Вода считается полярным растворителем поскольку обладает
следующими положительными характеристиками:
- высокой диэлектрической проницаемостью, когда в растворе противоположно заряженные ионы притягиваются в 78 раз меньше;
- образует водородные соединения;
- обладает высокой температурой кипения.
Вода, как растворитель имеет важное значение не только в
природе, но и в организмах живых существ и органах растений. Совершая свое
движение в природе, как в кровеносной системе, жидкость участвует в процессе
растворения и распределения необходимых для роста и развития веществ и газов.
Без нее не было бы жизни на земле, она играет роль в химико-физических
процессах практически в любой области жизнедеятельности. Поэтому понятен
интерес ученых к ее удивительным свойствам и их стремление создать идеально
чистую воду.
Источник
Благодаря своим уникальным физическим и химическим
свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем
состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно
много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять
накопленное тепло и остыть. Вот почему она используется в системах охлаждения
(например, в автомобильных радиаторах или для охлаждения промышленного
оборудования). Эта характеристика объясняет также то, почему в прибрежных (или
озерных) регионах температура воздуха мягче: в этих местах, когда времена года
меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается
или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды
определяют ее особое биологическое значение, первым делом нужно вспомнить, что
она имеет высокое поверхностное натяжение. Это означает, что после наливания на
гладкую поверхность она имеет тенденцию образовывать сферические капли, а не
растекаться в тонкую пленку. И это свойство во многом объясняет высокую
биологическую активность воды. Без гравитации капля ее была бы совершенно
сферической. Поверхностное натяжение позволяет растениям поглощать воду,
содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой
«проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко
стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, то
есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше
уровень, тем ниже температура, при которой вода начинает кипеть). Значения
кипения и замерзания воды берут в качестве контрольной точки для калибровки
термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а
100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность
уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или
лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она
является единственным на Земле веществом, которое можно найти во всех трех
физических состояниях в зависимости от температуры окружающей среды: жидкой,
твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — H2O: два атома водорода
(H2) связаны с одним атомом кислорода (O). Электроны атома (частицы с
отрицательным зарядом) устанавливают связи между собой. Кислород способен
держать их ближе к нему, чем водород. Молекула эта оказывается заряженной
отрицательно вблизи атома кислорода и положительно вблизи атомов водорода.
Поскольку противоположности притягиваются, молекулы воды имеют тенденцию
соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она
может растворять больше веществ, чем любая другая жидкость. И нам очень с этим
повезло: если бы не это химическое свойство, мы не могли бы выпить чашку
горячего подслащенного чая, потому что сахар остался бы на дне чашки. Вот
почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на
первый взгляд, на самом деле содержат огромное количество растворенных
элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри
нашего тела, вода растворяет в себе и несет чрезвычайно большое количество
различных веществ. Таким образом, она выполняет драгоценную задачу: переносить
иногда на большие расстояния вещества, с которыми она сталкивается на своем
пути. Причем, с водой при обычных климатических условиях не реагирует
большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7
(средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода
реагирует с немногими веществами, например, серой, некоторыми солями и
металлами. Также возможен гидролиз (распад) воды при реакции с какими-то
химическими веществами.
Вода может содержать огромное количество взвешенных частиц
разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение
чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая
и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих
случаях зависит от водородных связей внутри ее молекул. При сравнении этих
свойств со свойствами атомов или не связанных с водородом молекулярных
жидкостей с аналогичными размерами молекул некоторые особенности воды
заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании,
приводит ко многим последствиям в природе. Именно вода и ее свойство легко
проникать в расщелины скал, когда она замерзает, приводит к разрушению скал.
Постепенно происходит физическое и химическое выветривание скальных пород. И, в
конечном итоге, физические свойства и химические функции воды сформировали
почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а
не в точке замерзания, имеет важное значение для термического расслоения и
циркуляции воды в природе. Это химико-физическое свойство воды приводит к
замерзанию водоемов от их поверхности в направлении дна. Это важно не только
для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы
океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за
время лета, было бы достаточно только для оттаивания самого верхнего слоя. Так
осуществляется круговорот энергии и материи, которая опирается на циркуляции
океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его
способность хранить огромное количество энергии. Таким образом, водные потоки,
например, Гольфстрим, способны нести огромное количество тепла из более теплых
климатических зон в более холодные. Таким образом, океаны работают как огромные
термостаты. Не только климат Земли, но и температурное регулирование живых
организмов зависит от высокой теплоемкости воды. Это способствует, например,
поддержанию постоянной температуры тела у теплокровных организмов. Кроме того,
относительно высокая теплопроводность воды предотвращает серьезные локальные
колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03
мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных
водоемах значительно выше, из-за растворенных ионных компонентов. Вода, будучи
сильным диэлектриком (водный диэлектрик – константа), является одним из самых
лучших растворителей для солей и газов, которые способны к сольволизу с
последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для
гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть
воды. Она определяет количество воды, которое переходит в газовую фазу и может
транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в
физическом и химическом плане. Особые свойства воды сделали ее колыбелью и
абсолютным условием жизни на Земле. Зная основные характеристики этого
вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим
свойствам вода стала жидкой основой жизни.
Источник
