Какое вещество проявляет только окислительные свойства серная кислота

Оксид серы((VI))
Oксид серы(VI) образуется при каталитическом окислении сернистого газа:
2SO2+O2⇄t,k2SO3.
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
SO3+H2O=H2SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы((VI)) дымит на воздухе.
Особенностью оксида серы((VI)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы((VI)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
SO3+2NaOH=Na2SO4+H2O,
SO3+CaO=CaSO4.
Степень окисления серы в этом оксиде — (+6). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота H2SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
H2SO4+CuO=CuSO4+H2O,
H2SO4+Zn(OH)2=ZnSO4+2H2O;
- с солями, если образуется газ или нерастворимое вещество:
H2SO4+CaCO3=CaSO4+H2O+CO2↑,
H2SO4+BaCl2=BaSO4↓+2HCl.
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
H2+1SO4+Zn0=Zn+2SO4+H2↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2H2S+6O4+Cu0=Cu+2SO4+S+4O2+2H2O.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
H2SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5H2O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2H2O применяется в строительстве, сульфат бария BaSO4 — в медицине.
Источник
Сера – элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к
группе халькогенов – элементов VIa группы.
Сера – S – простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при
религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных
электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 – пирит, колчедан
- ZnS – цинковая обманка
- PbS – свинцовый блеск (галенит), Sb2S3 – сурьмяный блеск, Bi2S3 – висмутовый блеск
- HgS – киноварь
- CuFeS2 – халькопирит
- Cu2S – халькозин
- CuS – ковеллин
- BaSO4 – барит, тяжелый шпат
- CaSO4 – гипс
В местах вулканической активности встречаются залежи самородной серы.

Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S,
SO2.
H2S + O2 = S + H2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакции с кислотами
- Реакции с щелочами
На воздухе сера окисляется, образуя сернистый газ – SO2. Реагирует со многими неметаллами, без нагревания –
только со фтором.
S + O2 = (t) SO2
S + F2 = SF6
S + Cl2 = (t) SCl2
S + C = (t) CS2

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
K + S = (t) K2S
Al + S = Al2S3
Fe + S = (t) FeS
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO4 + NO2 + H2O
Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O

Сероводород – H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные
ванны).

Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- Восстановительные свойства
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит
от соотношения основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
2KOH + H2S = K2S + 2H2O
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
Сероводород – сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + S (недостаток кислорода)
H2S + O2 = H2O + SO2 (избыток кислорода)
H2S + HClO3 = H2SO4 + HCl

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы – SO2
Сернистый газ – SO2 – при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся
спички).

Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота,
распадающаяся на сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- Восстановительные свойства
- Как окислитель
С основными оксидами, основаниями образует соли сернистой кислоты – сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
2NaOH + SO2 = Na2SO3 + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4
SO2 + O2 = (t, кат. – Pt) SO3
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S + H2O
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
- Диссоциация
- Кислотные свойства
- Окислительные свойства
- Восстановительные свойства
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3-
HSO3- = H+ + SO32-
В реакциях с основными оксидами, основаниями образует соли – сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота – основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота – основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr

Оксид серы VI – SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора
(оксид ванадия – Pr, V2O5).
SO2 + O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты – сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
Химические свойства
- Кислотные свойства
- Окислительные свойства
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли – сульфаты и
гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке – средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке – кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O

SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
SO3 – сильный окислитель. Чаще всего восстанавливается до SO2.
SO3 + P = SO2 + P2O5
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.
В зависимости от поставленной задачи (окисление в жидкой или в газообразной фазе, окисление на поверхности) в качестве окислителя могут быть использованы самые разные вещества.
- Электрохимическое окисление позволяет окислять практически любые вещества на аноде, в растворах или в расплавах. Так, самый сильный неорганический окислитель, элементарный фтор, получают электролизом расплавов фторидов.
Распространённые окислители и их продукты[править | править код]
| Окислитель | Полуреакции | Продукт | Стандартный потенциал, В |
|---|---|---|---|
| O2кислород | Разные, включая оксиды, H2O и CO2 | +1,229 (в кислой среде) +0,401 (в щелочной среде) | |
| O3озон | Разные, включая кетоны и альдегиды | +2,07 (в кислой среде) | |
| Пероксиды | Разные, включая оксиды, окисляет сульфиды металлов до сульфатов H2O | ||
| Hal2галогены | Hal−; окисляет металлы, P, C, S, Si до галогенидов | F2: +2,87 Cl2: +1,36 | |
| ClO−гипохлориты | Cl− | ||
| ClO3−хлораты | Cl− | ||
| HNO3азотная кислота | с активными металлами, разбавленная с активными металлами, концентрированная с тяжёлыми металлами, разбавленная c тяжёлыми металлами, концентрированная | NH3, NH4+ NO NO NO2 | |
| H2SO4, конц. серная кислота | c неметаллами и тяжёлыми металлами с активными металлами | SO2; окисляет металлы до сульфатов с выделением сернистого газа или серы S H2S | |
| Шестивалентный хром | Cr3+ | +1,33 | |
| MnO2оксид марганца(IV) | Mn2+ | +1,23 | |
| MnO4−перманганаты | кислая среда нейтральная среда сильнощелочная среда | Mn2+ MnO2 MnO42− | +1,51 +1,695 +0,564 |
| Катионы металлов и H+ | Me0 H2 | См. Электрохимический ряд активности металлов |
Зависимость степени окисления от концентрации окислителя[править | править код]
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен её раствор, тем полнее протекает восстановление.
В качестве примера — реакция азотной кислоты с цинком:
- Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
- 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
- 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
- 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
- 4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Сильные окислители[править | править код]
Сильными окислительными свойствами обладает «царская водка» — смесь одного объёма азотной кислоты и трёх объёмов соляной кислоты.
HNO3 + 3HCl ↔ NOCl + 2Cl + 2H2O
Образующийся в нём хлористый нитрозил распадается на атомарный хлор и монооксид азота:
NOCl=NO + Cl
Царская водка является сильным окислителем благодаря атомарному хлору, который образуется в растворе.
Царская водка окисляет даже благородные металлы — золото и платину.
Селеновая кислота — одна из немногих неорганических кислот, в концентрированном виде способная окислять золото. Более сильный окислитель даже в умеренно разбавленном растворе, чем серная кислота. Способна к окислению соляной кислоты по уравнению:
При этом продуктами реакции являются селенистая кислота, свободный хлор и вода. В то же время концентрированная серная кислота не способна окислять HCl.
Ещё один сильный окислитель — перманганат калия. Он способен окислять органические вещества и даже разрывать углеродные цепи:
С6H5-CH2-CH3 + [O] → C6H5COOH + …
C6H6 + [O] → HOOC-(CH2)4-COOH
Сила окислителя при реакции в разбавленном водном растворе может быть выражена стандартным электродным потенциалом: чем выше потенциал, тем сильнее окислитель.
К сильным окислителям относятся также оксид меди(III), озонид цезия, надпероксид цезия, все фториды ксенона.
Очень сильные окислители[править | править код]
Условно к «очень сильным окислителям» относят вещества, превышающие по окислительной активности молекулярный фтор. К ним, например, относятся: гексафторид платины, диоксидифторид, дифторид криптона, фторид серебра(II), катионная форма Ag2+, гексафтороникелат(IV) калия. Перечисленные вещества, к примеру, способны при комнатной температуре окислять инертный газ ксенон, что неспособен делать фтор (требуется давление и нагрев) и тем более ни один из кислородсодержащих окислителей.
См. также[править | править код]
- Окислительно-восстановительные реакции
Источник
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
1
1
Число электронов на внешнем энергетическом уровне атома фосфора в возбуждённом состоянии равно
1) 5
2) 4
3) 3
4) 6
2
2
Окислительные свойства серы выражены сильнее, чем свойства элемента, имеющего электронную конфигурацию
1) ls22s22p4
2) ls22s22p5
3) ls22s22p63s2
4) ls22s22p63s23p5
3
3
В гидроксиде кальция связи
1) только ионные
2) только ковалентные полярные
3) как ионные, так и ковалентные неполярные
4) как ковалентные полярные, так и ионные
4
4
Значения высшей и низшей степени окисления серы соответственно равны
1) +2 и -6
2) +6 и -2
3) +6 и -3
4) +5 и -2
5
5
Амфотерным и кислотным оксидами соответственно являются
1) ZnO, Na2O
2) SO3, CaO
3) P2O5, Na2O
4) ZnO, Сl2О3
6
6
Верны ли следующие утверждения?
А. Выделение тепла и света всегда является признаком протекания химических реакций.
Б. При взаимодействии веществ всегда изменяется их агрегатное состояние.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
7
7
С образованием катионов металла в растворах диссоциируют
1) основные оксиды
2) кислотные оксиды
3) основания
4) кислоты
8
8
Осадок не образуется при смешивании растворов
1) карбоната натрия и серной кислоты
2) сульфата калия и нитрата бария
3) карбоната кальция и фосфорной кислоты
4) сульфита калия и хлорида бария
9
9
При взаимодействии хлора с раствором гидроксида натрия при обычных условиях преимущественно образуются
1) → NaCl + Н2↑
2) → NaCl + NaClO3 + Н2O
3) → NaCIO + NaCl + Н2O
4) → NaCl + H2 ↑ + O2 ↑
10
10
Сколько веществ из указанных в ряду: H2SO3, Ва(ОН)2, СаО, Н2O — реагируют с оксидом углерода(IV) при комнатной температуре?
1) 1
2) 2
3) 3
4) 4
11
11
Верны ли следующие суждения?
А. Все кислоты — жидкие вещества.
Б. Фенолфталеин в растворах кислот имеет малиновую окраску.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
12
12
Соль образуется при
1) разложении известняка
2) растворении натрия в воде
3) фотосинтезе
4) взаимодействии аммиака с хлороводородом
13
13
Верны ли следующие суждения о чистых веществах и смесях?
А. Сталь является смесью веществ.
Б. Латунь является чистым веществом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14
14
Только восстановительные свойства проявляет
1) азот
2) цинк
3) йод
4) сера
15
15
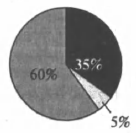
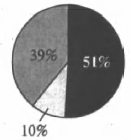
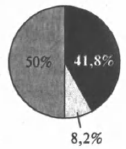
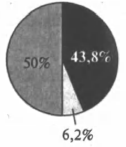
На какой диаграмме распределение массовых долей элементов отвечает качественному составу нитрита аммония?
1) 
2) 
3) 
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
16
16
В ряду химических элементов Be → С → N:
1) уменьшается число протонов в ядре
2) уменьшается электроотрицательность
3) увеличивается число электронов на внешнем электронном слое
4) увеличивается радиус атомов
5) усиливаются неметаллические свойства
17
17
Как с бромной водой, так и с водой могут взаимодействовать
1) метан
2) этилен
3) этан
4) этин
5) гексан
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
18
18
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) Н3РO4(р-р) и КОН(р-р)
Б) HNO3(p-p) и Na2SO4(p-p)
В) КОН и Ва(ОН)2(р-р)
РЕАКТИВ
1) метилоранж(р-р)
2) NaOH(p-p)
3) Na3PO4(p-p)
4) NH3(p-p)
19
19
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА
А) оксид калия
Б) оксид фосфора(V)
В) оксид хрома(III)
ВЕЩЕСТВА
1) H2O, LiOH
2) Н2O, Si
3) Н2, Fe3O4
4) Н2O, N2O5
5) NaOH, Al
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
20
Используя метод электронного баланса, составьте уравнение реакции
С + SiO2 + Са3(РO4)2 → Р + СО + CaSiO3.
Определите окислитель и восстановитель.
Показать ответ
С0 + SiO2 + Са3(Р+5O4)2 → Р0 + С+2O + CaSiO3

2Р0 + 5С0 = 2Р0 + 5С+2
Р+5(Са3(Р+5O4)2) — окислитель
С0 — восстановитель
Молекулярное уравнение
5С + 3SiO2 + Са3(РO4)2 = 2Р + 5СО + 3CaSiO3
21
Техническую кальцинированную соду, массовая доля примесей-в которой составляет 5%, обработали избытком соляной кислоты. При этом выделилось 2 моль оксида углерода(IV). Вычислите массу технической соды, вступившей в реакцию с кислотой.
Показать ответ
1) Уравнение реакции:
Na2CO3 + 2НСl = 2NaCl + Н2O + CO2↑.
2) Рассчитываем массу Nа2СO3(чист):
а) по уравнению реакции
n(Na2CO3) = n(СO2) = 2 моль
M(Na2CO3) = 106 г/моль, m(Na2CO3) = 2 • 106 = 212 г.
3) Рассчитываем массу технической соды: m(Na2CO3 + примеси) = 212 • 100/95 ≈ 223,16 г.
22
Даны вещества: FeCl2, CuS, растворы H2SO4, HNO3, NaOH, H2O2. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат железа(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Показать ответ
Схема эксперимента FeCl2 → Fe(OH)2 → Fe(NO3)2
1) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
Fe2++ 2OH-= Fe(OH)2
Образуется осадок белого цвета. Реакция ионного обмена.
2) Fe(OH)2 + 2HNO3 = Fe(NO3)2 + 2Н2O
Fe(OH)2 + 2Н+ = Fe2+ + 2Н2O
Осадок Fe(OH)2 растворяется и образуется бесцветный раствор. Реакция ионного обмена.
| № | Ваш ответ | Правильный ответ | Первичный балл |
|---|---|---|---|
Здесь появится результат тестовой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы. | |||
Делитесь своими результатами или спрашивайте, как решить конкретное задание. Будьте вежливы, ребята:
Источник
