Какое вещество дает одинаковые продукты при электролизе

Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
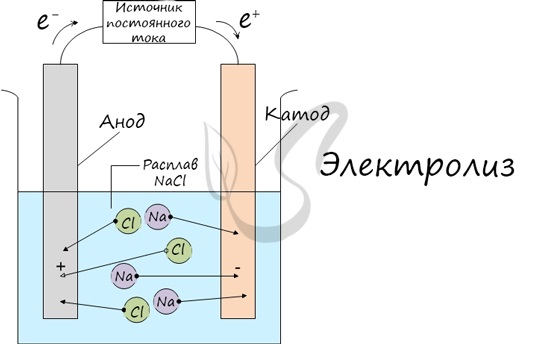
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
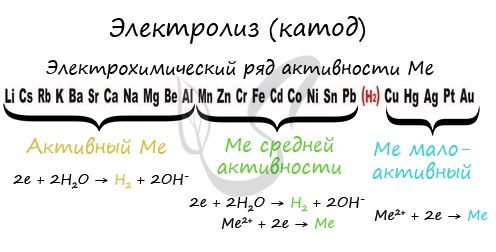
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
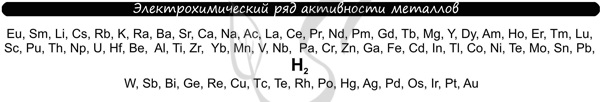
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
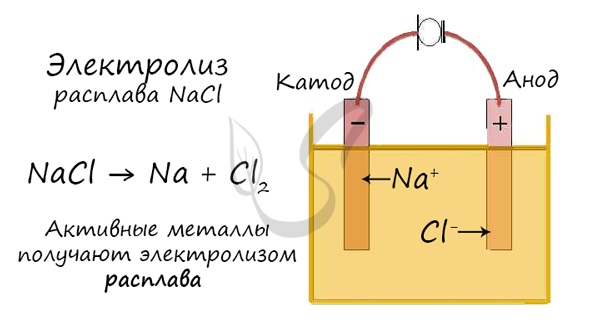
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Электролиз воды
Для успешного решения задача по уравнениям электролиза, Вам, прежде всего, нужно научиться писать эти уравнения. Тогда решение задач на электролиз сведется к решению задач по уравнению реакции, с некоторыми особенностями, которые я и намереваюсь обсудить в этой статье.
Только напомню, что
электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.
Для лучшего понимания процесса электролиза, предлагаю сначала посмотреть опыт по электролизу раствора сульфата меди (II):
Как показано в опыте количество вещества (в данном опыте меди) выделившегося на электроде прямо пропорционально количеству электричества q (q=I*t, где I – сила тока, t – время электролиза), пропущенного через раствор электролита (закон Фарадея).
То есть, чем дольше пропускаем ток, тем больше меди осядет на катоде. Как долго может продолжаться этот процесс? В данном эксперименте – пока не раствориться анод, так как он медный, а значит – растворимый. В этом случае цепь разомкнется и ток прекратиться.
А если взять угольные электроды? Как долго можем проводить эксперимент и сколько меди получим? На вторую часть вопроса, с точки зрения химика, ответить легко – максимальное количество моль меди выделившееся на каноде равно количеству моль сульфата меди (II) в растворе, так как процесс проходит согласно уравнению реакции:
CuSO4 + 2Н2О = Сu + H2SO4 + O2
А на первую часть вопроса, как долго можем проводить эксперимент, ответить сложнее. Но давайте попробуем, не прибегая к расчетам, проанализировать этапы прохождения процесса электролиза и понять, на каком этапе электролиз прекратился, с точки зрения химии.
На первом этапе – ток пропускаем непродолжительное время, и как результат в растворе остается непрореагировавший сульфат меди (II).
На втором этапе – ток пропускали ровно столько, чтобы весь сульфат меди прореагировал. Процесс электролиза сульфата меди прошел до конца.
На третьем этапе – ток продолжаем пропускать и после того как весь сульфат меди прореагировал. Будет ли проходить электролиз? Да, будет. Проходит электролиз воды (точнее, электролиз раствора серной кислоты, в данном конкретном случае):
2Н2О = 2Н2 + О2
На четвертом этапе – ток пропускаем уже через концентрированный раствор серной кислоты (большая часть воды из раствора разложилась). Проходит электролиз концентрированного раствора серной кислоты (но эта реакция уже вне рамок школьного курса химии, как и последующие возможные превращения образовавшихся веществ).
То есть, с точки зрения химика, электролиз можно проводить до тех пор, пока не разложатся все вещества содержащиеся в растворе.
В задачах школьного курса химии, рассматриваются только процессы, описанные как первые три этапа электролиза. И на основании этих трех случаев электролиза решим небольшие расчетные задачи.
1. Через 200 г раствора сульфата меди (II), содержащего 4 мас.% CuSO4, некоторое время пропускали постоянный ток. Выделилось 0,448 л газа (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
Запишем уравнение реакции:
CuSO4 + 2Н2О = Сu + H2SO4 + O2
Находим массу сульфата меди (II) в растворе: m(CuSO4 ) = 200*0,04 = 8 г
Количесвто моль CuSO4 : n(CuSO4)исход. = 8/160 = 0,05 моль.
Количество моль газа: n(газ) = 0,448 /22,4 = 0,02 моль.
Согласно уравнению реакции, если бы разложился весь сульфата меди (II) (0,05 моль), то выделилось бы 0,05 моль газа – кислорода.
Поскольку, n(газ) = 0,02 < 0,05, то не весь сульфата меди (II) прореагировал.
n(CuSO4)прореаг. = n(газ) =0,02 моль.
В растворе осталось: n(CuSO4)конеч. = n(CuSO4)исход. – n(CuSO4)прореаг. = 0,05 – 0,02 = 0,03 моль.
Кроме того, в результате реакции образовались серная кислота:
n(H2SO4) = n(газ) = 0,02 моль и медь: n(Cu) = n(газ) = 0,02 моль.
Таким образом, в растворе присутствуют два вещества: сульфат меди и серная кислота.
m(CuSO4)конеч. = n(CuSO4)конеч*М = 0,03* 160 = 4,8 г
m( H2SO4)конеч. = n(H2SO4)*М = 0,02* 98 = 1,96 г.
Масса раствора:
m(p-pa)конеч.= m(p-pa)исх. – (Сu) – m(O2)=200 – 0,02*64-0,02*32 = 198,08 г.
Массовые доли растворенных веществ:
w(CuSO4 ) = m(CuSO4 )конеч./m(p-pa)конеч. = 4,8/198,08 = 0,024 (2,4%)
w( H2SO4 ) = m( H2SO4 )конеч./m(p-pa)конеч. = 1,96/198,08 = 0,01 (1%).
2. Через 200 г раствора сульфата меди (II), содержащего 4 мас.% CuSO4, пропускали постоянный ток, до тех пор пока масса раствора не уменьшилась на 4,8 г. Определите концентрации веществ в мaс.% в полученном растворе.
Уравнение реакции:
CuSO4 + 2Н2О = Сu + H2SO4 + O2
Масса сульфата меди (II) в растворе: m(CuSO4) = 200*0,04 = 8 г
Количество моль CuSO4: n(CuSO4)исход. = 8/160 = 0,05 моль.
Как видно из уравнения реакции, масса раствора должна была уменьшиться за счет меди, осевшей на катоде и кислорода – выделившегося на аноде. Если бы указанные вещества выделялись в тех количествах, что указаны в уравнении реакции, то масса раствора уменьшилась бы на: 64 + 32 = 96 г. Но поскольку, масса раствора уменьшилась только на 4,8 г, то n(Cu)=n(O2) = 4,8/96 =0,05 моль. (К этому же результату можем прийти, решив уравнение: 64х + 32х = 4,8, где х – количество моль меди).
Так как n(CuSO4) = n(Cu) = 0,05 моль, то очевидно, что весь сульфат меди прореагировал. А в растворе осталась только серная кислота, количеством вещества 0,05 моль.
Масса серной кислоты: m(H2SO4) = 0,05*98 = 4,9 г.
- Масса раствора: m(p-pa)конеч. = 200 – 4,8 = 195,2 г.
Массовая доля растворенного вещества:
w( H2SO4 ) = m(H2SO4 )конеч./m(p-pa)конеч. = 4,9/195,2 =0,0251 (2,51%).
3. При проведении электролиза 200 г раствора сульфата меди (II), содержащего 4 мас.% CuSO4, процесс прекратили, когда на аноде выделилось 2,24 л газа. Определите концентрации веществ в мaс.% в полученном растворе.
Уравнение реакции: CuSO4 + 2Н2О = Сu + H2SO4 + O2
Масса сульфата меди (II) в растворе: m(CuSO4 ) = 200*0,04 = 8 г. Количество моль CuSO4: n(CuSO4)исход. = 8/160 = 0,05 моль.
Количество моль газа, выделившегося на аноде:
n(газ) = 2,24/22,4 = 0,1 моль.
Согласно уравнению реакции, из 0,05 моль CuSO4 образуется 0,05 моль O2.
То есть, весь CuSO4 прореагировал, да еще дополнительно разложилась вода, дав 0,05 моль газа на аноде. Уравнение реакции разложения воды:
2Н2О = 2Н2 + О2
n(O2)разлож.воды = 0,1- 0,05 = 0,05 моль.
Таким образом, растворенным веществом является только серная кислота, образовавшаяся в результате электролиза раствора сульфата меди (II).
Количество моль серной кислоты: n(H2SO4) = n(CuSO4) = 0,05 моль.
Масса серной кислоты: m(H2SO4) = 0,05*98 = 4,9 г.
Масса раствора:
m(p-pa)конеч.= m(p-pa)исх.-m(Сu) – m(O2) – m(H2)разлож.воды- m(O2)разлож.воды = 200 – 0,05*64-0,05*32-2*0,05*2-0,05*32 = 193,4 г.
Массовая доля растворенного вещества:
w( H2SO4 ) = m( H2SO4 )конеч./m(p-pa)конеч. = 4,9/193,4 = 0,0253 (2,53%).
На простых примерах мы разобрали решения задач на отдельные случаи процессов электролиза. А теперь решим две 34 задачи, по реакцям электролиза.
Первая задача, на неполный электролиз растворенного вещества с отбором порции раствора.
Условие задачи:
Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение:
Еще одна задача по реакции электролиза с дополнительным электролизом воды.
Условие задачи:
Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 11,2 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
Решение:
А вот задачи для самостеятельного решения.
1. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, как на аноде выделилось 6,72 л газа. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе. [3,5%]
2. Для проведения электролиза (на инертных электродах) взяли 372,5 г 20%-ного раствора хлорида калия. После того как масса раствора уменьшилась на 29,2 г, процесс остановили. К образовавшемуся раствору добавили 162,5 г 20%-ного раствора хлорида железа(III). Определите массовую долю хлорида калия в полученном растворе.[13,6%]
3. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 11,2 л газа. Из полученного раствора отобрали порцию массой 79,44 г, а к оставшемуся раствору прибавили 145,75 г 16% раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе. [0,5%]
4. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. [3,7%]
Успехов в решении задач на электролиз!
Источник
Электролиз растворов и расплавов электролитов.
ЭЛЕКТРОЛИЗ –это процесс разложения расплавов и растворов электролитов под действием электрического тока.
В раствор или расплав какого-либо электролита опускают электроды: катод (-) и анод (+).
При этом ионы, образовавшиеся при диссоциации электролита, движутся к электродам и разряжаются на них, принимая или отдавая электроны.
Электролиз расплавов.
1)Расплав хлорида натрия. Он содержит катион натрия и анион хлора.
| катод: | Na+ + 1e à Na0 | На катоде: разряжается КАТИОН натрия: |
| анод: | 2Cl- – 2e à Cl20 | На аноде: разряжается АНИОН хлора: |
Cуммарное уравнение электролиза: 2NaCl(расплав) 2Na + Cl2
Расплав гидроксида натрия.
4NaOH (расплав) 4Na + O2 + 2H2O
| катод: | Na+ + 1e à Na0 | 4 |
| анод: | 4ОН- – 4e à O2 + 2H2O | 1 |
Расплав оксида алюминия в криолите.
Криолит – Na3[AlF6] используют для уменьшения температуры плавления оксида алюминия.
Электролиз проводится на графитовых электродах, при этом часть электрода сгорает в выделяющемся кислороде, выделяются оксиды углерода.
2Al2O3 (расплав) 4 Al + 3O2
Электролиз растворов электролитов с инертными электродами.
| Катодный процесс-разрядка катиона зависит от положения в электрохимическом ряду напряжений. | Анодный процесс |
| 1. Металлы правее Н: разряжаются на катоде ® Ме¯ | 1. Анионы бескислородных кислот (кроме F-) – разряжаютсядо простого вещества: S2- >I- >Br ->Cl- |
| 2. Металлы от Al до Н: идёт два параллельных процесса: а) разрядка металла ® Ме¯ б) разрядка воды: ® Н2 | 2. Анионы кислородсодержащих кислот и F- не разряжаются, идёт разрядка воды: ® О2 |
| 3. Если в растворе ионы Н+- они разряжаются до Н2 | 3. Если есть ОН- он разряжается с выделением О2 |
| 4. Металлы левее алюминия – НЕ РАЗРЯЖАЮТСЯ, идёт разрядка воды: ®Н2 | 4. Анионы карбоновых кислот – реакция Кольбе. Происходит процесс декарбоксилирования и выделяется алкан (в результате сдваивания алкильных радикалов). Пример: 2CH3COO- -2e à 2CO2+ CH3-CH3 |
Примеры:
1) раствор хлорида натрия. NaCl + H2O
| 2Н2О +2е à H2 + OH- | 1 | катод: около катода Na+ и H2O. Натрий левее Al, поэтому идёт разрядка воды. |
| 2Cl- – 2e à Cl2 | 1 | анод: около анода хлорид-анион и вода. Разряжается ион Cl- |
Cуммарное уравнение электролиза:
2NaCl + 2H2O Сl2 + H2 + 2NaOH
На электродах выделяются газообразные продукты – хлор и водород, в растворе накапливается гидроксид натрия.
2) раствор сульфата меди (II) CuSO4 + H2O
| Cu2+ +2е à Cu | 1 | катод: около катода Cu2+ и H2O.Медь левее Н, поэтому она сама будет разряжаться на катоде: |
| 2H2O – 4eàO2+ 4H+ | 1 | анод: около анода – сульфат- анион и вода. Разряжается вода. |
Cуммарное уравнение электролиза:
CuSO4 + H2O Cu + O2 + H2SO4
На катоде выделяется металл – медь, на аноде – газообразный кислород, в растворе накапливается серная кислота.
Электролиз растворов солей с растворимым анодом.
Если анод из того же металла, что и металл в составе соли (например, медный анод в растворе сульфата меди), то на аноде не происходит разрядки воды или аниона. Происходит процесс РАСТВОРЕНИЯ АНОДА: Ме+n + nē = Ме0
Пример: электролиз раствора сульфата никеля с никелевыми электродами.
катод: Ni2+ + 2ē = Ni0
анод: Ni0 – 2ē = Ni2+
В3. Электролиз расплавов и растворов (солей, щелочей, кислот).
1. Какое из веществ дает одинаковые продукты при электролизе водного раствора и расплава? 1) СuСl2 2) КВr 3) КОН 4) AgNO3
2. Электролиз раствора сульфата меди описывается уравнением:
1) СuSО4 + 2Н2О = Сu(ОН)2 + Н2SО4 2) 2СuSО4 = 2СuО + SО2 + О2
3) 2Н2O = 2Н2 + O2 4) 2СuSО4 + 2Н2О = 2Сu + 2Н2SО4 + О2
3.При электролизе водного раствора нитрата марганца (II) на катоде выделяются
1)марганец 2) кислород 3)марганец и водород 4) марганец и кислород
4.Кислород выделяется на аноде при электролизе водного раствора
1)хлорида меди (II) 3) бромида цинка
2) алюмокалиевых квасцов 4) сульфида натрия
5.Кислород выделяется на аноде при электролизе водного раствора
1)хлорида натрия 3) йодида натрия 2)бромида натрия 4) фторида натрия
6. При электролизе раствора соли меди (II) выделяется кислород. Какая это соль?
1) Бромид 2) Нитрат 3) Хлорид 4) Сульфид
7. При электролизе раствора хлорида калия вблизи катода среда
1) щелочная 2) кислая 3) нейтральная 4)соленая
8.Электролиз водного раствора соли можно использовать для получения
1)кальция 2) бария 3) цинка 4) лития
9.Только газообразные продукты выделяются на катоде и аноде при электролизе водного раствора 1) МnСl2 2) КСl 3) Cr2(SO4)3 4) Cu(NO3)2
10.Электролиз водного раствора соли нельзя использовать для получения
1)магния 2) меди 3) цинка 4) хрома
11.Кислород выделяется на аноде при электролизе водного раствора
1) нитрата лития 4) бромида хрома (III)
2)хлорида меди (II) 5) фторида натрия
3)сульфата железа (II) 6) йодида бария
12.Кислород не выделяется на аноде при электролизе водного раствора
1)сульфида лития 4) хлорида хрома (III)
2)сульфата цинка 5) фторида калия
3)нитрата никеля (II) 6) бромида кальция
13. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах:
| ФОРМУЛЫ ВЕЩЕСТВ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) KBr Б) KOH В) MgSO4 Г) CuSO4 | 1)Cu, O2, H2 2) Cu, O2 3) H2, O2 4) H2, Br2 5) Mg, O2, H2 6) K, O2, H2 |
14. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| A)АlСl3 Б) RbOH B) Hg(NО3)2 Г) АuСl3 | 1) металл, галоген 2) гидроксид металла, хлор, водород 3) металл, кислород 4) водород, галоген 5) водород, кислород 6) металл, кислота, кислород |
9.Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ ЭЛЕКТРОЛИЗА |
| А) KBr Б) K2SO4 В) HNO3 Г) AgNO3 | 1) водород 2) калий 3) серебро 4) кислород 5) сера 6) оксид азота (IV) |
10. Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА |
| A) KBr Б) AlCl3 B) CuSO4 Г) AgNO3 | 1) 2H2O – 4eà O2+4H+ 2) 2H2O + 2e à H2 + 2OH- 3) 2Cl- – 2e à Cl2 4) 2Br–2e à Br2 5) SO42- – 2e à SO2 + O2 6) 2NO3- – 2e à 2NO2+ O2 |
11. Установите соответствие между формулой соли и уравнением анодного процесса в водном растворе.
| ФОРМУЛА СОЛИ | УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА |
| A) Al(NО3)3 Б) CuCl2 B) SbCl3 Г) Cu(NО3)2 | 1) 2H2О – 4е à О2+ 4H+ 2) 2H2О + 2е à H2+ 2ОH- 3) 2Cl- -2е à Cl2 4) Sb3++ 3е à Sb0 5) Cl- + 4H2О – 8е à ClO4- + 8H+ 6) 4NО3- – 4е à 2N2О + 5О2 |
25. Установите соответствие между формулой соли и продуктами, образующимися на аноде при электролизе его водного раствора.
| Формула соли | Продукты на аноде |
| A)CH3COONa Б) Cu(NO3)2 B)K2SO3 Г) АlСl3 | 1) металл 2) кислород 3) оксид серы (IV) 4) этан, углекислый газ 5) галоген 6)оксид азота (IV) |
Коррозия металлов.
Коррозия – это разрушение металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе.
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
1) Благородные металлы не подвергаются коррозии из-за химической инертности;
2) Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии;
3) Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия происходит при воздействии на металл сухих газов, её называют газовой. 3Fe + 2O2 = Fe3O4
В аппаратах химических производств возможны процессы:
Fe + 2HCl à FeCl2 + H2
2 Fe + 3Cl2 à 2FeCl3
Электрохимическая коррозия – разрушение металла в присутствии воды и кислорода, либо в растворах электролитов.
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
Читайте также:
Рекомендуемые страницы:
©2015-2020 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-08-27
Нарушение авторских прав и Нарушение персональных данных
Источник
