Какое утверждение характеризующее свойства алмаза является неверным

Алмаз (adamas, adamant, diamond). Старое название алмаза – адамас. Греческое слово “адамас” (αδαμας)
означает “непобедимый”, “непреодолимый”. Поначалу старинное название алмаза “адамас” не обозначало драгоценный камень; греческие летописцы
использовали его, описывая очень прочные металлы и сплавы (в частности, сталь), которые казались несокрушимыми по сравнению с бронзой.
В английском языке используются слова, которые происходят от старого названия алмаза “адамас”, это: adamant (1 – алмаз; 2 – непреклонный),
adamantine (очень твёрдый), adamantly (категорически). Первое упоминание термина “адамас” как названия алмаза, с характерным описанием камня и
его ценности, было найдено у поэта Марка Манилия (эпоха императора Августа).
Алмаз – типичный ковалентный кристалл, обладающий рядом уникальных свойств: самыми высокими среди известных материалов
твёрдостью, прочностью при сжатии, трещиностойкостью. Беспримесные алмазы являются одними из лучших изоляторов и прозрачны
практически для любых длин волн.
Алмаз отличается исключительной химической устойчивостью и инертностью к агрессивным средам.
Благодаря столь ценным свойствам алмаз всё шире применяется в различных отраслях промышленности и современной техники как
инструментальный и конструкционный материал.
Физические свойства алмаза
Из всех известных драгоценных камней алмаз является самым простым по своему химическому составу, он состоит из одного элемента – углерода.
Удивительно, что из одного и того же элемента получилось два настолько разных вещеста: алмаз и графит. Общие
физические свойства алмаза и графита представлены в сравнительной таблице.
Алмаз – исключительный технический материал. При этом для технических целей ценны все свойства алмаза: абразивные, термические, электрические,
оптические и др.
По десятибалльной шкале твёрдости Мооса алмаз является эталоном наивысшей твёрдости и имеет значение 10.
Для подробного изучения физических свойств алмаза рекомендуется изучить специальную литературу [1,2].
В кристалле алмаза кроме углерода всегда присутствует некоторое количество примесей, составляющих не более
десятых долей процента, но иногда доходящих до 5%. Основные химические элементы-примеси в алмазе – азот, кислород, водород, железо, титан,
марганец, кремний, алюминий, реже встречаются и некоторые другие. Азот является одной из характерных примесей, оказывающих существенное влияние
на ряд свойств алмаза, в частности на его люминесценцию (свечение). Железистые примеси придают алмазу оранжево-желтые оттенки.
Кристаллическая решётка алмаза

Алмаз кристаллизуется в кубической системе, отвечающей самой плотной упаковке атомов и содержащей всего 18 атомов углерода.
В кристаллической решётке алмаза каждый атом связан с четырьмя ближайшими соседними атомами, расположенными в вершинах правильного тетраэдра.
Расстояние между двумя соседними атомами решётки 0,154 нм. Постоянный размер кристаллической решётки алмаза 0,356 нм.
Алмаз образовывается при высоких давлении и температуре, как правило – в земных недрах, на большой глубине. Эти выводы геологов были
использованы исследователями, работающими над проблемой искусственного получения алмазов. Получение искусственных алмазов имеет длинную историю,
подробно останавливаться на этом мы сейчас не будем. Акцентируем внимание лишь на способе, который первым предложил Анри Муассан
(первооткрыватель фтора, 1852-1907)). Расплавленный в дуговой печи, перенасыщенный углеродом чугун Анри Муассан мгновенно охлаждал водой. Корка
застывшего чугуна, сжимаясь за счёт охлаждения, с чудовищной силой сдавливала ещё горячее ядро, внутри которого создавалось высокое давление.
Таким способом Анри Муассан сумел получить мелкие твёрдые кристаллы плотностью 3,5 г/см3, которые современники долгое время считали
алмазами. Позже способ Анри Муассана подвергся критике и сомнению. Тем не менее эта теория получения алмаза не угасла, а наоборот вдохновила
многих учёных на дальнейшие исследования. В настоящее время продолжают разрабатываться гипотезы процессов формирования алмаза в чугуне.
Предлагаем вашему вниманию статью Давыдова С.В. Кристаллизация шаровидного графита в расплаве высокопрочного чугуна),
а также статью про “гексагональный алмаз” – лонсдейлит.
Фазовые равновесия алмаза с металлами
Добавка некоторых металлов или сплавов позволяет осуществить переход Г→А (графит-алмаз) при более низких давлениях и
температурах, чем в случае прямого перехода. […] В отличие от прямого перехода в этом случае возможно образование алмаза в
условиях, близких к равновесным. Для каждого металла существует нижний предел температур, ниже которого металл не оказывает
положительного влияния на образование алмаза. Верхний предел температур образования алмаза в присутствии любого из металлов
близок к равновесной температуре А↔Г.
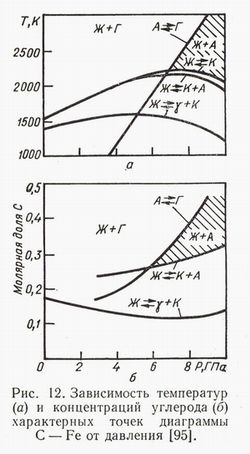
Двойные системы углерод-металл. Система C-Fe. Образование алмаза
Стабильная диаграмма C-Fe при атмосферном давлении сходна с диаграммами C-Ni и C-Co, также образует
эвтектику γ + Г ↔ Ж
(T=1426 K, молярная доля углерода 0,171), отличаясь только в области сплавов, богатых железом, в связи с полиморфизмом последнего,
что несущественно с точки зрения равновесий углерода. Кроме стабильной, известна метастабильная диаграмма этой системы с образованием
цементита Fe3C и эвтектикой γ + Fe3C ↔ Ж при температуре 1420 K
и молярной доле углерода 0,1728. […]
При повышении давления стабилизируется цементит […], выше 8 ГПа стабилизируется карбид Fe7C3 […]. На рис.12
показана зависимость характерных точек диаграммы C-Fe от давления. Согласно этим данным, образование алмаза из расплава возможно при
давлениях выше 6,4 ГПа и температурах выше 2120 K (давление и температура более высокие, чем в системе C-Ni). Однако экспериментально
алмаз был получен при давлении 5,3 ГПа и температуре 1600 K или 4,7 ГПа и 1580 K. В связи с этим высказано
предположение, что цементит плавится при более низкой температуре […]. Другое предположение состоит в том, что алмаз может
образоваться при плавлении метастабильной эвтектики γ + Г.
Пояснения: А – алмаз, Г – графит, К – карбид, Ж – жидкость
Автор: Корниенко А.Э. (ИЦМ)
Литература:
- Справочник “Физические свойства алмаза” Под ред. Новикова Н.В. – Киев: Наукова думка, 1987. – 188 с. УДК 539.2: 549.211
- Васильев Л.А., Белых З.П. Алмазы, их свойства и применение. М., Недра, 1983. 101 с. УДК 553.81 : 549.211 : 679.89
- The natural history, ancient and modern, of precious stones and gems, and of the precious metals. By C.W.King, M.A., – London: Bell and Daldy, 1865.
Источник
Ñàìîå òâåðäîå âåùåñòâî
Íàèáîëåå òâ¸ðäûì èç ñóùåñòâóþùèõ íà ñåãîäíÿøíèé äåíü ìàòåðèàëîâ ÿâëÿåòñÿ óëüòðàòâ¸ðäûé ôóëëåðèò (ïðèìåðíî â 1,171,52 òâ¸ðæå àëìàçà). Îäíàêî ýòîò ìàòåðèàë äîñòóïåí òîëüêî â ìèêðîñêîïè÷åñêèõ êîëè÷åñòâàõ. Ñàìûì æå òâ¸ðäûì èç ðàñïðîñòðàí¸ííûõ âåùåñòâ ÿâëÿåòñÿ àëìàç. Êðîìå òîãî, ñóùåñòâóåò èíôîðìàöèÿ, ÷òî ãðóïïå àìåðèêàíñêèõ è êèòàéñêèõ ó÷åíûõ óäàëîñü äîêàçàòü, ÷òî ñïåöèàëüíî îáðàáîòàííûé ëîíñäåéëèò íà 58% òâåðæå àëìàçà.
Ëîíñäåéëèò ïðåäñòàâëÿåò ñîáîé îäíó èç àëëîòðîïíûõ ìîäèôèêàöèé óãëåðîäà. Ñòðóêòóðà åãî êðèñòàëëè÷åñêîé ðåøåòêè íàïîìèíàåò ñòðóêòóðó ðåøåòêè àëìàçà. Çà ýòî äàííûé ìàòåðèàë ïîëó÷èë âòîðîå èìÿ – ãåêñàãîíàëüíûé àëìàç. Îòëè÷èå çàêëþ÷àåòñÿ â òîì, ÷òî ýëåìåíòàðíàÿ ÿ÷åéêà ëîíñäåéëèòà ñîäåðæèò ÷åòûðå àòîìà, à ÿ÷åéêà àëìàçà – âîñåìü. Îäíàêî, ïî ñëîâàì èññëåäîâàòåëåé, ìàëîâåðîÿòíî, ÷òî íîâûé ìàòåðèàë íàéäåò ïðàêòè÷åñêîå ïðèìåíåíèå, ïîòîìó ðàññìàòðèâàòü åãî òåîðåòè÷åñêèå ñâîéñòâà íà äàííûé ìîìåíò íå èìååò íèêàêîãî ñìûñëà.
Ôóëëåðèò ýòî ìîëåêóëÿðíûé êðèñòàëë, â óçëàõ ðåø¸òêè êîòîðîãî íàõîäÿòñÿ ìîëåêóëû ôóëëåðåíà.
Àëìàç ìèíåðàë, îäíà èç àëëîòðîïíûõ ôîðì óãëåðîäà.
Òâ¸ðäîñòü ñâîéñòâî ìàòåðèàëà ñîïðîòèâëÿòüñÿ ïðîíèêíîâåíèþ â íåãî äðóãîãî, áîëåå òâ¸ðäîãî òåëà.
ÔÓËËÅÐÈÒ – ÍÎÂÀß ÔÎÐÌÀ ÓÃËÅÐÎÄÀ
È. Â. ÇÎËÎÒÓÕÈÍ, Âîðîíåæñêèé òåõíè÷åñêèé óíèâåðñèòåò
ÂÂÅÄÅÍÈÅ
 1990 ãîäó ñðåäè ôèçèêîâ è õèìèêîâ âîçíèê áóì èññëåäîâàòåëüñêèõ ðàáîò, âûçâàííûé ñîîáùåíèåì î ïîëó÷åíèè íîâîãî âåùåñòâà – ôóëëåðèòà, ñîñòîÿùåãî èç ìîëåêóë óãëåðîäà – ôóëëåðåíîâ. Ñòðóêòóðà ôóëëåðèòà, åãî ñâîéñòâà, ìåòîäû ïîëó÷åíèÿ – âñå ýòè âîïðîñû îêàçàëèñü â ôîêóñå âíèìàíèÿ èññëåäîâàòåëåé. Îòêðûëèñü áîãàòåéøèå âîçìîæíîñòè äëÿ ñîçäàíèÿ íà îñíîâå íîâîãî âåùåñòâà ðàçëè÷íîãî ðîäà ñîåäèíåíèé è ñòðóêòóð ñ íåîáû÷íûìè ôèçèêî-õèìè÷åñêèìè ñâîéñòâàìè.
Ôóëëåðèò ÿâëÿåòñÿ àëëîòðîïíîé ìîäèôèêàöèåé óãëåðîäà. Ïîýòîìó, ïðåæäå ÷åì ïåðåéòè ê ðàññìîòðåíèþ åãî ñòðóêòóðû, ñâîéñòâ è âîçìîæíûõ îáëàñòåé ïðèìåíåíèÿ, âñïîìíèì áëèæàéøèõ “ðîäñòâåííèêîâ” íîâîãî âåùåñòâà – ãðàôèò è àëìàç.
Îäíîé èç êðèñòàëëè÷åñêèõ ìîäèôèêàöèé óãëåðîäà ÿâëÿåòñÿ ãðàôèò. Ýòîò ÷óäåñíûé ìàòåðèàë íàõîäèò øèðî÷àéøåå ïðèìåíåíèå â ñàìûõ ðàçíîîáðàçíûõ ñôåðàõ ÷åëîâå÷åñêîé äåÿòåëüíîñòè – îò èçãîòîâëåíèÿ êàðàíäàøíûõ ãðèôåëåé äî áëîêîâ çàìåäëåíèÿ íåéòðîíîâ â ÿäåðíûõ ðåàêòîðàõ.
Ðàñïîëîæåíèå àòîìîâ óãëåðîäà â êðèñòàëëè÷åñêîé ñòðóêòóðå ãðàôèòà âåñüìà íåîáû÷íî. Îòäåëüíûå àòîìû, ñîåäèíÿÿñü ìåæäó ñîáîé, ôîðìèðóþò øåñòèóãîëüíûå êîëüöà, îáðàçóþùèå ñåòêó, ïîõîæóþ íà ï÷åëèíûå ñîòû [1]. Ìíîæåñòâî òàêèõ ñåòîê ðàñïîëàãàþòñÿ äðóã íàä äðóãîì ñëîÿìè. Ðàññòîÿíèå ìåæäó àòîìàìè, ðàñïîëîæåííûìè â âåðøèíàõ ïðàâèëüíûõ øåñòèóãîëüíèêîâ, ðàâíî 0,142 íì. Ñîñåäíèå àòîìû âíóòðè êàæäîãî ñëîÿ ñâÿçàíû âåñüìà ïðî÷íûìè êîâàëåíòíûìè ñâÿçÿìè, ïîýòîìó ñëîé àòîìîâ, îáðàçóþùèõ ãåêñàãîíàëüíóþ ñåòêó, äîñòàòî÷íî ïðî÷åí è ñòàáèëåí. À âîò ñëîè â ãðàôèòå íàõîäÿòñÿ íà äîâîëüíî ïî÷òèòåëüíîì ðàññòîÿíèè äðóã îò äðóãà: îíî ðàâíî 0,335 íì, ÷òî áîëåå ÷åì â äâà ðàçà ïðåâûøàåò ðàññòîÿíèå ìåæäó óãëåðîäíûìè àòîìàìè â ãåêñàãîíàëüíîé ñåòêå. Áîëüøîå ðàññòîÿíèå ìåæäó ñëîÿìè îïðåäåëÿåò ñëàáîñòü ñèë, ñâÿçûâàþùèõ ñëîè. Òàêàÿ ñòðóêòóðà – ïðî÷íûå ñëîè, ñëàáî ñâÿçàííûå ìåæäó ñîáîé – îïðåäåëÿåò ñïåöèôè÷åñêèå ñâîéñòâà ãðàôèòà: íèçêóþ òâåðäîñòü è ñïîñîáíîñòü ëåãêî ðàññëàèâàòüñÿ íà ìåëü÷àéøèå ÷åøóéêè.
Äðóãîé êðèñòàëëè÷åñêîé ìîäèôèêàöèåé óãëåðîäà ÿâëÿåòñÿ àëìàç – âåùåñòâî ñîâåðøåííî óíèêàëüíîå. Êàæäûé àòîì óãëåðîäà â ñòðóêòóðå àëìàçà ðàñïîëîæåí â öåíòðå òåòðàýäðà, âåðøèíàìè êîòîðîãî ñëóæàò ÷åòûðå áëèæàéøèõ àòîìà. Ñîñåäíèå àòîìû ñâÿçàíû ìåæäó ñîáîé êîâàëåíòíûìè ñâÿçÿìè. Òàêàÿ ñòðóêòóðà îïðåäåëÿåò ñâîéñòâà àëìàçà – ñàìîãî òâåðäîãî âåùåñòâà, èçâåñòíîãî íà Çåìëå.
Èçó÷åíèå ýòèõ äâóõ ôîðì ÷èñòîãî óãëåðîäà èìååò äàâíþþ èñòîðèþ.  ðàçíîå âðåìÿ âûäàþùèåñÿ õèìèêè è ìàòåðèàëîâåäû îòêðûëè è äðóãèå ôîðìû óãëåðîäà, òàêèå, êàê àìîðôíûé óãëåðîä, êàðáèí, áåëûé óãëåðîä è ò. ä. Îäíàêî âñå ýòè ôîðìû ÿâëÿþòñÿ êîìïîçèòàìè, òî åñòü ñìåñüþ ìàëûõ ôðàãìåíòîâ ãðàôèòà è àëìàçà. Äî ïîñëåäíåãî âðåìåíè ñ÷èòàëîñü, ÷òî ñóùåñòâóþò òîëüêî äâà ñïîñîáà ðàñïîëîæåíèÿ àòîìîâ óãëåðîäà â ïðîñòðàíñòâå, ïîçâîëÿþùèõ ïîëó÷èòü êðèñòàëëè÷åñêóþ ôîðìó óãëåðîäà. Òàêîå ïîëîæåíèå ñëåäóåò ñ÷èòàòü âåñüìà óäèâèòåëüíûì.  ñàìîì äåëå, â íàñòîÿùåå âðåìÿ èçâåñòíî ñâûøå ìèëëèîíà ñîåäèíåíèé óãëåðîäà ñ äðóãèìè ýëåìåíòàìè. Èõ èçó÷åíèå ñîñòàâëÿåò ïðåäìåò îãðîìíîãî ðàçäåëà íàóêè – îðãàíè÷åñêîé õèìèè.  òî æå âðåìÿ èññëåäîâàíèÿ â îáëàñòè õèìèè ÷èñòîãî óãëåðîäà íà÷àëèñü ñðàâíèòåëüíî íåäàâíî.  ïîñëåäíèå 10 ëåò ôóíäàìåíòàëüíûå èññëåäîâàíèÿ îçíàìåíîâàëèñü âûäàþùèìèñÿ óñïåõàìè â ïîëó÷åíèè ïðèíöèïèàëüíî íîâîé òðåòüåé ôîðìû ÷èñòîãî óãëåðîäà, î êîòîðîé ïîéäåò ðå÷ü íèæå.
ÔÓËËÅÐÅÍÛ – ÌÎËÅÊÓËßÐÍÀß ÔÎÐÌÀ ÓÃËÅÐÎÄÀ
Íîâàÿ ôîðìà óãëåðîäà ÿâëÿåòñÿ íîâîé ïî ñóùåñòâó [2].  ïðîòèâîïîëîæíîñòü ïåðâûì äâóì, ãðàôèòó è àëìàçó, ñòðóêòóðà êîòîðûõ ïðåäñòàâëÿåò ñîáîé ïåðèîäè÷åñêóþ ðåøåòêó àòîìîâ, òðåòüÿ ôîðìà ÷èñòîãî óãëåðîäà ÿâëÿåòñÿ ìîëåêóëÿðíîé. Ýòî îçíà÷àåò, ÷òî ìèíèìàëüíûì ýëåìåíòîì åå ñòðóêòóðû ÿâëÿåòñÿ íå àòîì, à ìîëåêóëà óãëåðîäà. Äà êàêàÿ ìîëåêóëà! Îêàçûâàåòñÿ, ìîëåêóëû ÷èñòîãî óãëåðîäà ïðåäñòàâëÿþò ñîáîé çàìêíóòóþ ïîâåðõíîñòü, èìåþùóþ ôîðìó ñôåðû èëè ñôåðîèäà. Òàêèå ìîëåêóëû íàçâàëè ôóëëåðåíàìè â ÷åñòü àìåðèêàíñêîãî èçîáðåòàòåëÿ è àðõèòåêòîðà Ðè÷àðäà Áàêìèíñòåðà Ôóëëåðà, ïîëó÷èâøåãî â 1954 ãîäó ïàòåíò íà ñòðîèòåëüíûå êîíñòðóêöèè â âèäå øåñòèóãîëüíèêîâ è ïÿòèóãîëüíèêîâ, ñîñòàâëÿþùèõ ïîëóñôåðó èëè ïîëóñôåðîèä, êîòîðûå ìîæíî èñïîëüçîâàòü â êà÷åñòâå êðûø áîëüøèõ çäàíèé (öèðêè, âûñòàâî÷íûå ïàâèëüîíû è äð.).
Áîëüøîé èíòåðåñ ê ìîëåêóëÿðíîìó óãëåðîäó âîçíèê â 1985 ãîäó, êîãäà áûëà îòêðûòà 60-àòîìíàÿ ìîëåêóëà C60 . Êðîìå òîãî, áûëè îáíàðóæåíû ìîëåêóëû C70 , C76 , C84 è ò. ä. Âñå îíè èìåþò ôîðìó çàìêíóòîé ïîâåðõíîñòè, íà êîòîðîé ðàñïîëàãàþòñÿ àòîìû óãëåðîäà.
Îñíîâíûì ýëåìåíòîì ñòðóêòóðû ôóëëåðåíîâ ÿâëÿåòñÿ øåñòèóãîëüíèê, â âåðøèíàõ êîòîðîãî ðàñïîëîæåíû àòîìû óãëåðîäà. Êàê ìû âèäåëè ðàíåå, ïîäîáíûå øåñòèóãîëüíèêè òàêæå õàðàêòåðíû äëÿ ñòðóêòóðû ãðàôèòà. Èñõîäÿ èç ýòîãî, ëîãè÷íî ïðåäïîëîæèòü, ÷òî ãðàôèò äîëæåí èñïîëüçîâàòüñÿ êàê èñõîäíîå ñûðüå äëÿ ñèíòåçà ôóëëåðåíîâ. Òàê è ïðîèñõîäèò íà ñàìîì äåëå.  íàñòîÿùåå âðåìÿ òâåðäî óñòàíîâëåíî, ÷òî íàèáîëåå ýôôåêòèâíûì ñïîñîáîì ïîëó÷åíèÿ ôóëëåðåíîâ ÿâëÿåòñÿ òåðìè÷åñêîå ðàçëîæåíèå ñëîèñòîé ñòðóêòóðû ãðàôèòà íà ìàëûå ôðàãìåíòû, èç êîòîðûõ çàòåì ïðîèñõîäèò ôîðìèðîâàíèå C60 è äðóãèõ çàìêíóòûõ ìîëåêóë óãëåðîäà.
Åñëè ñ÷èòàòü, ÷òî ìîëåêóëà C60 ñîñòàâëåíà òîëüêî èç øåñòèóãîëüíûõ ôðàãìåíòîâ ãðàôèòà, òî åå ðàäèóñ äîëæåí áûòü ðàâåí 0,37 íì. Íà ñàìîì æå äåëå òî÷íîå çíà÷åíèå ðàäèóñà C60 , óñòàíîâëåííîå ðåíòãåíîñòðóêòóðíûì àíàëèçîì, ñîñòàâëÿåò 0,357 íì. Ýòà âåëè÷èíà âñåãî íà 2% îòëè÷àåòñÿ îò ðàññ÷èòàííîé. Ðàçëè÷èå â ðàäèóñàõ ñâÿçàíî ñ òåì, ÷òî àòîìû óãëåðîäà ðàñïîëàãàþòñÿ íà ñôåðè÷åñêîé ïîâåðõíîñòè â âåðøèíàõ 20 ïðàâèëüíûõ øåñòèóãîëüíèêîâ, óíàñëåäîâàííûõ îò ãðàôèòà, è 12 ïðàâèëüíûõ ïÿòèóãîëüíèêîâ, âîçíèêøèõ â ïðîöåññå ôîðìèðîâàíèÿ C60 . Ìîæíî ïîêàçàòü, ÷òî èç ïðàâèëüíûõ øåñòèóãîëüíèêîâ ëåãêî âûêëàäûâàåòñÿ ïëîñêàÿ ïîâåðõíîñòü, îäíàêî èìè íå ìîæåò áûòü âûëîæåíà ïîâåðõíîñòü çàìêíóòàÿ: ÷àñòü øåñòèóãîëüíûõ êîëåö íåîáõîäèìî ðàçðåçàòü, ÷òîáû èç ðàçðåçàííûõ ÷àñòåé ñôîðìèðîâàëèñü ïÿòèóãîëüíèêè. Òî÷íî òàêèì æå îáðàçîì øüåòñÿ ôóòáîëüíûé ìÿ÷. Åãî ïîêðûøêà òàêæå ñîñòîèò (è â ýòîì ëåãêî óáåäèòüñÿ) èç ïÿòè- è øåñòèóãîëüíûõ ëîñêóòêîâ êîæè, îáðàçóþùèõ ñôåðè÷åñêóþ ïîâåðõíîñòü.
Òàêèì îáðàçîì, ñòðóêòóðíûå ýëåìåíòû ôóëëåðåíîâ ïîäîáíû ñòðóêòóðíûì ýëåìåíòàì ãðàôèòà. Ïëîñêàÿ ñåòêà øåñòèóãîëüíèêîâ (â ñëó÷àå ãðàôèòà) ñâåðíóòà è ñøèòà â çàìêíóòóþ ñôåðó èëè ñôåðîèä. Ïðè ýòîì ÷àñòü øåñòèóãîëüíèêîâ ïðåîáðàçóåòñÿ â ïÿòèóãîëüíèêè.
ÏÎËÓ×ÅÍÈÅ ÔÓËËÅÐÅÍÎÂ È ÔÓËËÅÐÈÒÀ
Óñòàíîâêà äëÿ ïîëó÷åíèÿ ôóëëåðåíîâ ïóòåì òåðìè÷åñêîãî èñïàðåíèÿ ãðàôèòà. Ýòîò ñïîñîá áûë ðàçðàáîòàí â 1990 ãîäó [3].  êà÷åñòâå ñûðüÿ èñïîëüçóþò öèëèíäðè÷åñêèå ñòåðæíè ñïåêòðàëüíî ÷èñòîãî ãðàôèòà, èìåþùèå äèàìåòð îò 1 äî 6 ìì. Çàòî÷åííûå êîíöû ñòåðæíåé ñîåäèíÿþò, è ÷åðåç íèõ ïðîïóñêàþò òîê 150 – 200 À. Ìîæíî èñïîëüçîâàòü êàê ïîñòîÿííûé, òàê è ïåðåìåííûé òîê. Ïðè ïðîïóñêàíèè òîêà â ìåñòå êîíòàêòà âîçíèêàåò ýëåêòðè÷åñêàÿ äóãà è íà÷èíàåòñÿ èñïàðåíèå ãðàôèòà. Íàãðåâ äîëæåí áûòü óìåðåííûì, ÷òîáû îò ñòåðæíåé îòäåëÿëèñü íå îòäåëüíûå àòîìû óãëåðîäà, à öåëûå ôðàãìåíòû ñëîåâ ãðàôèòà, ñîñòîÿùèå èç óãëåðîäíûõ øåñòèóãîëüíèêîâ. Èñïàðåííûé ãðàôèò îñàæäàåòñÿ íà ñòåíêàõ êàìåðû â âèäå ñàæè.
Îïèñàííûé ïðîöåññ îñóùåñòâëÿåòñÿ â êàìåðå, â êîòîðîé ïðåäâàðèòåëüíî ñîçäàåòñÿ âàêóóì ïîðÿäêà 10- 6 Òîðð. Çàòåì êàìåðó çàïîëíÿþò ãàçîì ãåëèåì. Ñ÷èòàåòñÿ, ÷òî àòîìû ãåëèÿ ñïîñîáíû ýôôåêòèâíî îòíèìàòü èçáûòî÷íóþ ýíåðãèþ ó ôðàãìåíòîâ ãðàôèòà, ïîêèíóâøèõ çîíó ýëåêòðè÷åñêîé äóãè. Êðîìå òîãî, ãåëèé óíîñèò ýíåðãèþ, âûäåëÿþùóþñÿ ïðè îáúåäèíåíèè ôðàãìåíòîâ â ìîëåêóëû ôóëëåðåíîâ. Îïòèìàëüíîå äàâëåíèå ãåëèÿ â êàìåðå ïðè èñïàðåíèè ãðàôèòà íàõîäèòñÿ â ïðåäåëàõ 50 – 100 Òîðð. Øåñòèóãîëüíûå ôðàãìåíòû ãðàôèòà, îõëàæäåííûå â ãàçîîáðàçíîì ãåëèè, ñëóæàò “êèðïè÷èêàìè” äëÿ ïîñòðîåíèÿ ìîëåêóë C60 è C70 .
×òîáû âûäåëèòü ÷èñòûå ôóëëåðåíû, îñåâøóþ íà ñòåíêàõ èñïàðèòåëüíîé êàìåðû ñàæó ðàñòâîðÿþò â ìåòèëáåíçîëå (òîëóîëå). Ïðè ýòîì ôóëëåðåíû ïåðåõîäÿò â ðàñòâîð, à íåïðîðåàãèðîâàâøèå ôðàãìåíòû ãðàôèòà âûïàäàþò â îñàäîê. Îòäåëåíèå îñàäêà ìîæåò áûòü ïðîèçâåäåíî îäíèì èç òðåõ ïóòåé: ôèëüòðàöèåé, âðàùåíèåì ðàñòâîðà â öåíòðèôóãå, ýêñòðàêöèåé ïðè ïîìîùè ïðèáîðà Ñîêñëåòà.  ðåçóëüòàòå ïîëó÷àþò æèäêîñòü öâåòà êðàñíîãî âèíà, êîòîðàÿ çàòåì ïîìåùàåòñÿ â èñïàðèòåëü. Òîëóîë èñïàðÿåòñÿ, à ôóëëåðåíû âûïàäàþò íà äíî è ñòåíêè ñîñóäà â âèäå ÷åðíîé ïóäðû, ìàññà êîòîðîé ñîñòàâëÿåò îêîëî 10% îò ìàññû èñõîäíîé ãðàôèòîâîé ñàæè.  ñîñòàâ ïóäðû âõîäÿò ìîëåêóëû C60 è C70 â ñîîòíîøåíèè 85 : 15. Äëÿ ðàçäåëåíèÿ ýòèõ ôóëëåðåíîâ èñïîëüçóåòñÿ æèäêîñòíàÿ êîëîíî÷íàÿ õðîìàòîãðàôèÿ, òðåáóþùàÿ áîëüøîãî êîëè÷åñòâà ðàñòâîðèòåëåé. Öâåò ÷èñòîãî C60 â ðàñòâîðå – êðàñíûé àíèëèíîâûé, òîãäà êàê öâåò ðàñòâîðà C70 – îðàíæåâûé.
Ïðè âûïàðèâàíèè ðàñòâîðà ÷èñòîãî C60 îáðàçóåòñÿ íîâîå êðèñòàëëè÷åñêîå âåùåñòâî, êîòîðîå ïîëó÷èëî íàçâàíèå “ôóëëåðèò”. Âïåðâûå òâåðäûé ôóëëåðèò íàáëþäàëè Êðå÷ìåð è Õóôôìàí â ìàå 1990 ãîäà â îäíîé èç ëàáîðàòîðèé Èíñòèòóòà ÿäåðíîé ôèçèêè â ã. Ãåéäåëüáåðãå (Ãåðìàíèÿ). Ôóëëåðèò ÿâëÿåòñÿ òðåòüåé ôîðìîé
Источник
Сохраните:
Ответы и задания для тренировочных вариантов ХИ2010101, ХИ2010102, ХИ2010103, ХИ2010104 тренировочная работа №1 ЕГЭ 2021 статград по химии 11 класс. Официальная дата проведения работы: 28.09.2020 (28 сентября 2020 год).
Ссылка для скачивания вариантов (ХИ2010101-ХИ2010102): скачать задания
Ссылка для скачивания вариантов (ХИ2010103-ХИ2010104): скачать задания
Ссылка для скачивания ответов и критериев для вариантов: скачать ответы
Решать тренировочные варианты ХИ2010101-ХИ2010102 ЕГЭ 2021 по химии 11 класс:
Решать тренировочные варианты ХИ2010103-ХИ2010104 ЕГЭ 2021 по химии 11 класс:
Вариант ХИ2010101:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Be, 2) P, 3) Cl, 4) Co, 5) S. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите, какие из указанных элементов имеют в основном состоянии три неспаренных электрона. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 24
2)Из приведённого списка выберите три элемента, которые образуют летучие водородные соединения, и расположите их в порядке усиления кислотных свойств водородного соединения. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 253
3)Из приведённого списка выберите два элемента, которые в оксидах и гидроксидах проявляют степень окисления +2. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 14
4)Из предложенного перечня выберите два вещества ионного строения, в которых есть ковалентные связи. 1) BaO2 2) MgO 3) CaF2 4) NaOH 5) N2O4
Ответ: 14
6)Из предложенного списка выберите два вещества, которые реагируют с кислородом при нагревании. 1) медь 2) золото 3) фосфор 4) хлор 5) аргон Запишите номера выбранных ответов.
Ответ: 13
7)В двух колбах находился раствор хлорида железа (III). В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выпал бурый осадок, а во второй выпал осадок и выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) NaOH
- 2) H2SO4
- 3) AgNO3
- 4) Na2CO3
- 5) KBr
Ответ: 1431
10)Задана следующая схема превращений веществ: P2O5 X, t fi P 2 Y, H O fi PH3 Определите, какие из указанных веществ являются веществами X и Y. 1) KOH 2) H2SO4 3) C 4) SiO2 5) NH3
12)Из предложенного перечня выберите два вещества, в составе которых есть атом(-ы) углерода в sp2-гибридном состоянии. 1) бутин-1 2) полиэтилен 3) циклогексан 4) муравьиная кислота 5) изопропилбензол
Ответ: 45
13)Из предложенного перечня выберите два вещества, из которых в лаборатории в одну стадию можно получить толуол. 1) C2H4 2) C6H5Cl 3) C6H5CH=CH2 4) C6H5COOK 5) C6H5CH2COOK
Ответ: 25
14)Из предложенного перечня выберите два вещества, с каждым из которых реагирует пропанол-2, но не реагирует пропионовая кислота. 1) [Ag(NH3)2]OH 2) Na 3) HCl 4) Cu(OH)2 5) KMnO4
Ответ: 35
15)Из предложенного перечня выберите два вещества, которые могут образоваться при гидролизе белков. 1) глицин 2) глицерин 3) серилаланин 4) анилин 5) адипиновая кислота
Ответ: 13
19)Из предложенного перечня выберите все реакции, для осуществления которых требуется катализатор.
- 1) взаимодействие оксида азота(II) с кислородом
- 2) бромирование бензола
- 3) взаимодействие этанола с уксусной кислотой
- 4) взаимодействие фенола с бромной водой
- 5) окисление сернистого газа кислородом
Ответ: 235
20)Из предложенного перечня выберите все реакции, скорость которых возрастает с увеличением давления водорода.
- 1) C3H6 + H2 fi C3H8
- 2) H2 + Cl2 fi 2HCl
- 3) Zn + 2HCl fi ZnCl2 + H2
- 4) C6H14 fi C6H6 + 4H2
- 5) CO + 2H2 fi CH3OH
27)Массовая доля хлорида натрия в насыщенном растворе при 20 оС равна 26,5 %. Сколько граммов хлорида натрия надо растворить в 200 г воды, чтобы получить насыщенный раствор? Ответ запишите с точностью до целых.
28)Чтобы вскипятить чайник, требуется 315,2 кДж теплоты. Сколько граммов угля надо сжечь, чтобы получить такое количество теплоты? Примите, что уголь – это чистый углерод. Термохимическое уравнение сгорания углерода имеет вид C + O2 = CO2 + 394 кДж. Ответ округлите до десятых.
29)При растворении ртути в азотной кислоте выделилось 4,48 л (в пересчёте на н. у.) оксида азота(IV). Сколько граммов азотной кислоты израсходовано? Считайте NO2 единственным газообразным продуктом. Ответ приведите с точностью до десятых.
Для выполнения заданий 30 и 31 используйте следующий перечень веществ: соляная кислота, хлорид железа(III), сероводород, сульфид цинка, гидроксид кальция, медь. Допустимо использование водных растворов веществ.
30)Из предложенного перечня выберите вещества, между которыми возможна окислительно-восстановительная реакция, приводящая к образованию двух солей, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31)Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
32)Цинк растворили в разбавленной серной кислоте. К полученному раствору добавили раствор карбоната натрия, при этом выпал белый осадок и выделился газ. Осадок отфильтровали и прокалили. Газ, образовавшийся при прокаливании, пропустили через известковую воду и наблюдали её помутнение. Напишите уравнения четырёх реакций, соответствующих описанным превращениям.
34)Смесь порошков алюминия и серы общей массой 25 г нагрели. После окончания реакции к полученной смеси добавили 150 г 36,5 %-й соляной кислоты, при этом осталось 2,5 г нерастворившегося вещества. Рассчитайте массовые доли простых веществ в исходной смеси и массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
35)При сжигании 4,0 г органической кислоты образовалось 3,92 л (н. у.) углекислого газа и 2,7 г воды. При сплавлении натриевой соли этой кислоты со щёлочью образуется углеводород, хлорирование которого на свету даёт только одно монохлорпроизводное. Определите молекулярную формулу кислоты и установите её структуру. Напишите уравнение взаимодействия её соли с гидроксидом натрия.
Вариант ХИ2010102:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Ca, 2) S, 3) Br, 4) Cu, 5) N. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите, какие из указанных элементов имеют в основном состоянии один неспаренный электрон. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 34
2)Из приведённого списка выберите три элемента, которые образуют летучие водородные соединения, и расположите их в порядке ослабления кислотных свойств водородного соединения. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 325
3)Из приведённого списка выберите два элемента, которые в соединениях могут иметь степень окисления –2. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 25
4)Из предложенного перечня выберите два вещества атомного строения, в которых есть ковалентные неполярные связи. 1) SiO2 2) H2O2 3) Si 4) C(алмаз) 5) Сl2
Ответ: 34
5)Из предложенного списка выберите два вещества, которые реагируют с водородом при нагревании. 1) медь 2) хлор 3) литий 4) кремний 5) неон
Ответ: 134
7)В двух колбах находился раствор сульфита калия. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ, а раствор остался прозрачным. Во второй колбе выделился газ и выпал осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) CaCl2
- 2) AlCl3
- 3) KOH
- 4) H2SO4
- 5) AgNO3
Ответ: 4243
10)Задана следующая схема превращений веществ: SO2 X fi S Y fi H2SO4 Определите, какие из указанных веществ являются веществами X и Y. 1) KOH 2) KMnO4 3) HNO3 4) H2S 5) H2O
12)Из предложенного перечня выберите два вещества, в составе которых есть атом(-ы) углерода в sp3-гибридном состоянии. 1) ацетилен 2) бутадиен-1,3 3) бутен-2 4) щавелевая кислота 5) толуол Запишите номера выбранных ответов.
Ответ: 35
13)Из предложенного перечня выберите два вещества, из которых в лаборатории в одну стадию можно получить циклогексан. 1) C2H2 2) C6H6 3) CH3CH=CH2 4) Br(CH2)6Br 5) HOOC(CH2)4COOH
Ответ: 24
14)Из предложенного перечня выберите два вещества, с каждым из которых реагирует муравьиная кислота, но не реагирует этанол. 1) Na 2) NaHCO3 3) Br2(H2O) 4) Cu 5) KMnO4
Ответ: 23
15)Из предложенного перечня выберите два вещества, которые могут образоваться при гидролизе природных полисахаридов. 1) сахароза 2) мальтоза 3) дезоксирибоза 4) целлобиоза 5) фруктоза
Ответ: 24
19)Из предложенного перечня выберите все гетерогенные реакции. 1) взаимодействие диоксида марганца с соляной кислотой 2) взаимодействие оксида азота(II) с кислородом 3) взаимодействие водорода с серой 4) нейтрализация известковой воды соляной кислотой 5) взаимодействие лития с водой
Ответ: 135
20)Из предложенного перечня выберите все реакции, скорость которых возрастает с увеличением давления хлора. 1) MnO2 + 4HCl fi MnCl2 + Cl2 + H2O 2) H2 + Cl2 fi 2HCl 3) 2P + 5Cl2 fi 2PCl5 4) CO + Cl2 fi COCl2 5) CaCl2 + 2H2O fi H2 + Cl2 + Ca(OH)2
27)Массовая доля нитрата серебра в насыщенном растворе при 25 оС равна 71,4 %. Сколько граммов нитрата серебра надо растворить в 20 г воды, чтобы получить насыщенный раствор? Ответ запишите с точностью до целых.
28)Чтобы нагреть воздух в двухкомнатной квартире на один градус, требуется 250 кДж теплоты. Сколько литров метана (н. у.) надо сжечь, чтобы получить такое количество теплоты? Термохимическое уравнение сгорания метана имеет вид CH4 + 2O2 = CO2 + 2H2O + 800 кДж. Ответ округлите до целых.
29)При растворении меди в азотной кислоте выделилось 2,8 л (н. у.) оксида азота(II). Сколько граммов азотной кислоты израсходовано? Считайте NO единственным газообразным продуктом. Ответ приведите с точностью до десятых.
Для выполнения заданий 30 и 31 используйте следующий перечень веществ: фосфор, карбонат натрия, аммиачная вода, силикат кальция, азотная кислота, хлорид железа(III). Допустимо использование водных растворов веществ.
30)Из предложенного перечня выберите вещества, между которыми возможна окислительно-восстановительная реакция, сопровождающаяся выделением газа, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31)Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
32)Зелёный порошок, образовавшийся при разложении дихромата аммония, смешали с порошком угля, взятым в избытке, и нагрели в атмосфере хлора. Полученное вещество растворили в воде и добавили избыток щёлочи. Через образовавшийся раствор пропускали хлор до тех пор, пока раствор не приобрёл жёлтую окраску. Напишите уравнения четырёх реакций, соответствующих описанным превращениям.
33)Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: пропен fi X1 KOH(спирт.р-р) fi пропин C, t fi X2 fi X3 fi бензол При написании уравнений реакций используйте структурные формулы органических веществ.
34)Смесь порошков алюминия и углерода общей массой 25 г прокалили в электрической печи. После окончания реакции к полученной смеси добавили 365 г 20%-й соляной кислоты, при этом осталось 3,4 г нерастворившегося вещества. Рассчитайте массовые доли простых веществ в исходной смеси и массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
35)При сжигании 3,65 г органической кислоты образовалось 3,36 л (н. у.) углекислого газа и 2,25 г воды. При сплавлении калиевой средней соли этой кислоты с гидроксидом калия образуется углеводород разветвлённого строения. Определите молекулярную формулу кислоты и установите её структуру, если известно, что в её молекуле только один третичный атом углерода. Напишите уравнение взаимодействия соли кислоты со щёлочью.
Химия 11 класс тренировочные варианты ХИ1910501-ХИ1910504:
14.05.2020 Химия 11 класс варианты ХИ1910501-ХИ1910504 ответы и задания
Тренировочные варианты статград по химии 11 класс ЕГЭ 2021:
СтатГрад
Источник
