Какое свойство в водороде

Атомная масса – 1 а.е.м. Молекула водорода двухатомна – Н2.
Электронная конфигурация атома водорода – 1s1. Водород относится к семейству s-элементов. В своих соединениях проявляет степени окисления -1, 0,
+1. Природный водород состоит из двух стабильных изотопов – протия 1Н (99,98%) и дейтерия 2Н (D) (0,015%) – и радиоактивного изотопа трития 3Н (Т) (следовые количества, период полураспада – 12,5 лет).
Химические свойства водорода
При обычных условиях молекулярный водород проявляет сравнительно низкую реакционную способность, что объясняется высокой прочностью связей в молекуле. При нагревании вступает во взаимодействие практически со всеми простыми веществами, образованными элементами главных подгрупп (кроме благородных газов, B, Si,
P, Al). В химических реакциях может выступать как в роли восстановителя (чаще), так и окислителя (реже).
Водород проявляет свойства восстановителя (Н20 -2е → 2Н+) в следующих реакциях:
1. Реакции взаимодействия с простыми веществами – неметаллами. Водород реагирует с галогенами, причем, реакция взаимодействия со фтором при обычных условиях, в темноте, со взрывом, с хлором – при освещении (или УФ-облучении) по цепному механизму, с бромом и йодом только при нагревании; кислородом (смесь кислорода и водорода в объемном отношении 2:1 называют «гремучим газом»), серой, азотом и углеродом:
H2 + Hal2 = 2HHal;
2H2 + O2 = 2H2O + Q (t);
H2 + S = H2S (t = 150 – 300C);
3H2 + N2 ↔ 2NH3 (t = 500C, p, kat = Fe, Pt);
2H2 + C ↔ CH4 (t, p, kat).
2. Реакции взаимодействия со сложными веществами. Водород реагирует с оксидами малоактивных металлов, причем он способен восстанавливать только металлы, стоящие в ряду активности правее цинка:
CuO + H2 = Cu + H2O (t);
Fe2O3 + 3H2 = 2Fe + 3H2O (t);
WO3 + 3H2 = W + 3H2O (t).
Водород реагирует с оксидами неметаллов:
H2 + CO2 ↔ CO + H2O (t);
2H2 + CO ↔ CH3OH (t = 300C, p = 250 – 300 атм., kat = ZnO, Cr2O3).
Водород вступает в реакции гидрирования с органическими соединениями класса циклоалканов, алкенов, аренов, альдегидов и кетонов и др. Все эти реакции проводят при нагревании, под давлением, в качестве катализаторов используют платину или никель:
CH2 = CH2 + H2 ↔ CH3-CH3;
C6H6 + 3H2 ↔ C6H12;
C3H6 + H2 ↔ C3H8;
CH3CHO + H2 ↔ CH3-CH2-OH;
CH3-CO-CH3 + H2 ↔ CH3-CH(OH)-CH3.
Водород в качестве окислителя (Н2 +2е → 2Н—) выступает в реакциях взаимодействия со щелочными и щелочноземельными металлами. При этом образуются гидриды – кристаллические ионные соединения, в которых водород проявляет степень окисления -1.
2Na +H2 ↔ 2NaH (t, p).
Ca + H2 ↔ CaH2 (t, p).
Физические свойства водорода
Водород – легкий бесцветный газ, без запаха, плотность при н.у. – 0,09 г/л, в 14,5 раз легче воздуха, tкип = -252,8С, tпл = — 259,2С. Водород плохо растворим в воде и органически растворителях, хорошо растворим в некоторых металлах: никеле, палладии, платине.
По данным современной космохимии водород является самым распространенным элементом Вселенной. Основная форма существования водорода в космическом пространстве – отдельные атомы. По распространенности на Земле водород занимает 9 место среди всех элементов. Основное количество водорода на Земле находится в связанном состоянии – в составе воды, нефти, природного газа, каменного угля и т.д. В виде простого вещества водород встречается редко – в составе вулканических газов.
Получение водорода
Различают лабораторные и промышленные способы получения водорода. К лабораторным способам относят взаимодействие металлов с кислотами (1), а также взаимодействие алюминия с водными растворами щелочей (2). Среди промышленных способов получения водорода большую роль играют электролиз водных растворов щелочей и солей (3) и конверсия метана (4):
Zn + 2HCl = ZnCl2 + H2↑ (1);
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] +3 H2↑ (2);
2NaCl + 2H2O = H2↑ + Cl2↑ + 2NaOH (3);
CH4 + H2O ↔ CO + H2 (4).
Примеры решения задач
Источник
Если кислород является самым распространенным химическим элементом на Земле, то водород – самый распространенный элемент во всей Вселенной. Наше Солнце (и другие звезды) примерно на половину состоит из водорода, а что касается межзвездного газа, то он на 90% состоит из атомов водорода. Немалое место этот химический элемент занимает и на Земле, ведь вместе с кислородом он входит в состав воды, а само его название «водород» происходит от двух древнегреческих слов: «вода» и «рожаю». Помимо воды водород присутствует в большинстве органических веществ и клеток, без него, как и без кислорода, была бы немыслима сама Жизнь.
История открытия водорода
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Водород в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы водорода
Водород это газ, молекула его состоит из двух атомов.
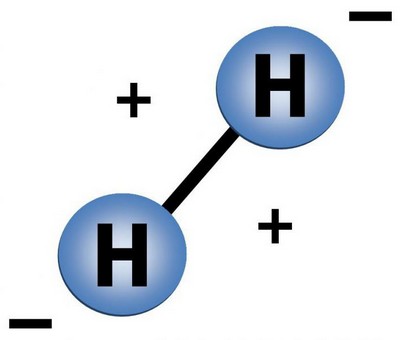
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства водорода
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства водорода
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить водород?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Применение водорода
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Водород, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Каждый химический элемент в периодической системе имеет свое определенное место положения, которое отражает проявляемые им свойства и говорит о его электронном строении. Однако есть среди всех один особый атом, который занимает сразу две ячейки. Он располагается в двух совершенно противоположных по проявляемым свойствам группах элементов. Это водород. Такие особенности делают его уникальным.
Водород – это не просто элемент, но и простое вещество, а также составная часть многих сложных соединений, биогенный и органогенный элемент. Поэтому рассмотрим его характеристики и свойства подробнее.

Водород как химический элемент
Водород – это элемент первой группы главной подгруппы, а также седьмой группы главной подгруппы в первом малом периоде. Данный период состоит всего из двух атомов: гелия и рассматриваемого нами элемента. Опишем основные особенности положения водорода в периодической системе.
- Порядковый номер водорода – 1, количество электронов такое же, соответственно, протонов столько же. Атомная масса – 1,00795. Существует три изотопа данного элемента с массовыми числами 1, 2, 3. Однако свойства каждого из них очень сильно различаются, так как увеличение массы даже на единицу именно для водорода является сразу двойным.
- То, что на внешнем энергетическом уровне он содержит всего один электрон, позволяет успешно проявлять ему как окислительные, так и восстановительные свойства. Кроме того, после отдачи электрона у него остается свободная орбиталь, которая принимает участие в образовании химических связей по донорно-акцепторному механизму.
- Водород – это сильный восстановитель. Поэтому основным местом его считается первая группа главной подгруппы, где он возглавляет самые активные металлы – щелочные.
- Однако при взаимодействии с сильными восстановителями, такими как, например, металлы, он может быть и окислителем, принимая электрон. Данные соединения получили название гидридов. По этому признаку он возглавляет подгруппу галогенов, с которыми является схожим.
- Благодаря совсем маленькой атомной массе, водород считается самым легким элементом. Кроме того, его плотность также очень мала, поэтому он также является эталоном легкости.
Таким образом, очевидно, что атом водорода – это совершенно уникальный, непохожий на все остальные элемент. Следовательно, свойства его тоже особенные, а образуемые простые и сложные вещества очень важны. Рассмотрим их далее.
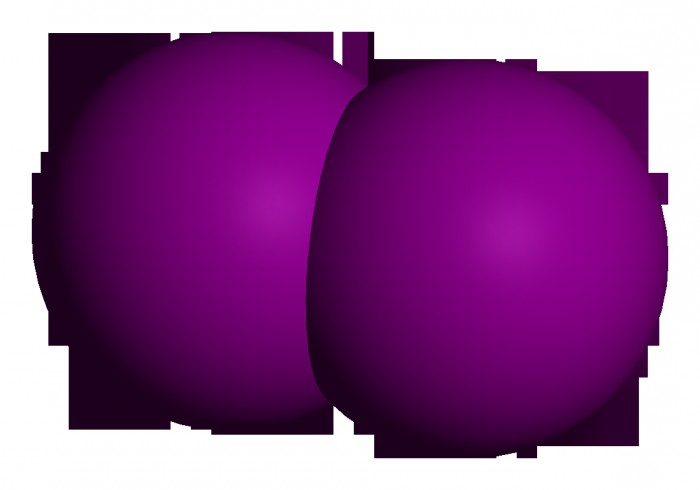
Простое вещество
Если говорить о данном элементе как о молекуле, то нужно сказать, что она двухатомна. То есть водород (простое вещество) – это газ. Формула его эмпирическая будет записываться как Н2, а графическая – через одинарную сигма-связь Н-Н. Механизм образования связи между атомами – ковалентный неполярный.
Еще Генри Кавендиш в 1766 году сумел открыть данное вещество. Именно он и доказал, что водород – это газ, причем такой, который способен взрываться на воздухе. Позже были хорошо изучены свойства, стало ясно, что данное вещество – самое легкое среди известных.
Еще позже Лавуазье дал название (как элементу, так и веществу на его основе) на латыни – hydrogenium, что в переводе означает “рождающий воду”. В 1781 году первооткрыватель данного элемента Генри Кавендиш доказал, что вода – сочетание водорода и кислорода, то есть это продукт их взаимодействия. А о том, что легкий газ еще и очень горючий, было известно еще в XVI веке, это отражалось в записях Парацельса.
Таким образом, молекулярный водород – это очень распространенное в природе и образующееся естественным путем газообразное соединение, состоящее из двух атомов, которое способно взрываться на воздухе. Кроме того, молекула может распадаться на атомы, которые принимают участие в ядерных реакциях, превращаясь в ядра гелия. Данные процессы непрерывно происходят на Солнце и в космосе, которые и являются основными поставщиками данного соединения.
Водород – это вещество, которое способно проявлять себя и как окислитель, и как восстановитель. Также оно находит себе очень широкое применение в деятельности человека.

Физические свойства
Физические параметры водород имеет следующие:
- Температура кипения – (-252,76 0С).
- Температура плавления – (-259,2 0С).
- В обозначенном интервале температур является бесцветной жидкостью, не имеющей запаха.
- При очень высоком давлении существуют снегообразные кристаллы твердого водорода.
- При определенных условиях (высокое давление и низкие температуры) способен переходить в металлическое состояние.
- Практически нерастворим в воде, поэтому возможен сбор методом вытеснения воды при получении в лабораторных условиях.
- При обычных условиях водород – это газ, не имеющий запаха, цвета и вкуса.
- Является горючим и взрывоопасным веществом.
- Хорошо растворяется в металлах, так как способен диффундировать сквозь их толщу.
- Примерно в 14,5 раз данный газ легче воздуха.
Кристаллическая решетка простого вещества молекулярная, связи слабые, поэтому легко разрушаются.
Химические свойства
Как уже говорилось выше, водород способен проявлять как восстановительные, так и окислительные свойства. Возможные степени окисления элемента +1; -1. Поэтому его часто используют в промышленности для синтезов и различных реакций.
Окислительные свойства водорода
- Взаимодействие с активными металлами (щелочными и щелочноземельными) при обычных условиях приводит к образованию солеподобных соединений, называемых гидридами. Например: LiH, CaH2, KH, MgH2 и прочие.
- Соединения с малоактивными металлами под воздействием высоких температур или сильной освещенности (фотохимическая инициация реакций) также образуют гидриды.
Восстановительные свойства водорода
- Взаимодействие при обычных условиях только с фтором (как сильным окислителем). В результате образуется фтороводород или плавиковая кислота HF.
- Взаимодействие практически со всеми неметаллами, но при определенных достаточно жестких условиях. Примеры соединений: H2S, NH3, H2O, PH3, SiH4 и прочие.
- Восстанавливает металлы из их оксидов до простых веществ. Это один из промышленных способов получения металлов, называющийся водородотермией.
Отдельно следует выделить реакции, которые используются в органических синтезах. Они называются гидрированием – насыщением водородом и дегидрированием, то есть его отщеплением от молекулы. На основании этих способов превращений получают множество углеводородов и других органических соединений.
Нахождение в природе
Водород – это самое распространенное вещество на нашей планете и за ее пределами. Ведь практически все межзвездное пространство и звезды состоят именно из этого соединения. В космосе он может существовать в виде:
- плазмы;
- газа;
- ионов;
- атомов;
- молекул.
Существует несколько видов различных по плотности облаков, состоящих именно из этого вещества.
Если говорить о распространении конкретно в земной коре, то водород стоит на втором месте по числу атомов после кислорода, его приблизительно 17%. В свободном виде встречается редко, лишь в незначительных количествах в составе сухого воздуха. Самое распространенное соединение данного элемента – вода. Именно в ее составе он и встречается на планете.
Также водород является обязательной составной частью любого живого организма. Причем в теле человека на долю этого атома приходится 63%. Водород – это органогенный элемент, поэтому формирует молекулы белков, жиров, углеводов и нуклеиновых кислот, а также многих других жизненно важных соединений.

Получение
Существуют разные способы получения рассматриваемого нами газа. К ним относится несколько промышленных и лабораторных вариантов синтеза.
Промышленные способы получения водорода:
- Паровая конверсия метана.
- Газификация угля – процесс подразумевает нагревание угля до 1000 0С, в результате чего образуется водород и высокоуглеродный уголь.
- Электролиз. Данный метод может использоваться только для водных растворов различных солей, так как расплавы не приводят к разряжению воды на катоде.
Лабораторные способы получения водорода:
- Гидролиз гидридов металлов.
- Действие разбавленных кислот на активные металлы и средней активности.
- Взаимодействие щелочных и щелочноземельных металлов с водой.
Чтобы собрать образующийся водород, необходимо держать пробирку перевернутой вверх дном. Ведь данный газ нельзя собрать так, как, например, углекислый газ. Это водород, он намного легче воздуха. Быстро улетучивается, а в больших количествах при смешении с воздухом взрывается. Поэтому и следует переворачивать пробирку. После ее заполнения ее нужно закрыть резиновой пробкой.
Чтобы проверить чистоту собранного водорода, следует поднести к горлышку зажженную спичку. Если хлопок глухой и тихий – значит газ чистый, с минимальными примесями воздуха. Если же громкий и свистящий – грязный, с большой долей посторонних компонентов.

Области использования
При сгорании водорода выделяется настолько большое количество энергии (теплоты), что данный газ считается самым выгодным топливом. К тому же экологически чистым. Однако на сегодняшний день его применение в данной области ограничено. Это связано с непродуманными до конца и не решенными проблемами синтеза чистого водорода, который был бы пригоден для использования в качестве топлива в реакторах, двигателях и портативных устройствах, а также отопительных котлах жилых домов.
Ведь способы получения данного газа достаточно дорогостоящие, поэтому прежде необходимо разработать особый метод синтеза. Такой, который позволит получать продукт в большом объеме и с минимальными затратами.
Можно выделить несколько основных областей, в которых находит применение рассматриваемый нами газ.
- Химические синтезы. На основании гидрирования получают мыла, маргарины, пластмассы. При участии водорода синтезируется метанол и аммиак, а также другие соединения.
- В пищевой промышленности – как добавка Е949.
- Авиационная промышленность (ракетостроение, самолетостроение).
- Электроэнергетика.
- Метеорология.
- Топливо экологически чистого вида.
Очевидно, что водород так же важен, как и распространен в природе. Еще большую роль играют образуемые им различные соединения.

Соединения водорода
Это сложные, содержащие атомы водорода вещества. Можно выделить несколько основных типов подобных веществ.
- Галогеноводороды. Общая формула – HHal. Особое значение среди них имеет хлорид водорода. Это газ, который растворяется в воде с образованием раствора соляной кислоты. Данная кислота находит широкое применение практически во всех химических синтезах. Причем как органических, так и неорганических. Хлорид водорода – это соединение, имеющее эмпирическую формулу HCL и являющееся одним из крупнейших по объемам производства в нашей стране ежегодно. Также к галогеноводородам относятся йодоводород, фтороводород и бромоводород. Все они образуют соответствующие кислоты.
- Летучие водородные соединения неметаллов. Практически все они достаточно ядовитые газы. Например, сероводород, метан, силан, фосфин и прочие. При этом очень горючие.
- Гидриды – соединения с металлами. Относятся к классу солей.
- Гидроксиды: основания, кислоты и амфотерные соединения. В их состав обязательно входят атомы водорода, один или несколько. Пример: NaOH, K2[AL(OH)4], H2SO4 и прочие.
- Гидроксид водорода. Это соединение больше известно как вода. Другое название оксид водорода. Эмпирическая формула выглядит так – Н2О.
- Пероксид водорода. Это сильнейший окислитель, формула которого имеет вид Н2О2.
- Многочисленные органические соединения: углеводороды, белки, жиры, липиды, витамины, гормоны, эфирные масла и прочие.
Очевидно, что разнообразие соединений рассматриваемого нами элемента очень велико. Это еще раз подтверждает его высокое значение для природы и человека, а также для всех живых существ.
Оксид водорода – это лучший растворитель
Как уже упоминалось выше, простонародное название данного вещества – вода. Состоит из двух атомов водорода и одного кислорода, соединенных между собой ковалентными полярными связями. Молекула воды является диполем, это объясняет многие проявляемые ею свойства. В частности то, что она является универсальным растворителем.
Именно в водной среде происходят практически все химические процессы. Внутренние реакции пластического и энергетического обмена в живых организмах также осуществляются с помощью оксида водорода.
Вода по праву считается самым важным веществом на планете. Известно, что без нее не сможет жить ни один живой организм. На Земле она способна существовать в трех агрегатных состояниях:
- жидкость;
- газ (пар);
- твердое (лед).
В зависимости от изотопа водорода, входящего в состав молекулы, различают три вида воды.
- Легкая или протиевая. Изотоп с массовым числом 1. Формула – Н2О. Это привычная форма, которую используют все организмы.
- Дейтериевая или тяжелая, ее формула – D2O. Содержит изотоп 2Н.
- Сверхтяжелая или тритиевая. Формула выглядит как Т3О, изотоп – 3Н.
Очень важны запасы пресной протиевой воды на планете. Уже сейчас во многих странах ощущается ее недостаток. Разрабатываются способы обработки соленой воды с целью получения питьевой.
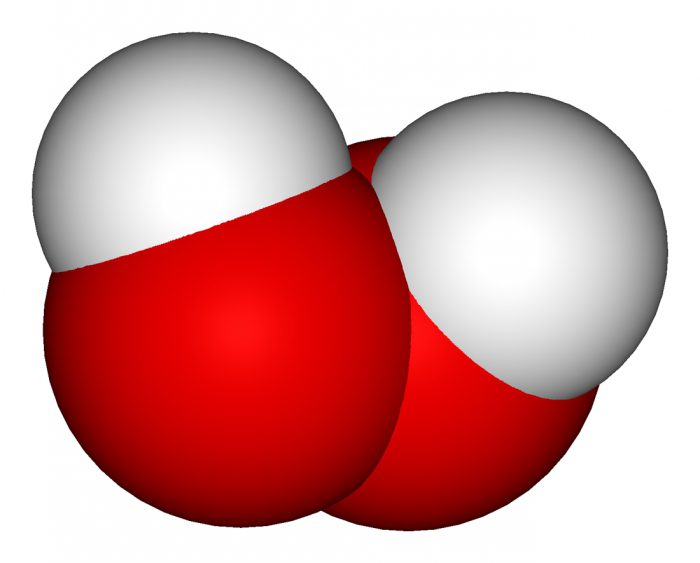
Пероксид водорода – это универсальное средство
Данное соединение, как уже упоминалось выше, прекрасный окислитель. Однако с сильными представителями может вести себя и как восстановитель тоже. Кроме того, обладает выраженным бактерицидным эффектом.
Другое название данного соединения – перекись. Именно в таком виде его используют в медицине. 3% раствор кристаллогидрата рассматриваемого соединения – это медицинское лекарство, которое применяют для обработки небольших ран с целью их обеззараживания. Однако доказано, что при этом заживление ранения по времени увеличивается.
Также пероксид водорода используется в ракетном топливе, в промышленности для дезинфекции и отбеливания, в качестве пенообразователя для получения соответствующих материалов (пенопласта, например). Кроме того, перекись помогает очищать аквариумы, обесцвечивать волосы и отбеливать зубы. Однако при этом наносит вред тканям, поэтому специалистами в этих целях не рекомендуется.
Источник
