Какое свойство углерода подчеркивает своеобразие

Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия углерода
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Углерод в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома углерода
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
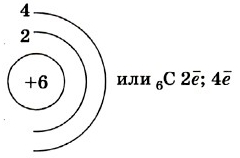
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства углерода
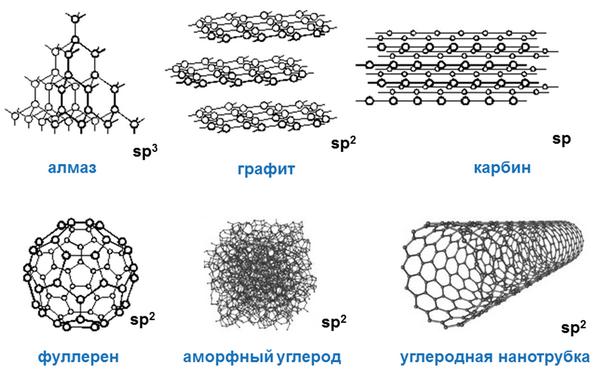
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства углерода
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
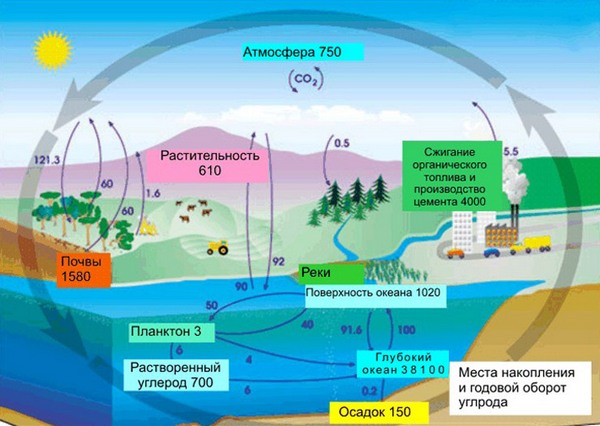
Углерод в природе
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
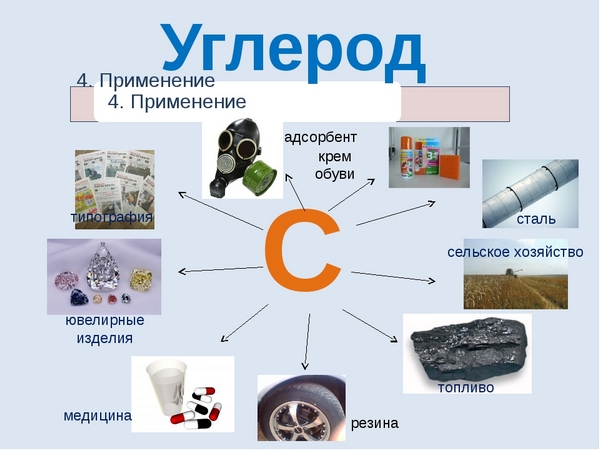
Применение углерода
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Рекомендованная литература и полезные ссылки
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
Углерод, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Органическая химия
Углерод. Особенности строения. Свойства.
Строение углерода
Углерод является шестым элементом периодической системы Менделеева. Его атомный вес равен 12.
Углерод находится во втором периоде системы Менделеева и в четвёртой группе этой системы.
Номер периода сообщает нам, что шесть электронов углерода располагаются на двух энергетических уровнях.
А четвёртый номер группы говорит, что на внешнем энергетическом уровне у углерода находится четыре электрона. Два из них это спаренные s-электроны, а два другие – не спаренные р-электроны.
Структура внешнего электронного слоя атома углерода может быть выражена следующими схемами:

Каждая ячейка вэтих схемах означает отдельную электронную орбиталь, стрелка – элетрон, находящийся на орбитали. Две стрелки внутри одной ячейки – это два электрона, находящиеся на одной орбитали, но имеющие противоположно направленные спины.
При возбуждении атома (при сообщени ему энергии) один из спаренных S-электронов занимает р-орбиталь.
Возбуждённый атом углерода может учавствовать в образовании четырёх ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет валентность, равную четырем.
Так, простейшее органическое соединение углеводород метан имеет состав СН4. Строение его может быть выражено структурной или электронной формулами:

Электронная формула показывает, что атом углерода в молекуле метана имеет устойчивую восьмиэлектронную внешнюю оболочку, а атомы водорода – устойчивую двухэлектронную оболочку.
Все четыре ковалентных связи углерода в метане (и в других подобных соединениях) равноценны и симметрично направлены в пространстве.
Атом углерода находится как бы в центре тетраэдра (правильной четырёхугольной пирамиды), а четыре соединённых с ним атома (в случае метана – четыре атома водорода) в вершинах тетраэдра.
Углы между направлениями любой пары связей одинаковы и составляют 109 градусов 28 минут.
Это объясняется тем, что в атоме углерода, когда он образует ковалентные связи с четырьмя другими атомами, из одной s– и трёх p-орбиталей в результате sp3-гибридизации образуются чтыре симметрично расположенные в пространстве гибридные sp3-орбитали, вытянутые в направлении к вершинам тетраэдра.

Особенность свойств углерода.
Количество электронов на внешнем энергетическом уровне является главным фактором, определяющим химические свойства элемента.
В левой части периодической системы расположены элементы с малозаполненным внешним электронным уровнем. У элементов первой группы на внешнем уровне один электрон, у элементов второй группы – два.
Элементы этих двух групп являются металлами. Они легко окисляются, т.е. теряют свои внешние электроны ипревращаются в положительные ионы.
В правой части периодической системы, наоборот, находятся неметаллы (окислители). В сравнении с металлами они обладают ядром с большим числом протонов. Такое массивное ядро обеспечивает гораздо более сильное притяжение своего электронного облака.
Такие элементы с большим трудом теряют свои электроны, зато непрочь присоединить к себе дополнительные электроны других атомов, т.е. окислить их, а самим, при этом, превратиться в отрицательный ион.
Металлические свойства элементов по мере возрастания номера группы в периодической системе ослабляются, а их способность окислять другие элементы увеличивается.
Углерод находится в четвёртой группе, т.е. как раз посередине между металлами, легко отдающими электроны, и неметаллами, легко эти электроны присоединяющими.
По этой причине углерод не обладает ярко выраженной склонности отдавать или присоединять электроны.
Углеродные цепи.
Исключительным свойством углерода, обуславливающим многообразие органических соединений, является способность его атомов соединяться прочными ковалентными связями друг с другом, образуя углеродные схемы практически неограниченной длины.

Кроме углерода, цепи из одинаковых атомов образует его аналог из IV группы – кремний. Однако такие цепи содержат не более шести атомов Si. Известны длинные цепи из атомов серы, но содержащие их соединения непрочны.
Валентности атомов углерода, не задействованные для взаимного соединения, используются на присоединение других атомов или групп (в углеводородах – для присоединения водорода).
Так углеводороды этан (С2Н6) и пропан (С3Н8) содержат цепи соответственно из двух и трёх атомов углерода. Строение их выражают следующие структурные и электронные формулы:

Известны соединения, содержащие в цепях сотни и более атомов углерода.
Вследствии тетраэдрической направленности связей углерода, его атомы, входящие в цепь, располагаются не на прямой, а зигзагообразно. Причём, благодаря возможности вращения атомов вокруг оси связи, цепь в пространстве может принимать различные формы (конформации):

Такая структура цепей даёт возможность сближаться концевым или другим не смежным атомам углерода. В результате возникновения связи между этими атомами углеродные цепи могут замыкаться в кольца (циклы), например:

Таким образом, многообразие органических соединений определяется и тем, что при одинаковом числе атомов углерода в молекуле возможны соединения с открытой незамкнутой цепью углеродных атомов, а также вещества, молекулы которых содержат циклы.
Простые и кратные связи.
Ковалентные связи между атомами углерода, образованные одной парой обобщённых электронов, называются простыми связями.

Связь между атомами углерода может осуществляться не одной, а двумя или тремя общими парами электронов. Тогда получаются цепи с кратными – двойными или тройными связями. Эти связи можно изобразить следующим образом:
Простейшие соединения, содержащие кратные связи – углеводороды этилен (с двойной связью) и ацетилен (с тройной связью):

Углеводороды с кратными связями называются непредельными или ненасыщенными. Этилен и ацетилен – первые представители двух гомологических рядов – этиленовых и ацетиленовых углеводородов.
Источник
5. в чем уникальность строения атома углерода и почему он так распространен в соединениях. Почему нашу жизнь иногда называют углеродной.
С точки зрения химии жизнь — это всевозможные превращения разнообразных крупных и сложных молекул, главным элементом которых является углерод. Он важен не с точки зрения распространенности на Земле, в земной коре углерода всего 0,055 %, в то время как кислорода 60,50 %, кремния 20,45 % и даже титана 0,27 %. В атмосфере двуокиси углерода 0,03 %, т. е. углерода всего 0,008 %. Все биологически функциональные вещества, кроме нескольких солей и воды, содержат углерод. Это белки, жиры, углеводы, гормоны, витамины. Число соединений углерода огромно. Они называются органическими соединениями, поскольку когда-то считалось, что такие молекулы могут образовываться только в живых организмах.
Органическая химия посвящена изучению углерода и его соединений. Атомный номер углерода — 6, его ядро содержит шесть протонов и шесть нейтронов, вокруг ядра вращаются шесть электронов, масса атома С равна 12. При химических реакциях углерод способен присоединить 4 электрона и образовать устойчивую оболочку из восьми электронов, т. е. имеет валентность, равную четырем, и способен к прочной ковалентной (присоединением электронов) связи. Например, эмпирическая формула одного из таких прочных соединений — метана — СН4, а в структурном изображении — это тетраэдр (четыре симметричные связи углерода).
Уникальным свойством углерода является его способность образовывать стабильные цепи и кольца, которые обеспечивают разнообразие органических соединений, причем эти связи могут быть кратными. При этом важно расположение атомов в пространстве, которое приводит к оптической активности вещества, к отличию в повороте плоскости поляризации проходящего света (рис. 1). Структурные формулы наглядно отражают связь формулы со свойствами вещества, с их помощью стало возможным объяснение изомерии и предсказание свойств неизвестных еще соединений.

Рис. 1. Способы соединения атомов углерода друг с другом Черточки со свободными концами при каждом атоме углерода показывают, что он может образовывать связи с атомами других элементов (обычно это водород, кислород, азот, сера)
Зная валентность углерода, можно достаточно просто изобразить положение всех недостающих водородных атомов, что позволяет сосредоточить внимание на наиболее важных связях и химических группах. Такие прочные ковалентные связи углерод может образовывать и с атомами других элементов (Н, О, Р, N, S), и с углеродными (С-С связь). Внутреннее отличие органики от большинства неорганических соединений выражается в том, что химические связи, как правило, в органических соединениях валентные, а ионные связи — очень редки. Поэтому углерод обладает этими уникальными свойствами, среди которых еще не отмечена способность соединений углерода к полимеризации и поликонденсации, а наша жизнь называется углеродной.
6. Преобразования энергии и круговорот веществ в природе. Чем они отличаются и что между ними общего.
Биосфера представляет из себя единство живого и минеральных элементов, вовлеченных в сферу жизни. Она распределена по земной поверхности крайне неравномерно и в различных природных условиях принимает вид относительно независимых комплексов — биогеоценозов (или экосистем). Живая часть биогеоценоза — биоценоз – состоит из популяций организмов разных видов.
Одним из самых больших достижений науки в XX в. является выяснение механизмов превращения энергии в биологических системах Сейчас уже понятно, как солнечная энергия преобразуется в специальных пигментных структурах растений в энергию химических связей, как превращаются вещества в процессах брожения и гликолиза (окисление углеводов без кислорода), как происходит внутриклеточное дыхание — перенос электронов в митохондриях от коферментов к кислороду. В центре этих превращений в клетке находится АТФ, которая синтезируется из АДФ и Н3РО4 за счет световой энергии или энергии, выделяемой при гликолизе, брожении или дыхании. При гликолизе АТФ выделяется энергия, необходимая для совершения всей работы живого организма — от создания градиентов концентрации ионов и сокращения мышц до синтеза белка.
Биосфера улавливает лишь небольшую часть солнечной энергии, поступающей на Землю. Ультрафиолетовая часть солнечного излучения, которая составляет 30 % всей солнечной энергии, доходящей до Земли, практически полностью задерживается атмосферой. Половина поступающей энергии превращается в тепло и затем излучается в космическое пространство, 20% расходуется на испарение воды и образование облаков и только около 0,02 % используется биосферой. Зеленые растения усваивают эту энергию, поглощая молекул».) хлорофилла, и процессе фотосинтеза преобразуют ее и запасают и форме сахарен. От этого процесса зависит нее существование биосферы.
Животные, поедая растения, а хищники — травоядных животных, освобождают для себя эту энергию, сжигая сахара и другие питательные вещества при помощи кислорода. Переработка пищи в организмах сопровождается выделением энергии, при этом часть ее запасается в форме химической энергии и используется для совершения работы. В отличие от простейших существ, у которых сжигание веществ может происходить в любой части организма, высшие животные обладают специальной системой, распределяющей по организму кислород и энергоносители. В легких кровь поглощает кислород и выделяет углекислый газ, в кишечнике она получает питательные вещества. Процессы переваривания пищи обеспечивают разложение сложных компонентов пищи на более простые, которые усваиваются кишечником и поступают в кровь, при этом высвобождается энергия. Конечные продукты обмена веществ (избыток солей, воды, чужеродные и токсичные соединения) поступают через почки в мочу и выводятся из организма.
Животные не получают необходимую им энергию непосредственно от Солнца. Для добывания пищи им нужна сенсорная система ее обнаружения (глаза, уши, нос или сонар — ультразвуковой локатор, иные органы) и мускульная система, приводящая в движение их органы (руки, ноги, плавники, крылья и т.д.). Кроме того, у растений и животных имеются регулирующие системы — железы, выделяющие гормоны, и нервная система. В организме постоянно совершается работа: перекачивается кровь, поглощаются питательные вещества, происходят процессы возбуждения молекул, в которых запасается энергия, выводятся отходы жизнедеятельности и вредные вещества и т. д. Для создания упорядоченных систем (высокого уровня генетической или нервной организации) тоже необходима энергия. Эффективное функционирование всех систем обеспечивается также информацией о внешнем и внутреннем окружении. Работа состоит в выработке сигналов, которые регулируют энергетические процессы, организуют биоструктуры, контролируют расход энергии на разные раздражители и т. п.
Удовлетворение энергетических потребностей организмов происходит в рамках равновесия, которое устанавливается между различными организмами данной среды обитания (экосистемы). Среди обитателей обычно выделяют два типа организмов: одни способны непосредственно использовать солнечную энергию и перерабатывать
в пищу вещества из неживой окружающей среды (автотрофы), другие зависят от остальных производителей энергии, т. е. сами не производят необходимую им пищу {гетеротрофы). Все элементы, из которых построены организмы, многократно используются в биосфере, тем более, что масса всего живого, когда-либо заселявшего Землю, много больше массы самой Земли. Обмен энергии в биосфере отличается от круговорота веществ в ней. Частично энергия рассеивается при переходе от продуцентов (зеленых растений) к травоядным, а затем и к плотоядным животным (редуцентам), поэтому необходима постоянная подпитка биосферы солнечной энергией.
Основу биосферы составляет биотический круговорот органических веществ при участии всех населяющих ее организмов. В закономерностях этого круговорота решена проблема развития и длительного существования жизни. Мы не говорим “бесконечного”, потому что все на земле имеет конец: сама Земля представляет собой ограниченное тело, конечен запас минеральных элементов и т. д. “Единственный способ придать ограниченному количеству свойство бесконечного, — писал академик В. Р. Вильяме, — это заставить его вращаться по замкнутой кривой. Зеленые растения создают органическое вещество, незеленые разрушают его. Из минеральных соединений, полученных из распада органического вещества, новые зеленые растения строят новое органическое вещество и так без конца”.
Жизнь на Земле идет именно таким путем. Каждый вид — это только звено в биотическом круговороте. Непрерывность жизни обеспечивается процессами синтеза и распада, каждый организм отдает или выделяет то, что используют другие организмы. Особенно велика в этом круговороте роль микроорганизмов, которые превращают остатки животных и растений в минеральные соли и простейшие органические соединения, вновь используемые зелеными растениями для синтеза новых органических веществ. При разрушении сложных органических соединений высвобождается энергия, теряется информация, свойственная сложно организованным существам. Любая форма жизни участвует в биотическом круговороте, и на нем основана саморегуляция биосферы. Микроорганизмы при этом играют двоякую роль: они быстро приспосабливаются к разным условиям жизни и могут использовать различные субстраты в качестве источника углерода и энергии. Высшие организмы не обладают такими способностями и потому располагаются выше одноклеточных в экологической пирамиде, опираясь на них, как на фундамент.
Биотический круговорот состоит из разных круговоротов, причем каждый биоценоз представляет модель биосферы в миниатюре. Важны и исторические факторы формирования биоценоза, и климат, и ландшафт, и многое другое. Например, экосистема леса включает биоценозы различных типов лесов — хвойные, лиственные, тропические, каждый из которых характеризуется своим круговоротом веществ. В этом мне кажется проявляется отличие биотического круговорота от круговорота энергии, второе отличие: по закону сохранения энергии энергия не возникает ниоткуда и не уходит в никуда, т.е. преобразование энергии вечно (именно в данном круговороте энергии), а круговорот веществ в природе имеет свое окончание, как уже было сказано выше.
Раздел: Естествознание
Количество знаков с пробелами: 47732
Количество таблиц: 0
Количество изображений: 1
… сущность теории химической эволюции и биогенеза. Опишите историю открытия и изучения клетки.
Зав. кафедрой
————————————————–
Экзаменационный
билет по предмету
КОНЦЕПЦИИ
СОВРЕМЕННОГО
ЕСТЕСТВОЗНАНИЯ
Билет № 30 Назовите и охарактеризуйте междисциплинарные естественные науки. Сформулируйте третий закон механического движения Ньютона. Каким …
… вещей (»арден 1987: 53-68, Назаретян 1991: 60, Абдеев 1994: 150- 160). Атрибутивная концепция информации – информация как мера упорядоченности структур и их взаимодействий на всех стадиях организации материи (Абдеев 1994: 162). Одна из самых сложных проблем современного естествознания – функционирование отражения в неживом мире (существует ли в неживом мире опосредующее звено между …
… , или концепция биогенеза). В XIX веке ее окончательно опроверг Л. Пастер, доказав, что появление жизни там, где она не существовала, связано с бактериями (пастеризация – избавление от бактерий). 3. Концепция современного состояния предполагает, что Земля и жизнь на ней существовали всегда, причем в неизменном виде. 4. Концепция панспермии связывает появление жизни на Земле с ее занесением из …
… галактик и Вселенной. Материальные системы микро-, макро- и мегамира различаются между собой размерами, характером доминирующих процессов и законами, которым они подчиняются. Важнейшая концепция современного естествознания заключается в материальном единстве всех систем микро-, макро- и мегамира. Можно говорить о единой материальной основе происхождения всех материальных систем на разных стадиях …
Источник
