Какое свойство принципиально отличает аморфные тела от кристаллов

Существует несколько агрегатных состояний, в которых находятся все тела и вещества. Это:
- газ;
- жидкость;
- плазма;
- твердое.
Если рассматривать общую совокупность планеты и космоса, то большая часть веществ и тел все же находится в состоянии газа и плазмы. Однако на самой Земле существенно и содержание твердых частиц. Вот о них мы и поговорим, выяснив, чем являются кристаллические и аморфные твердые тела.
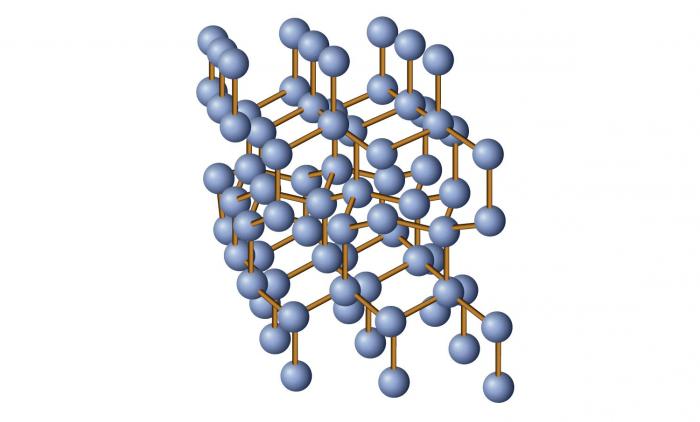
Кристаллические и аморфные тела: общее понятие
Все твердые вещества, тела, предметы условно подразделяются на:
- кристаллические;
- аморфные.
Разница между ними огромная, ведь в основе подразделения лежат признаки строения и проявляемых свойств. Если говорить кратко, то твердыми кристаллическими именуются те вещества и тела, которые имеют определенный тип пространственной кристаллической решетки, то есть обладают способностью изменяться в определенном направлении, но не во всех (анизотропия).
Если же характеризовать аморфные соединения, то первый их признак – способность менять физические характеристики по всем направлениям одновременно. Это называется изотропией.
Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует.

Свойства твердых тел
Кристаллические и аморфные тела тем не менее относятся к единой группе твердых, а значит, обладают всеми характеристиками данного агрегатного состояния. То есть общими свойствами для них будут следующие:
- Механические – упругость, твердость, способность к деформации.
- Тепловые – температуры кипения и плавления, коэффициент теплового расширения.
- Электрические и магнитные – проводимость тепловая и электрическая.
Таким образом, рассматриваемые нами состояния обладают всеми данными характеристиками. Только проявляться у аморфных тел они будут несколько иначе, нежели у кристаллических.
Важными свойствами для промышленных целей являются механические и электрические. Способность восстанавливаться после деформации или, напротив, крошиться и измельчаться – важная особенность. Также большую роль играет тот факт, может вещество проводить электрический ток либо не способно к этому.

Строение кристаллов
Если описывать строение кристаллических и аморфных тел, то в первую очередь следует указать тип частиц, которые их слагают. В случае кристаллов это могут быть ионы, атомы, атом-ионы (в металлах), молекулы (редко).
Вообще данные структуры характеризуются наличием строго упорядоченной пространственной решетки, которая формируется в результате расположения образующих вещество частиц. Если представить строение кристалла образно, то получится примерно такая картина: атомы (или другие частицы) располагаются друг от друга на определенных расстояниях так, чтобы в результате получилась идеальная элементарная ячейка будущей кристаллической решетки. Затем данная ячейка многократно повторяется, и так складывается общая структура.
Главной особенностью является то, что физические свойства в подобных структурах изменяются в параллелях, но не во всех направлениях. Называется подобное явление анизотропией. То есть если воздействовать на одну часть кристалла, то вторая сторона может не реагировать на это. Так, можно измельчить половину кусочка поваренной соли, однако вторая останется целой.
Типы кристаллов
Принято обозначать два варианта кристаллов. Первый – это монокристаллические структуры, то есть когда сама решетка 1. Кристаллические и аморфные тела в этом случае совсем различны по свойствам. Ведь для монокристалла характерна анизотропия в чистом виде. Он представляет собой самую маленькую структуру, элементарную.
Если же монокристаллы повторяются многократно и соединяются в одно целое, тогда речь идет о поликристалле. Тогда речь об анизотропии не идет, так как ориентация элементарных ячеек нарушает общую упорядоченную структуру. В этом отношении поликристаллы и аморфные тела близки друг другу по проявляемым физическим свойствам.

Металлы и их сплавы
Кристаллические и аморфные тела очень близки друг другу. В этом легко убедиться, взяв в качестве примера металлы и их сплавы. Сами по себе они при обычных условиях твердые вещества. Однако при определенной температуре начинают плавиться и, пока не произойдет полная кристаллизация, будут оставаться в состоянии тянущейся, густой, вязкой массы. А это уже и есть аморфное состояние тела.
Поэтому, строго говоря, практически каждое кристаллическое вещество может при определенных условиях стать аморфным. Так же, как и последнее при кристаллизации становится твердым веществом с упорядоченной пространственной структурой.
Металлы могут иметь разные типы пространственных структур, самыми известными и изученными из которых являются следующие:
- Простая кубическая.
- Гранецентрированная.
- Объемоцентрированная.
В основе структуры кристалла может лежать призма или пирамида, а ее главная часть представлена:
- треугольником;
- параллелограммом;
- квадратом;
- шестиугольником.
Идеальными свойствами изотропии обладает вещество, имеющее простую правильную кубическую решетку.

Понятие об аморфности
Кристаллические и аморфные тела внешне различить достаточно просто. Ведь последние часто можно перепутать с вязкими жидкостями. В основе структуры аморфного вещества также лежат ионы, атомы, молекулы. Однако они не образуют упорядоченной строгой структуры, а потому и свойства их изменяются во всех направлениях. То есть они изотропны.
Частицы располагаются хаотично, беспорядочно. Лишь иногда они могут образовывать небольшие локусы, что все равно не влияет на общие проявляемые свойства.
Свойства подобных тел
Они идентичны таковым у кристаллов. Различия лишь в показателях для каждого конкретного тела. Так, например, можно выделить такие характеристические параметры аморфных тел:
- упругость;
- плотность;
- вязкость;
- тягучесть;
- проводимость и полупроводимость.
Часто можно встретить граничные состояния соединений. Кристаллические и аморфные тела могут переходить в состояние полуаморфности.
Также интересна та черта рассматриваемого состояния, которая проявляется при резком внешнем воздействии. Так, если аморфное тело подвергнуть резкому удару или деформации, то оно способно повести себя как поликристалл и расколоться на мелкие кусочки. Однако если дать этим частям время, то вскоре они снова соединятся вместе и перейдут в вязкое текучее состояние.

У данного состояния соединений нет определенной температуры, при которой происходит фазовый переход. Этот процесс сильно растянут, иногда даже на десятки лет (например, разложение полиэтилена низкого давления).
Примеры аморфных веществ
Можно привести много примеров подобных веществ. Обозначим несколько самых наглядных и часто встречаемых.
- Шоколад – типичное аморфное вещество.
- Смолы, в том числе фенолформальдегидные, все пластики.
- Янтарь.
- Стекло любого состава.
- Битум.
- Гудрон.
- Воск и другие.
Аморфное тело образуется в результате очень медленной кристаллизации, то есть повышения вязкости раствора при понижении значения температуры. Часто сложно назвать подобные вещества твердыми, их относят скорее к вязким густым жидкостям.
Особое состояние имеют те соединения, которые при затвердевании вообще не кристаллизуются. Их называют стеклами, а состояние – стеклообразным.
Стеклообразные вещества
Свойства кристаллических и аморфных тел схожи, как мы выяснили, вследствие общего происхождения и единой внутренней природы. Но иногда от них отдельно рассматривают особое состояние веществ, именуемое стеклообразным. Это гомогенный минеральный раствор, который кристаллизуется и затвердевает без формирования пространственных решеток. То есть остается изотропным по изменению свойств всегда.
Так, например, обычное оконное стекло не имеет точного значения температуры плавления. Оно просто при повышении данного показателя медленно плавится, размягчается и переходит в жидкое состояние. Если же воздействие прекратить, то пойдет обратный процесс и начнется затвердевание, но без кристаллизации.
Такие вещества очень ценятся, стекло сегодня – один из самых распространенных и востребованных строительных материалов во всем мире.
Источник
В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.

Твердые тела
Все твердые тела обладают следующими общими свойствами:
- Способностью долгое время сохранять форму и объем (геометрические размеры);
- Наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).
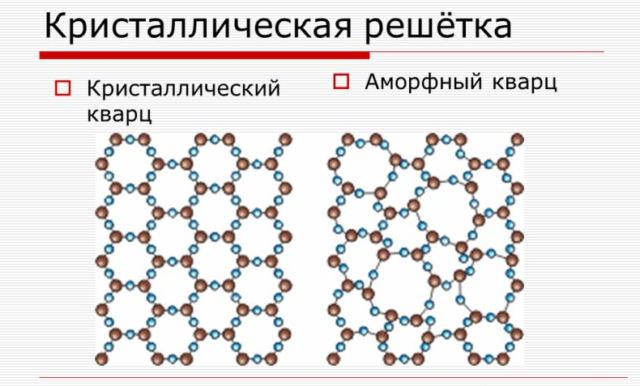
Рис. 1. Примеры решеток кристаллических и аморфных тел – кварц аморфный и кристаллический.
Современные ученые исследуют пространственное расположение атомов и молекул в твердых телах с помощью электронных микроскопов, которые позволяют получить изображение объекта с сильным увеличением (до 106 раз). Первый электронный микроскоп был изобретен в 30-х годах прошлого века. В 2018 г. с помощью последних версий этого прибора было получено разрешение 0,39 ангстрем. Напомним, что 1 ангстрем равен 10-8 см. В большинстве кристаллов это соответствует шагу атомной решетки.
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Отсутствие дальнего порядка в расположении частиц вещества у аморфных тел приводит к тому, что их физические свойства одинаковы во всех направлениях. Такие тела называют изотропными (слово “изотропный” составлено из двух греческих слов: isos — ровный, tropos — направление). Изотропность физических свойств аморфных тел является следствием хаотичного расположения составляющих их молекул и атомов.
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

Рис. 2. Монокристаллы и поликристаллы.
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.

Рис. 3. Графит и алмаз.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Тест по теме
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 266.
Источник
Вы когда-нибудь задумывались о том, что представляют собой загадочные аморфные вещества? По строению они отличаются и от твердых, и от жидких. Дело в том, что такие тела находятся в особом конденсированном состоянии, имеющем только ближний порядок. Примеры аморфных веществ – смола, стекло, янтарь, каучук, полиэтилен, поливинилхлорид (наши любимые пластиковые окна), различные полимеры и другие. Это твердые тела, у которых нет кристаллической решетки. Еще к ним можно отнести сургуч, различные клеи, эбонит и пластмассы.
Необыкновенные свойства аморфных веществ
Во время расщепления в аморфных телах не образуются грани. Частицы совершенно беспорядочны и находятся на близком расстоянии друг к другу. Они могут быть как сильно густыми, так и вязкими. Как на них влияют внешние воздействия? Под влиянием различных температур тела становятся текучими, словно жидкости, и одновременно довольно упругими. В случае, когда внешнее воздействие длится недолго, вещества аморфного строения могут при мощном ударе расколоться на кусочки. Длительное влияние извне приводит к тому, что они просто-напросто текут.

Попробуйте провести дома небольшой эксперимент с применением смолы. Положите ее на твердую поверхность, и вы заметите, что она начинает плавно растекаться. Правильно, ведь это аморфное вещество! Скорость зависит от показателей температуры. Если она будет сильно высокой, то растекаться смола начнет заметно быстрее.
Что еще характерно для таких тел? Они могут принимать любую форму. Если аморфные вещества в виде маленьких частиц поместить в сосуд, например, в кувшин, то они также примут форму сосуда. Еще они являются изотропными, то есть проявляют одинаковые физические свойства по всем направлениям.
Плавление и переход в другие состояния. Металл и стекло
Аморфное состояние вещества не подразумевает поддержания какой-либо определенной температуры. При низких показателях тела застывают, при высоких – плавятся. Кстати, от этого зависит и степень вязкости таких веществ. Низкая температура способствует пониженной вязкости, высокая, наоборот, ее повышает.

Для веществ аморфного типа можно выделить еще одну особенность – переход в кристаллическое состояние, причем самопроизвольный. Почему так происходит? Внутренней энергии в кристаллическом теле намного меньше, чем в аморфном. Мы это можем заметить на примере стеклянной продукции – со временем стекла становятся мутными.
Металлическое стекло – что же это такое? Металл можно избавить от кристаллической решетки в ходе плавления, то есть сделать вещество аморфного строения стеклообразным. Во время застывания при искусственном охлаждении кристаллическая решетка снова образуется. Аморфный металл имеет просто поразительную стойкость к коррозии. Например, сделанный из него кузов автомобиля не нуждался бы в различных покрытиях, так как не подвергался бы самопроизвольному разрушению. Аморфным веществом является такое тело, атомная структура которого обладает невиданной прочностью, а значит, аморфный металл мог бы применяться в совершенно любой промышленной отрасли.
Кристаллическое строение веществ
Чтобы хорошо разбираться в характеристиках металлов и уметь с ними работать, нужно обладать знаниями о кристаллическом строении тех или иных веществ. Производство продукции из металлов и область металлургии не смогли бы получить такое развитие, если бы у людей не было определенных знаний об изменениях в структуре сплавов, технологических приемах и эксплуатационных характеристиках.

Четыре состояния вещества
Общеизвестно, что существует четыре агрегатных состояния: твердое, жидкое, газообразное, плазменное. Твердые аморфные вещества могут быть и кристаллическими. При таком строении может наблюдаться пространственная периодичность в расположении частиц. Эти частицы в кристаллах могут выполнять периодическое движение. Во всех телах, которые мы наблюдаем в газообразном или жидком состоянии, можно заметить движение частиц в виде хаотичного беспорядка. Аморфные твердые вещества (например, металлы в конденсированном состоянии: эбонит, стеклянная продукция, смолы) можно называть жидкостями замороженного типа, потому что у них при изменении формы можно заметить такую характерную черту, как вязкость.
Отличие аморфных тел от газов и жидкостей
Проявления пластичности, упругости, упрочнения при деформации свойственны многим телам. Кристаллические и аморфные вещества в большей степени обладают этими характеристиками, в то время как жидкости и газы не имеют таких свойств. Но зато можно заметить, что они способствуют упругому изменению объема.
Кристаллические и аморфные вещества. Механические и физические свойства
Что собой представляют кристаллические и аморфные вещества? Как уже упоминалось выше, аморфными можно назвать те тела, которые обладают огромным коэффициентом вязкости, и при обыкновенной температуре их текучесть невозможна. А вот высокая температура, наоборот, позволяет, им быть текучими, как жидкость.

Совершенно другими представляются вещества кристаллического типа. Эти твердые тела могут иметь свою температуру плавления, зависящую от внешнего давления. Получение кристаллов возможно, если охладить жидкость. Если не принимать определенных мер, то можно заметить, что в жидком состоянии начинают возникать различные центры кристаллизации. В области, окружающей эти центры, происходит образование твердого вещества. Очень маленькие кристаллики начинают соединяться друг с другом в беспорядочном порядке, и получается так называемый поликристалл. Такое тело является изотропным.
Характеристики веществ
Что определяет физические и механические характеристики тел? Важное значение имеют атомные связи, а также тип кристаллической структуры. Кристаллам ионного типа характерны ионные связи, что означает плавный переход от одних атомов к другим. При этом происходит образование положительно и отрицательно заряженных частиц. Ионную связь мы можем наблюдать на простом примере – такие характеристики свойственны разнообразным оксидам и солям. Еще одна особенность ионных кристаллов – низкая проводимость тепла, но ее показатели могут заметно возрастать при нагревании. В узлах кристаллической решетки можно заметить различные молекулы, которые отличаются крепкой атомной связью.
Множество минералов, которые мы встречаем повсеместно в природе, имеют строение кристаллическое. И аморфное состояние вещества – это тоже природа в чистом виде. Только в этом случае тело представляет собой нечто бесформенное, а вот кристаллы могут принимать формы красивейших многогранников с наличием плоских граней, а также образовывать новые удивительной красоты и чистоты твердые тела.
Что представляют собой кристаллы? Аморфно-кристаллическая структура
Форма таких тел постоянна для определенного соединения. Например, берилл всегда выглядит как шестигранная призма. Проведите небольшой эксперимент. Возьмите небольшой кристаллик поваренной соли кубической формы (шар) и положите его в специальный раствор как можно более насыщенный той же поваренной соли. Со временем вы заметите, что этот тело осталось неизменным – оно снова приобрело форму куба или шара, которая присуща именно кристаллам поваренной соли.

Аморфно-кристаллические вещества – это такие тела, которые могут содержать в себе как аморфные, так и кристаллические фазы. Что влияет на свойства материалов такой структуры? Главным образом различное соотношение объемов и разное расположение по отношению друг к другу. Распространенными примерами таких веществ являются материалы из керамики, фарфора, ситаллы. Из таблицы свойств материалов с аморфно-кристаллической структурой становится известно, что фарфор содержит максимальный процент стеклофазы. Показатели колеблются в пределах 40-60-ти процентов. Самое низкое содержание мы увидим на примере каменного литья – меньше 5-ти процентов. При этом более высокое поглощение воды будет у керамической плитки.
Как известно, такие промышленные материалы, как фарфор, керамическая плитка, каменное литье и ситаллы, – это аморфно-кристаллические вещества, потому что содержат стекловидные фазы и одновременно кристаллы в своем составе. При этом стоит отметить, что свойства материалов не зависят от содержания в нем стеклофаз.
Аморфные металлы
Применение аморфных веществ наиболее активно осуществляется в области медицины. Например, быстро охлажденный металл активно используется в хирургии. Благодаря связанным с ним разработкам многие люди получили возможность самостоятельно передвигаться после тяжелых травм. Все дело в том, что вещество аморфной структуры является отличным биоматериалом для имплантации в кости. Полученные специальные винты, пластины, штыри, булавки внедряют при тяжелых переломах. Раньше в хирургии для таких целей применялись сталь и титан. Лишь позже было замечено, что аморфные вещества очень медленно распадаются в организме, а это удивительное свойство дает возможность восстановиться костным тканям. Впоследствии вещество заменяется костью.
Применение веществ аморфного типа в метрологии и точной механике
Точная механика основана именно на точности, а потому так и называется. Особенно важную роль в данной отрасли, равно как и в метрологии, играют сверхточные показатели приборов измерения, этого позволяет добиться использование в устройствах аморфных тел. Благодаря точным измерениям проводятся лабораторные и научные исследования в институтах в области механики и физики, происходит получение новых препаратов, совершенствование научных знаний.
Полимеры
Еще один пример применения аморфного вещества – это полимеры. Они могут медленно переходить из твердого состояния в жидкость, в то время как кристаллические полимеры характеризуются температурой плавления, а не температурой размягчения. Каково физическое состояние аморфных полимеров? Если предоставить этим веществам низкую температуру, можно заметить, что они будут находиться в стеклообразном состоянии и проявлять свойства твердых тел. Постепенное нагревание способствует тому, что полимеры начинают переходить в состояние повышенной эластичности.
Аморфные вещества, примеры которых мы сейчас приводили, интенсивно используются в промышленности. Сверхэластичное состояние позволяет полимерам как угодно деформироваться, а достигается такое состояние благодаря повышенной гибкости звеньев и молекул. Дальнейшее повышение показателей температуры приводит к тому, что полимер приобретает еще более эластичные свойства. Он начинает переходить в особое текучее и вязкое состояние.
Если оставить ситуацию без контроля и не воспрепятствовать дальнейшему повышению температуры, полимер подвергнется деструкции, то есть разрушению. Вязкое состояние показывает, что все звенья макромолекулы очень подвижны. Когда течет молекула полимера, звенья не только выпрямляются, но и еще и сильно сближаются друг с другом. Межмолекулярное воздействие превращает полимер в жесткое вещество (резину). Такой процесс называют механическим стеклованием. Полученное вещество используют для производства пленок и волокон.
На основе полимеров можно получить полиамиды, полиакрилонитрилы. Чтобы изготовить полимерную пленку, нужно продавить полимеры через фильеры, которые имеют щелевидное отверстие, и нанести на ленту. Таким образом изготавливаются упаковочные материалы и основы для магнитных лент. К полимерам относятся также различные лаки (образующие пенку в органическом растворителе), клеи и другие скрепляющие материалы, композиты (полимерная основа с наполнителем), пластмассы.

Области применения полимеров
Такого вида аморфные вещества прочно внедрились в нашу жизнь. Применяются они повсюду. К ним относят:
1. Различные основы для изготовления лаков, клея, пластмассовых изделий (фенолформальдегидные смолы).
2. Эластомеры или синтетические каучуки.
3. Электроизоляционный материал – поливинилхлорид, или всем известные пластиковые окна из ПВХ. Он устойчив к пожарам, так как считается трудногорючим, обладает повышенной механической прочностью и электроизоляционными свойствами.
4. Полиамид – вещество, обладающее очень высокой прочностью, стойкостью к износу. Ему свойственны высокие диэлектрические характеристики.
5. Плексиглас, или полиметилметакрилат. Его мы можем применять в сфере электротехники или использовать как материал для конструкций.
6. Фторопласт, или политетрафторэтилен, – известный диэлектрик, который не проявляет свойств растворения в растворителях органического происхождения. Обширный диапазон температур и хорошие диэлектрические свойства позволяют применять его как гидрофобный или антифрикционный материал.
7. Полистирол. Этот материал не подвержен воздействию кислот. Он, так же как фторопласт и полиамид, может считаться диэлектриком. Очень прочен в отношении механического воздействия. Полистирол используют повсеместно. Например, он хорошо зарекомендовал себя как конструкционный и электроизоляционный материал. Применяется в электро- и радиотехнике.
8. Наверное, самый известный для нас полимер – это полиэтилен. Материал проявляет устойчивость при воздействии агрессивной среды, он абсолютно не пропускает влагу. Если упаковка выполнена из полиэтилена, можно не бояться, что содержимое испортится под воздействием сильного дождя. Полиэтилен – это тоже диэлектрик. Его применение обширно. Из него изготавливают трубные конструкции, различные электротехнические изделия, изоляционную пленку, оболочки для кабелей телефонных и силовых линий, детали для радио и другой аппаратуры.
9. Полихлорвинил – это высокополимерное вещество. Он является синтетическим и термопластичным. Обладает структурой молекул, которые несимметричны. Почти не пропускает воду и изготавливается путем прессования с помощью штамповки и путем формования. Полихлорвинил применяют чаще всего в электрической промышленности. На его основе создают различные теплоизоляционные шланги и шланги для химической защиты, аккумуляторные банки, изоляционные втулки и прокладки, провода и кабели. Полихлорвинил также является отличной заменой вредному свинцу. Его нельзя применять в качестве высокочастотных цепей в виде диэлектрика. А все из-за того, что в этом случае показатели диэлектрических потерь будут высокими. Обладает высокой проводимостью.
Источник
