Какое свойство отличает монокристалл от аморфного
В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.

Твердые тела
Все твердые тела обладают следующими общими свойствами:
- Способностью долгое время сохранять форму и объем (геометрические размеры);
- Наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).
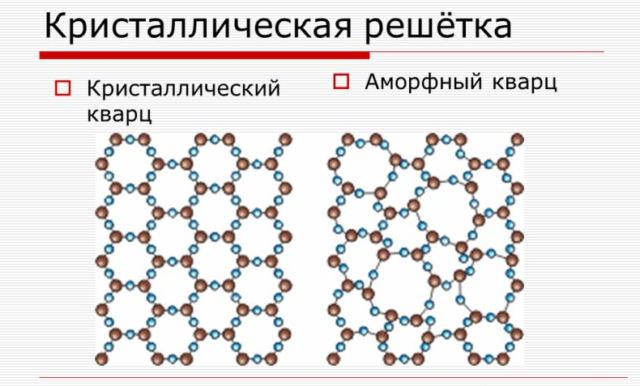
Рис. 1. Примеры решеток кристаллических и аморфных тел – кварц аморфный и кристаллический.
Современные ученые исследуют пространственное расположение атомов и молекул в твердых телах с помощью электронных микроскопов, которые позволяют получить изображение объекта с сильным увеличением (до 106 раз). Первый электронный микроскоп был изобретен в 30-х годах прошлого века. В 2018 г. с помощью последних версий этого прибора было получено разрешение 0,39 ангстрем. Напомним, что 1 ангстрем равен 10-8 см. В большинстве кристаллов это соответствует шагу атомной решетки.
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Отсутствие дальнего порядка в расположении частиц вещества у аморфных тел приводит к тому, что их физические свойства одинаковы во всех направлениях. Такие тела называют изотропными (слово “изотропный” составлено из двух греческих слов: isos — ровный, tropos — направление). Изотропность физических свойств аморфных тел является следствием хаотичного расположения составляющих их молекул и атомов.
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

Рис. 2. Монокристаллы и поликристаллы.
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.

Рис. 3. Графит и алмаз.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Тест по теме
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 263.
Источник
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
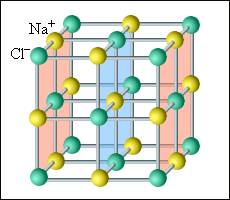
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl (рис. 3.6.1). Такие кристаллы называются ионными.
|
Рисунок 3.6.1. Кристаллическая решетка поваренной соли |
В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах.
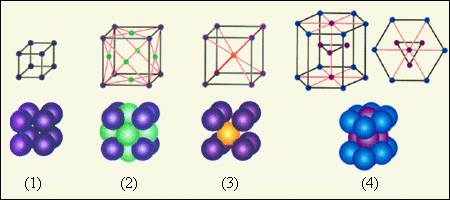
На рис. 3.6.2 приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
|
Рисунок 3.6.2. Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка |
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
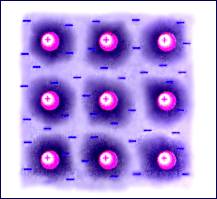
Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. 3.6.3). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.
|
Рисунок 3.6.3. Структура металлического кристалла |
Источник
Твёрдое тело — это агрегатное состояние вещества, характеризующееся стабильностью формы и объема.
По своему внутреннему строению твердые тела разделяются на кристаллические и аморфные.
Кристаллы – это твёрдые тела, частицы которых располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры.
Точнее, частицы колеблются около определенных положений равновесия. Если их мысленно соединить прямыми линиями, то получается своего рода «скелет» кристалла. Такое изображение кристалла называется кристаллической решеткой.
Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных атомов), которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl– (рис. 1). Такие кристаллы называются ионными.
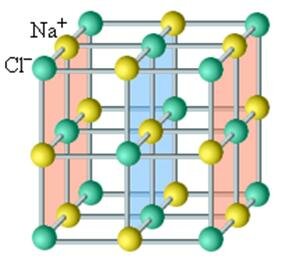
Рис. 1
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно. На рис. 2 приведены примеры простых кристаллических решеток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка.
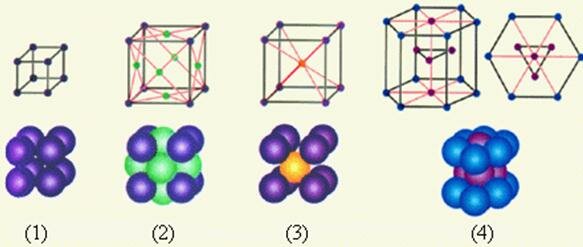
Рис. 2
Монокристаллы и поликристаллы
Если периодически повторяющаяся структура (кристаллическая решетка) распространяется по всему объему тела, то образуется «одиночный кристалл» — монокристалл. Монокристаллы имеют форму правильных симметричных многоугольников. Но они редко достигают размеров в несколько сантиметров. Примерами монокристаллов могут служить драгоценные камни, исландский шпат (рис. 3), топаз (рис. 4).

Рис. 3

Рис. 4
В природе чаще встречаются беспорядочно сросшиеся между собой монокристаллы. Такие твердые тела называются поликристаллы. Примерами поликристаллов являются: каменная соль (рис. 5), кварц (рис. 6), сахар, лед, железо, медь.

Рис. 5

Рис. 6
Анизотропия
Упорядоченность в строении кристалла приводит к анизотропии, т.е. зависимости физических свойств от выбранного направления. Оно объясняется различием в плотности расположения частиц в кристаллической решетке по разным направлениям. На рисунке 7 условно изображено расположение атомов в одной из плоскостей монокристалла. Через узлы этой плоской решетки проведены различно ориентированные параллельные прямые (1, 2, 3, 4). Видно, что на единицу длины прямых приходится не одинаковое количество атомов. А многие механические свойства кристалла зависят от плотности размещения образующих его частиц.
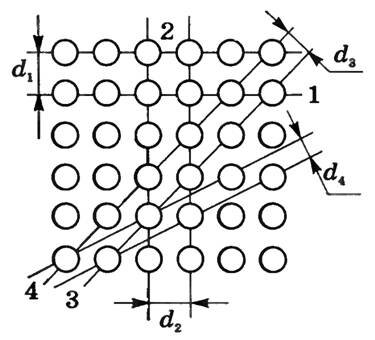
Рис. 7
Прежде всего, бросается в глаза различная механическая прочность кристаллов по разным направлениям. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Так же легко расслаивается в одном направлении кристалл графита. Когда вы пишете карандашом, такое расслоение происходит непрерывно и тонкие слои графита остаются на бумаге. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл алмаза по-разному преломляет свет в зависимости от направления падающих на него лучей.
Монокристаллы обладают анизотропией, поликристаллы изотропны.
Температура плавления
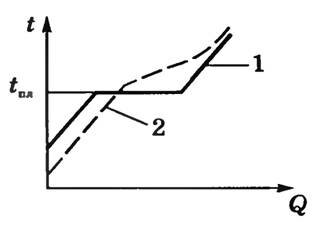
Кристаллические тела имеют определенную температуру плавления tпл, не изменяющуюся в процессе плавления при постоянном давлении (рис. 8, кривая 1).

Рис. 8
Зная температуру плавления и температуру тела, всегда можно определить в каком агрегатном состоянии будет находиться кристаллическое тело: если температура тела больше температуры плавления, то тело в жидком состоянии, если меньше – в твердом.
Полиморфизм
Практически все вещества в твердом состоянии могут существовать в двух или более кристаллических разновидностях (модификациях), отличающихся физическими свойствами. Это явление называется полиморфизмом. Так, у углерода две разновидности — алмаз и графит: графит отличается мягкостью, алмаз тверд, графит — проводник, алмаз — диэлектрик. Известны 4 модификации железа, 9 модификаций серы и др. Каждая модификация устойчива в определенном интервале температур и давлений.
См. так же
- Википедия
- Открытая Физика
У аморфных тел нет строгого порядка в расположении атомов. Только ближайшие атомы – соседи располагаются в некотором порядке. Но строгой направляемости по всем направлениям одного и того же элемента структуры, которая характерна для кристаллов в аморфных телах, нет. На рисунке 9 изображена плоская схема расположения молекул кварца – кристаллического тела (а), и кварцевого стекла — аморфного тела (б).
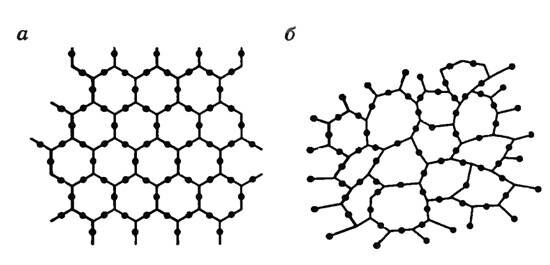
Рис. 9
Свойства аморфных тел
Все аморфные тела изотропные, т.е. их физические свойства одинаковы по всем направлениям. К аморфным телам относятся стекло, смола, канифоль, сахарный леденец и др.
При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, подобно твёрдым телам, и текучесть, подобно жидкости. Аморфное тело обладает слабо выраженной текучестью. Так, если воронку наполнить кусочками воска, то через некоторое время (различное для разных температур) кусочки воска будут “расплываться”. Воск примет форму воронки и начнет “вытекать” из нее.
Аморфные тела при низких температурах по своим свойствам напоминают твёрдые тела. Текучестью они почти не обладают, но по мере повышения температуры постепенно размягчаются и их свойства всё более и более приближаются к свойствам жидкостей. Это происходит потому, что с ростом температуры постепенно учащаются перескоки атомов из одного положения в другое. Определённой температуры плавления у аморфных тел, в отличие от кристаллических, нет. Вещество в аморфном состоянии при нагревании постепенно размягчается и переходит в жидкость (рис. 8, кривая 2). Вместо температуры плавления приходится говорить о температурном интервале размягчения.
Жидкие кристаллы — вещества, обладающие одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия).
По структуре они представляют собой жидкости, похожие на желе, состоящие из молекул вытянутой формы, определённым образом упорядоченных во всем объёме этой жидкости (рис. 10).

Рис. 10
Жидкие кристаллы — это почти прозрачные субстанции, проявляющие одновременно свойства кристалла и жидкости. Их внешнее состояние при нагревании может изменяться от твердого до жидкокристаллического и полностью переходить в жидкую форму при дальнейшем повышении температуры.
- Жидкие кристаллы открыл в 1888 г. австрийский ботаник Ф. Рейнитцер. Он обратил внимание, что у кристаллов холестерилбензоата и холестерилацетата было две точки плавления и, соответственно, два разных жидких состояния — мутное (от 145 °С до 179 °С) и прозрачное (выше 179 °С). Однако, учёные не обратили особого внимания на необычные свойства этих жидкостей. Долгое время физики и химики в принципе не признавали жидких кристаллов, потому что их существование разрушало теорию о трёх состояниях вещества: твёрдом, жидком и газообразном.
Применение жидких кристаллов
Одно из важных направлений использования жидких кристаллов — термография. Подбирая состав жидкокристаллического вещества, создают индикаторы для разных диапазонов температуры и для различных конструкций. Например, жидкокристаллический индикатор на коже больного быстро диагностирует скрытое воспаление и даже опухоль.
С помощью жидких кристаллов обнаруживают пары́ вредных химических соединений и опасные для здоровья человека гамма- и ультрафиолетовое излучения. На основе жидких кристаллов созданы измерители давления, детекторы ультразвука.
Но самая многообещающая область применения жидкокристаллических веществ — информационная техника. В настоящее время цветные жидкокристаллические экраны используются в сотовых телефонах, мониторах и телевизорах. Они обладают малой толщиной, малой потребляемой мощностью, высоким разрешением и яркостью.
См. так же
- Википедия
- Мегаэнциклопедия Кирилла и Мефодия
По своим необычным свойствам из всей группы твердых тел выделяются полимеры — вещества, молекулы которых состоят из большого числа повторяющихся групп атомов (мономеров).
- πολύ- и μέρος — от греч. «много» и «часть».
Например, молекула полимеров образуется повторением группы СH2:
— CH2 — CH2 — CH2 — CH2 —
Число мономерных единиц в молекуле определяет относительную молекулярную массу полимера, которая, как правило, очень велика — десятки и сотни тысяч атомных единиц массы. Например, полиэтилен имеет относительную массу 35000 а.е.м., каучук — 400000 а.е.м.
К полимерам относятся многочисленные природные соединения: белки, нуклеиновые кислоты, полисахариды, каучук и другие органические вещества. Большое число полимеров получают синтетическим путём. Названия полимеров образуются из названия мономера с приставкой поли-: полиэтилен, полипропилен, поливинилацетат и т. п.
Человек давно использует природные полимерные материалы в своей жизни. Например, кожа, меха, шерсть, шёлк, хлопок, используемые для изготовления одежды. На основе целлюлозе производят плёнки, волокна, лакокрасочные материалы и загустители. Развитие кино и фотографии оказалось возможным лишь благодаря появлению прозрачной плёнки из нитроцеллюлозы. Освоено производство тканей на основе полиэфирного волокна под названием лавсан или полиэтилентерефталат. Полипропилен и нитрон —синтетические волокна, которые использует современный человек для одежды и производственной деятельности.
Особые механические свойства
- эластичность — способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки);
- малая хрупкость стеклообразных и кристаллических полимеров (пластмассы, органическое стекло).
См. так же
- Википедия
- Все о полимерах
- Новости мира пластмасс plastmassa.net
- Новости мира пластмасс plast-tech.ru
- Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 184-185,186-187.
- Жилко В.В. Физика: Учеб. пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. — Мн.: Нар. асвета, 2002. — С. 265-269.
Источник