Какое свойство отличает кристаллические тела от аморфных тел
В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.

Твердые тела
Все твердые тела обладают следующими общими свойствами:
- Способностью долгое время сохранять форму и объем (геометрические размеры);
- Наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).
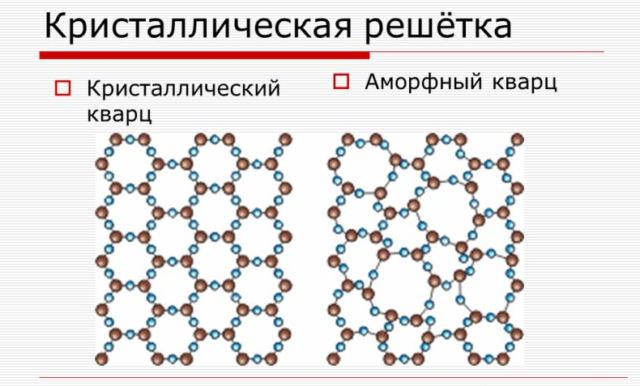
Рис. 1. Примеры решеток кристаллических и аморфных тел – кварц аморфный и кристаллический.
Современные ученые исследуют пространственное расположение атомов и молекул в твердых телах с помощью электронных микроскопов, которые позволяют получить изображение объекта с сильным увеличением (до 106 раз). Первый электронный микроскоп был изобретен в 30-х годах прошлого века. В 2018 г. с помощью последних версий этого прибора было получено разрешение 0,39 ангстрем. Напомним, что 1 ангстрем равен 10-8 см. В большинстве кристаллов это соответствует шагу атомной решетки.
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Отсутствие дальнего порядка в расположении частиц вещества у аморфных тел приводит к тому, что их физические свойства одинаковы во всех направлениях. Такие тела называют изотропными (слово “изотропный” составлено из двух греческих слов: isos — ровный, tropos — направление). Изотропность физических свойств аморфных тел является следствием хаотичного расположения составляющих их молекул и атомов.
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

Рис. 2. Монокристаллы и поликристаллы.
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.

Рис. 3. Графит и алмаз.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Тест по теме
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 263.
Источник
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
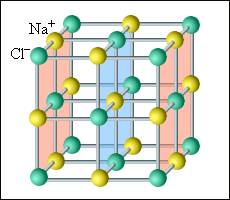
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl (рис. 3.6.1). Такие кристаллы называются ионными.
|
Рисунок 3.6.1. Кристаллическая решетка поваренной соли |
В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах.
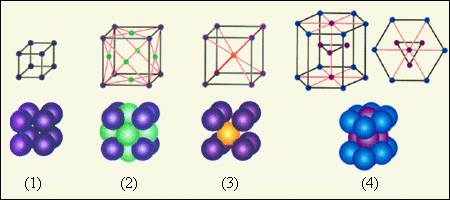
На рис. 3.6.2 приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
|
Рисунок 3.6.2. Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка |
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
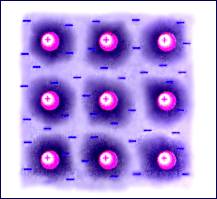
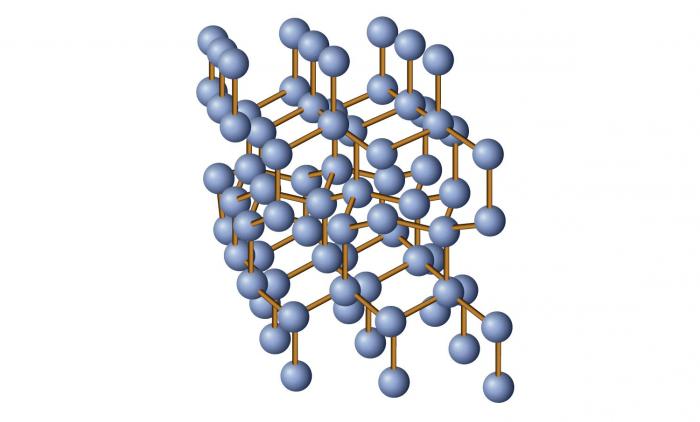
Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. 3.6.3). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.
|
Рисунок 3.6.3. Структура металлического кристалла |
Источник
Существует несколько агрегатных состояний, в которых находятся все тела и вещества. Это:
- газ;
- жидкость;
- плазма;
- твердое.
Если рассматривать общую совокупность планеты и космоса, то большая часть веществ и тел все же находится в состоянии газа и плазмы. Однако на самой Земле существенно и содержание твердых частиц. Вот о них мы и поговорим, выяснив, чем являются кристаллические и аморфные твердые тела.
Кристаллические и аморфные тела: общее понятие
Все твердые вещества, тела, предметы условно подразделяются на:
- кристаллические;
- аморфные.
Разница между ними огромная, ведь в основе подразделения лежат признаки строения и проявляемых свойств. Если говорить кратко, то твердыми кристаллическими именуются те вещества и тела, которые имеют определенный тип пространственной кристаллической решетки, то есть обладают способностью изменяться в определенном направлении, но не во всех (анизотропия).
Если же характеризовать аморфные соединения, то первый их признак – способность менять физические характеристики по всем направлениям одновременно. Это называется изотропией.
Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует.

Свойства твердых тел
Кристаллические и аморфные тела тем не менее относятся к единой группе твердых, а значит, обладают всеми характеристиками данного агрегатного состояния. То есть общими свойствами для них будут следующие:
- Механические – упругость, твердость, способность к деформации.
- Тепловые – температуры кипения и плавления, коэффициент теплового расширения.
- Электрические и магнитные – проводимость тепловая и электрическая.
Таким образом, рассматриваемые нами состояния обладают всеми данными характеристиками. Только проявляться у аморфных тел они будут несколько иначе, нежели у кристаллических.
Важными свойствами для промышленных целей являются механические и электрические. Способность восстанавливаться после деформации или, напротив, крошиться и измельчаться – важная особенность. Также большую роль играет тот факт, может вещество проводить электрический ток либо не способно к этому.

Строение кристаллов
Если описывать строение кристаллических и аморфных тел, то в первую очередь следует указать тип частиц, которые их слагают. В случае кристаллов это могут быть ионы, атомы, атом-ионы (в металлах), молекулы (редко).
Вообще данные структуры характеризуются наличием строго упорядоченной пространственной решетки, которая формируется в результате расположения образующих вещество частиц. Если представить строение кристалла образно, то получится примерно такая картина: атомы (или другие частицы) располагаются друг от друга на определенных расстояниях так, чтобы в результате получилась идеальная элементарная ячейка будущей кристаллической решетки. Затем данная ячейка многократно повторяется, и так складывается общая структура.
Главной особенностью является то, что физические свойства в подобных структурах изменяются в параллелях, но не во всех направлениях. Называется подобное явление анизотропией. То есть если воздействовать на одну часть кристалла, то вторая сторона может не реагировать на это. Так, можно измельчить половину кусочка поваренной соли, однако вторая останется целой.
Типы кристаллов
Принято обозначать два варианта кристаллов. Первый – это монокристаллические структуры, то есть когда сама решетка 1. Кристаллические и аморфные тела в этом случае совсем различны по свойствам. Ведь для монокристалла характерна анизотропия в чистом виде. Он представляет собой самую маленькую структуру, элементарную.
Если же монокристаллы повторяются многократно и соединяются в одно целое, тогда речь идет о поликристалле. Тогда речь об анизотропии не идет, так как ориентация элементарных ячеек нарушает общую упорядоченную структуру. В этом отношении поликристаллы и аморфные тела близки друг другу по проявляемым физическим свойствам.

Металлы и их сплавы
Кристаллические и аморфные тела очень близки друг другу. В этом легко убедиться, взяв в качестве примера металлы и их сплавы. Сами по себе они при обычных условиях твердые вещества. Однако при определенной температуре начинают плавиться и, пока не произойдет полная кристаллизация, будут оставаться в состоянии тянущейся, густой, вязкой массы. А это уже и есть аморфное состояние тела.
Поэтому, строго говоря, практически каждое кристаллическое вещество может при определенных условиях стать аморфным. Так же, как и последнее при кристаллизации становится твердым веществом с упорядоченной пространственной структурой.
Металлы могут иметь разные типы пространственных структур, самыми известными и изученными из которых являются следующие:
- Простая кубическая.
- Гранецентрированная.
- Объемоцентрированная.
В основе структуры кристалла может лежать призма или пирамида, а ее главная часть представлена:
- треугольником;
- параллелограммом;
- квадратом;
- шестиугольником.
Идеальными свойствами изотропии обладает вещество, имеющее простую правильную кубическую решетку.

Понятие об аморфности
Кристаллические и аморфные тела внешне различить достаточно просто. Ведь последние часто можно перепутать с вязкими жидкостями. В основе структуры аморфного вещества также лежат ионы, атомы, молекулы. Однако они не образуют упорядоченной строгой структуры, а потому и свойства их изменяются во всех направлениях. То есть они изотропны.
Частицы располагаются хаотично, беспорядочно. Лишь иногда они могут образовывать небольшие локусы, что все равно не влияет на общие проявляемые свойства.
Свойства подобных тел
Они идентичны таковым у кристаллов. Различия лишь в показателях для каждого конкретного тела. Так, например, можно выделить такие характеристические параметры аморфных тел:
- упругость;
- плотность;
- вязкость;
- тягучесть;
- проводимость и полупроводимость.
Часто можно встретить граничные состояния соединений. Кристаллические и аморфные тела могут переходить в состояние полуаморфности.
Также интересна та черта рассматриваемого состояния, которая проявляется при резком внешнем воздействии. Так, если аморфное тело подвергнуть резкому удару или деформации, то оно способно повести себя как поликристалл и расколоться на мелкие кусочки. Однако если дать этим частям время, то вскоре они снова соединятся вместе и перейдут в вязкое текучее состояние.

У данного состояния соединений нет определенной температуры, при которой происходит фазовый переход. Этот процесс сильно растянут, иногда даже на десятки лет (например, разложение полиэтилена низкого давления).
Примеры аморфных веществ
Можно привести много примеров подобных веществ. Обозначим несколько самых наглядных и часто встречаемых.
- Шоколад – типичное аморфное вещество.
- Смолы, в том числе фенолформальдегидные, все пластики.
- Янтарь.
- Стекло любого состава.
- Битум.
- Гудрон.
- Воск и другие.
Аморфное тело образуется в результате очень медленной кристаллизации, то есть повышения вязкости раствора при понижении значения температуры. Часто сложно назвать подобные вещества твердыми, их относят скорее к вязким густым жидкостям.
Особое состояние имеют те соединения, которые при затвердевании вообще не кристаллизуются. Их называют стеклами, а состояние – стеклообразным.
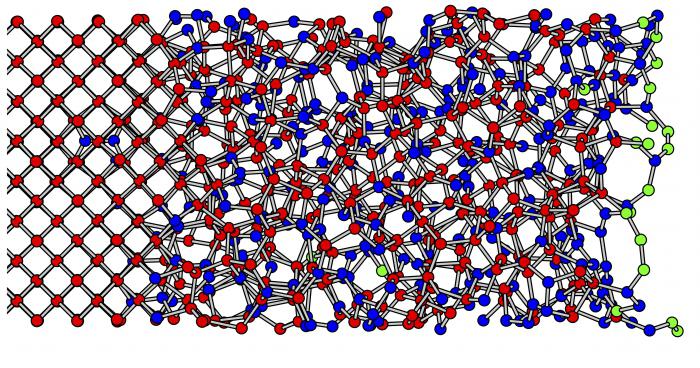
Стеклообразные вещества
Свойства кристаллических и аморфных тел схожи, как мы выяснили, вследствие общего происхождения и единой внутренней природы. Но иногда от них отдельно рассматривают особое состояние веществ, именуемое стеклообразным. Это гомогенный минеральный раствор, который кристаллизуется и затвердевает без формирования пространственных решеток. То есть остается изотропным по изменению свойств всегда.
Так, например, обычное оконное стекло не имеет точного значения температуры плавления. Оно просто при повышении данного показателя медленно плавится, размягчается и переходит в жидкое состояние. Если же воздействие прекратить, то пойдет обратный процесс и начнется затвердевание, но без кристаллизации.
Такие вещества очень ценятся, стекло сегодня – один из самых распространенных и востребованных строительных материалов во всем мире.
Источник
Твердыми являются кристаллические и аморфные тела. Кристалл — так в древности называли лед. А потом стали называть кристаллом кварц и горный хрусталь, считая эти минералы окаменевшим льдом. Кристаллы бывают природными и искусственными (синтетическими). Они используются в ювелирной промышленности, оптике, радиотехнике и электронике, в качестве опор для элементов в сверхточных приборах, как сверхтвердый абразивный материал.
Кристаллические тела характеризуются твердостью, имеют строго закономерное положение в пространстве молекул, ионов или атомов, в результате чего образуется трехмерная периодическая кристаллическая решетка (структура). Внешне это выражается определенной симметрией формы твердого тела и его определенными физическими свойствами. Во внешней форме кристаллические тела отражают симметрию, свойственную внутренней “упаковке” частиц. Это определяет равенство углов между гранями всех кристаллов, состоящих из одного и того же вещества.
В них равными будут и расстояния от центра до центра между соседствующими атомами (если они расположены на одной прямой, то это расстояние будет одинаковым на всей протяженности линии). Но для атомов, лежащих на прямой с другим направлением, расстояние между центрами атомов будет уже иным. Этим обстоятельством объясняется анизотропия. Анизотропность – главное, чем отличаются кристаллические тела от аморфных.

Более 90% твердых тел можно отнести к кристаллам. В природе они существуют в виде монокристаллов и поликристаллов. Монокристаллы — одиночные, грани которых представлены правильными многоугольниками; для них характерно наличие непрерывной кристаллической решетки и анизотропии физических свойств.
Поликристаллы — тела, состоящие из множества мелких кристаллов, “сросшихся” между собой несколько хаотично. Поликристаллами являются металлы, сахар, камни, песок. В таких телах (например, фрагмент металла) анизотропия обычно не проявляется из-за беспорядочного расположения элементов, хотя отдельно взятому кристаллу этого тела свойственна анизотропия.
Другие свойства кристаллических тел: строго определенная температура кристаллизации и плавления (наличие критических точек), прочность, упругость, электропроводность, магнитопроводность, теплопроводность.

Аморфные – не имеющие формы. Так дословно переводится это слово с греческого. Аморфные тела созданы природой. Например, янтарь, воск, вулканическое стекло. К созданию искусственных аморфных тел причастен человек – стекло и смолы (искусственные), парафин, пластмассы (полимеры), канифоль, нафталин, вар. Аморфные вещества не имеют кристаллической решетки вследствие хаотичного расположения молекул (атомов, ионов) в структуре тела. Поэтому физические свойства для какого-либо аморфного тела изотропны – одинаковы во всех направлениях. Для аморфных тел не существует критической точки температуры плавления, они постепенно размягчаются при нагревании и переходят в вязкие жидкости. Аморфным телам отведено промежуточное (переходное) положение между жидкостями и кристаллическими телами: при низких температурах они твердеют и становятся упругими, кроме того, могут раскалываться при ударе на бесформенные куски. При высоких температурах эти же элементы проявляют пластичность, становясь вязкими жидкостями.
Теперь вы знаете, что такое кристаллические тела!
Источник