Какое свойство отличает кристалл от аморфных тел
Рассмотрим твердые тела подробнее. По упорядоченности мельчайших частиц, из которых состоят твердые тела, их можно разделить на аморфные и кристаллические.
Чем отличаются кристаллические и аморфные тела
У кристаллических тел есть строго упорядоченное положение мельчайших частиц. Эти частички образуют правильную кристаллическую решетку (рис. 1).
Примечание: Атомы кристаллических тел располагаются в узлах кристаллической решетки. Связи между атомами обозначены линиями. Эти линии у различных кристаллических тел образуют разные пространственные фигуры.
Рис.1. Кристаллические тела имеют более упорядоченную структуру в твердом состоянии, чем аморфные тела
Аморфные тела не обладают строгой упорядоченностью мельчайших частиц — молекул, из которых они состоят. У аморфных тел порядок есть, но он не так выражен, как у кристаллических тел. Аморфное тело по своему строению больше похоже на очень вязкую жидкость, чем на твердое тело. Поэтому, аморфные тела обладают текучестью.
Основные отличия кристаллических и аморфных тел приведены на рисунке 2.
Рис. 2. Сравниваем свойства кристаллических и аморфных тел
Примечания:
- Благодаря текучести, спустя много лет после изготовления, верхняя часть установленного в раму оконного стекла, становится немного тоньше, чем его нижняя часть.
- Канифоль со временем может принимать форму сосуда, в который ее поместили.
Переход:
- из жидкого в твердое состояние – кристаллизация;
- из твердого в жидкое состояние – плавление;
Плавление аморфных тел
Аморфные тела конкретной температуры плавления не имеют. Строение аморфных тел больше похоже на очень вязкую жидкость, чем на твердое кристаллическое тело. Во время нагревания они будут становиться более текучими, все больше проявляя свойство жидкости. При этом, хрупкость, присущая твердому состоянию, будет исчезать. Одновременно с плавлением, температура аморфных тел будет повышаться.
Важно! Одновременно с плавлением, температура аморфных тел будет непрерывно повышаться. Потому, что такие тела не имеют конкретной температуры плавления.
Примеры аморфных тел
- канифоль (смола хвойных деревьев);
- стекло;
- эбонит;
- сургуч;
- различные пластмассы;
Примечание: Эбонит («Эбенос» др.-греч. — чёрное дерево) – это вулканизированный каучук с добавлением большого количество серы, до 50 % от массы каучука. Цвет эбонита обычно тёмно-бурый или чёрный. Этот материал не проводит электрических ток – то есть, является хорошим изолятором.
Плавление кристаллических тел
Чтобы кристаллическое тело начало плавиться, его нужно нагреть до определенной температуры. Одни кристаллические тела будут плавиться при низкой температуре, а другие – при высокой. То есть, у каждого вещества своя температура плавления. Ее можно найти в справочнике физики. При этом, пока вещество не расплавится, его температура изменяться не будет.
Важно! Кристаллические тела имеют конкретную температуру плавления. Пока кристаллическое вещество полностью не расплавится, его температура не изменится!
Примечания:
- Кристаллические вещества плавятся при той же температуре, при которой они будут превращаться в твердое тело (кристаллизоваться).
- Чтобы жидкое вещество начало кристаллизоваться, оно сначала должно остыть до определенной температуры.
- Температура плавления и температура кристаллизации – это одна и та же температура.
Примеры кристаллических тел
- лед;
- свинец;
- алюминий;
- ртуть;
- железо;
- золото;
- серебро;
Как на графике выглядит процесс плавления кристаллического тела
Рассмотрим переход из твердого состояния в жидкое — плавление и, обратно — кристаллизацию, на примере льда.
Возьмем лед при начальной температуре «-40» градусов по Цельсию (рис. 3) и поместим его в кастрюльку. Поставим эту кастрюльку на газовую плиту и начнем нагревать лед.
Процесс нагревания льда изображается наклонной линией синего цвета. Потому, что время идет, а температура льда повышается.
Во время нагревания льда от отрицательной температуры до нуля градусов, в емкости будет содержаться только твердый лед.
Рис.3. Процесс плавления – это горизонтальная линия на температурном графике
Как только будет достигнута температура плавления льда – «0» градусов по Цельсию, лед начнет превращаться в жидкость. В кастрюльке начнет понемногу появляться вода. То есть, будет присутствовать и лед, и вода одновременно. Постепенно воды становится все больше, а льда – все меньше.
Мы продолжаем подавать тепловую энергию. Но температура льда во время плавления не меняется до тех пор, пока весь лед не расплавится и не превратится в жидкость.
Поэтому на графике температуры плавление кристаллических тел изображается горизонтальной линией. На рисунке 3 эта линия выделена красным цветом.
Примечания:
- Чтобы тело расплавить, ему нужно передать тепловую энергию. Значит, при плавлении, тепловая энергия поглощается телом.
- При плавлении кристаллических тел, вся полученная тепловая энергия тратится на разрушение кристаллической решетки. Поэтому кристаллические тела имеют конкретную температуру плавления. Она не будет повышаться до тех пор, пока все кристаллическое тело полностью не расплавится.
Когда лед полностью расплавится, в кастрюльке будет присутствовать только жидкая вода. На рисунке 5 это — крайняя правая точка на горизонтальной красной линии.
Если продолжать подводить тепловую энергию, температура воды начнет повышаться. Идет процесс нагревания воды. На графике процесс нагревания – это еще одна наклонная прямая линия, она располагается справа от красной линии плавления.
Как на графике выглядит процесс кристаллизации для кристаллического тела
Давайте теперь прекратим нагревание воды, вынесем кастрюльку на мороз и, оставим ее там на какое-то время. Вода начнет охлаждаться, ее температура будет понижаться. На рисунке 4 это отражено убывающей до нуля прямой наклонной синей линией.
Рис. 4. Процесс кристаллизации – это горизонтальная линия на температурном графике
Когда вода охладится до нуля градусов, начнется процесс превращения жидкости в твердое тело – лед. Потому, что ноль градусов Цельсия – это температура не только плавления, но и кристаллизации льда. Вначале начнут появляться маленькие льдинки. Этому соответствует левая часть красной горизонтальной линии на графике 4.
Примечание: Если в воде присутствуют пылинки, или другие мелкие примеси, то кристаллизация проходит быстрее. Такие мелкие примеси называют центрами кристаллизации.
Постепенно, количество льда увеличивается, а воды становится все меньше. При этом, температура воды и льда в кастрюльке продолжает оставаться равной нулю градусов по Цельсию.
Когда вся вода в кастрюльке превращается в лед – этому соответствует крайняя правая точка на красной линии на графике.
Только после этого температура льда начинает понижаться от нуля в отрицательную область температур. На рисунке это описано наклонной синей линией, примыкающей справа к горизонтальной красной линии.
Примечание: Чтобы тело перешло из жидкого состояния в твердое (кристаллизовалось), оно должно избавиться от избытка тепловой энергии. Значит, при кристаллизации, тело отдает энергию окружающим телам. Физики скажут так: «Тело выделяет тепловую энергию во внешнюю среду».
Выводы
- Все тела в твердом состоянии по их строению можно разделить на аморфные и кристаллические.
- Переход из твердого в жидкое состояние – это плавление, а из жидкого в твердое состояние – кристаллизация;
- Аморфные тела конкретной температуры плавления не имеют. Их строение больше похоже на очень вязкую жидкость, чем на твердое кристаллическое тело. Одновременно с плавлением, температура аморфных тел будет повышаться.
- Кристаллическое тело плавится и кристаллизуются при одной и той же температуре. Эту температуру называют температурой плавления (кристаллизации). Т. е. пока происходят процессы плавления и кристаллизации, температура не меняется.
- Во время плавления тело получает тепловую энергию (количество теплоты), а во время кристаллизации тело отдает тепловую энергию в окружающее пространство.
- Сколько теплоты тело получило во время плавления, столько же оно отдаст в окружающую среду во время кристаллизации. Потому, что выполняется закон сохранения энергии (тепловой).
- Чтобы твердое тело превратить в жидкость, ему нужно сообщить (передать) тепловую энергию.
- Чтобы жидкое тело превратить в твердое, нужно избавить его от излишка тепловой энергии.
- Перед тем, как расплавить твердое кристаллическое вещество, нужно нагреть его до температуры плавления. Температуру плавления различных веществ можно найти в справочнике физики.
Источник
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
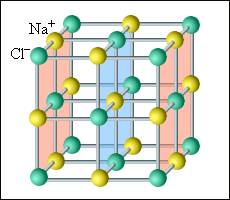
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl (рис. 3.6.1). Такие кристаллы называются ионными.
|
Рисунок 3.6.1. Кристаллическая решетка поваренной соли |
В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах.
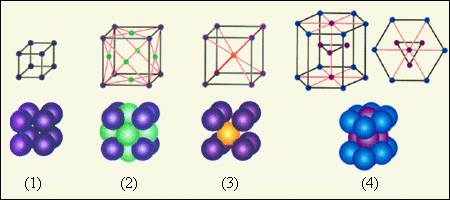
На рис. 3.6.2 приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
|
Рисунок 3.6.2. Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка |
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
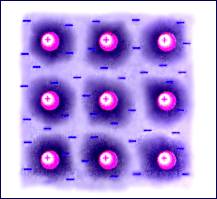
Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. 3.6.3). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.
|
Рисунок 3.6.3. Структура металлического кристалла |
Источник
В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.

Твердые тела
Все твердые тела обладают следующими общими свойствами:
- Способностью долгое время сохранять форму и объем (геометрические размеры);
- Наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).
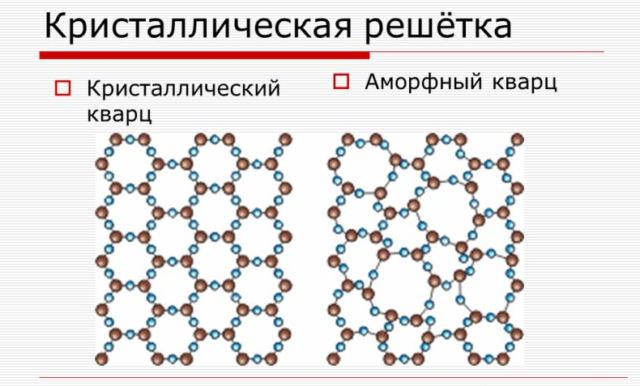
Рис. 1. Примеры решеток кристаллических и аморфных тел – кварц аморфный и кристаллический.
Современные ученые исследуют пространственное расположение атомов и молекул в твердых телах с помощью электронных микроскопов, которые позволяют получить изображение объекта с сильным увеличением (до 106 раз). Первый электронный микроскоп был изобретен в 30-х годах прошлого века. В 2018 г. с помощью последних версий этого прибора было получено разрешение 0,39 ангстрем. Напомним, что 1 ангстрем равен 10-8 см. В большинстве кристаллов это соответствует шагу атомной решетки.
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Отсутствие дальнего порядка в расположении частиц вещества у аморфных тел приводит к тому, что их физические свойства одинаковы во всех направлениях. Такие тела называют изотропными (слово “изотропный” составлено из двух греческих слов: isos — ровный, tropos — направление). Изотропность физических свойств аморфных тел является следствием хаотичного расположения составляющих их молекул и атомов.
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

Рис. 2. Монокристаллы и поликристаллы.
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.

Рис. 3. Графит и алмаз.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Саша Александр
5/5
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 79.
Источник
Продолжительность учебного занятия: 90 минут
Тип учебного занятия: урок объяснения нового
материала
Форма учебного занятия: урок – презентация
Цели:
Образовательные:
- Раскрыть основные свойства кристаллических и
аморфных тел и зависимость этих свойств от
внутреннего строения тел; отработать понятия
“изотропия и анизотропия”, “полиморфизм”. - Рассмотреть количественные характеристики
механических свойств тел. - Ознакомить учащихся с различного вида
деформациями твердого тела и их
характеристиками. - Сформулировать закон Гука.
- Объяснить физический смысл модуля упругости.
Развивающие:
- Сформировать познавательные умения сравнения,
классификации (кристаллов), анализа и
установления причинно-следственных связей между
внешними признаками, свойствами и внутренним
строением кристаллических и аморфных тел.
Воспитательные:
- а) мировоззренческие – углубить представления
учащихся о веществе как одном из видов материи на
примере свойств кристаллических и аморфных тел; - б) практические – показать использование
кристаллов в технике, в создании новых
материалов.
Оборудование: Компьютер, коллекция уральских
камней (минералов), штатив, кусок резины, линейка,
груз, модель для демонстрации видов деформации.
Ход урока
I. Орг. момент. Мотивация.
Мы живем в мире, в котором большая часть веществ
находится в твердом состоянии. Мы пользуемся
различными механизмами, инструментами,
приборами. Мы живем в домах и квартирах. Имеем
мебель, бытовые приборы, современнейшие средства
связи: радио, телевидение, компьютеры и т.д. А ведь
все это твердые тела. С физической точки зрения,
человек – твердое тело. Так что же такое твердые
тела? (Слайд 1,2)
II. Объяснение нового материала.
Существует два вида твердых тел: кристаллические
и аморфные. (Слайд 3)
В природе наиболее часто встречаются твердые
тела, имеющие форму правильных многогранников –
кристаллы. (Слайд 4)
Демонстрация кристаллов. (Слайд 5,6,7,8)
Коллекция уральских камней. (Слайд 9)
Если рассматривать при помощи лупы или
микроскопа крупинки сахара, соли, медного
купороса и т.п., то можно заметить, что они
ограничены плоскими, как бы шлифованными
гранями. Наличие таких естественных граней
является признаком нахождения вещества в
кристаллическом состоянии. (Слайд 10)
Для кристаллических тел характерна анизотропия.
(Слайд 11)
Анизотропия – неодинаковость свойств
кристаллов по разным направлениям.
Например, при нагревании кристалл может
расширяться по-разному в разных направлениях, а
некоторые (например, графит) в одном направлении
при нагревании расширяются, а в другом –
сжимаются. Оптические и электрические свойства
кристаллов также зависят от направления
(например, скорость света по разным направлениям
может быть различной). Скорость роста кристалла
(когда он образуется из расплава или
пересыщенного раствора) по разным направлениям
также различна. Если бы он рос по всем
направлениям с одинаковой скоростью, то всегда
получалось бы тело в форме шара.
Очень многие тела одинакового химического
состава в кристаллическом состоянии в
зависимости от условий могут существовать в двух
или более разновидностях. Это свойство
называется полиморфизмом (многоформностью).
Особо важное значение для техники имеет
полиморфизм углерода – углерод кристаллизуется
в двух модификациях: графит и алмаз. Графит –
мягкий материал матово-черного цвета. Из него,
например, изготавливают грифели карандашей.
Алмаз – это прозрачный и очень твердый кристалл.
При температуре около 1500С (при нагревании в
вакууме) алмаз превращается в графит. Чтобы
графит превратить в алмаз, его нужно нагреть до
20000С под давлением 1010Па. В настоящее
время освоено промышленное производство
искусственных алмазов. Искусственные алмазы
широко применяются в различных режущих
инструментах. (Слайд 12)
Не все твердые тела – кристаллы. Существует
множество аморфных тел (от греческого слова amorphos
– бесформенный). (Слайд 13)
У аморфных тел свойства по разным направлениям
одинаковы, они, как говорят, изотропны (греч.
“изос” – одинаковый, “тропос” – направление).
Примерами аморфных тел являются стекло (Слайд
14 – скрытый), всевозможные смолы – янтарь.
У аморфных тел в расположении молекул нет
определенного порядка, т.е. отсутствует
кристаллическая структура. В кристаллах они
расположены в определенном порядке,
следовательно, твердые тела, кристаллы имеют
кристаллическую решетку.
Аморфные тела при низких температурах по своим
свойствам напоминают твердые тела. У аморфных
тел нет определенной температуры плавления. (Слайд
15)
Может показаться, что кристаллических тел
очень мало. Но это не так. Подавляющее
большинство твердых тел, в том числе все металлы
и большинство минералов, являются кристаллами.
Но обычно их кристаллические свойства не
проявляются. Тело полностью обнаруживает свои
кристаллические свойства, если оно является
монокристаллом, т.е. во всем объеме имеет единую
кристаллическую решетку (“моно” – один, единый). (Слайд
16)
Но в большинстве же случаев твердые тела
состоят из множества сросшихся маленьких
кристалликов, ориентированных беспорядочно. Их
называют поликристаллами (“поли” – много).
Поликристаллическими являются все металлы и
минералы. В отличие от монокристаллов
поликристаллы изотропны, т.е. их свойства
одинаковы во всех направлениях. (Слайд 17)
Почему одно и то же вещество (сахар, например)
может быть и кристаллом и аморфным телом?
Ответ на этот вопрос учащиеся дают на основе
анализа графика зависимости температуры
плавления от количества выделившейся теплоты.
Учащиеся отмечают, что при нагревании
кристаллические решетки не разрушаются, а при
температуре плавления связи между частицами
кристаллической решетки нарушаются и происходит
ее разрушение, вещество при этом теряет свойства
анизотропии и становится изотропным.
В целях систематизации изучаемого материала по
ходу беседы учащиеся заполняют таблицу
“Кристаллические и аморфные тела” (табл. 1).
Таблица 1
| Признаки сравнения | Кристаллы | Аморфные тела |
| 1. Внешние признаки | Твердое тело сохраняет форму и объем, плоские грани, постоянство углов между ними, симметрия | Твердое тело, имеет форму, но со временем кристаллизуется (помутнение стекла) |
| 2. Внутреннее строение | Кристаллическая решетка, плотная упаковка частиц, наличие элементарных ячеек, дальний порядок | Ближний порядок, но неустойчивый во времени, в целом частицы расположены хаотично |
| 3. Физические свойства | Анизотропия (теплопроводность, твердость, упругость). Постоянная температура плавления | Изотропия, не имеют постоянной температуры плавления |
Деформация – это изменение размеров и формы
тела под действием силы.
При деформации возникает сила упругости, она
направлена в сторону, противоположную
направлению частиц тела при деформации. Но не
всегда деформация приводит к появлению сил
упругости. Пластичные тела не восстанавливают
своей формы после прекращения действия силы. То
есть существует упругая и пластическая
деформации.
Упругая деформация – это деформация, при
которой после прекращения действия силы размеры
и форма тела восстанавливаются (например,
пружина).
Пластическая деформация – это деформация,
при которой после прекращения действия силы тело
не восстанавливает свою первоначальную форму и
размеры (например, пластилин).
Фронтальная лабораторная работа “Наблюдение
упругих и пластических деформаций тел”
Приборы и материалы: 1) резина
ученическая (ластик); 2) полоска резинки; 3) кусок
пластилина.
Ход работы
1. Растяните, затем согните ластик.
Ответьте на вопросы:
– Как направлены силы, действующие на ластик при
его растяжении и сжатии?
– Как направлена сила упругости, возникающая в
ластике при деформации, относительно
направления смещения его частиц?
2. Изогните ластик. В каких слоях ластика
возникли деформации растяжения, а каких –
сжатия?
3. Скрутите ластик. Из каких деформаций состоит
деформация кручения?
4. Подвергните деформации сжатия кусок
пластилина. Восстанавливается ли его форма после
снятия нагрузки?
5. Подвергните деформации растяжения полоску
резинки. Восстанавливается ли ее форма после
снятия нагрузки?
Учащиеся называют виды деформаций и приводят
примеры. (Слайд 18)
Какие виды деформаций испытывает человеческое
тело?
Сообщение учащегося:
Человеческое тело испытывает достаточно
большую механическую нагрузку от собственного
веса и от мышечных усилий, возникающих во время
трудовой деятельности.
Интересно, что на примере человека можно
проследить все виды деформации. Деформации
сжатия испытывает позвоночный столб и нижние
конечности и покровы ступни. Деформации
растяжения – верхние конечности, связки,
сухожилия, мышцы. Деформации изгиба –
позвоночник, кости таза. Деформация кручения –
шея при повороте головы, туловище в пояснице при
повороте.
Рассмотрим удлинение стержня. (Слайд 19)
L0 – первоначальная длина стержня;
L – длина стержня под действием нагрузки;
S – площадь поперечного сечения стержня;
F- деформирующая сила;
–
напряжение, возникающее в стержне.
Напряжение – это сила, приходящаяся на
единицу площади поперечного сечения.
L – L0 = ?L – абсолютное удлинение
стержня к первоначальной длине.
– относительное
удлинение – удлинение каждого метра
первоначальной длины.
Например, L0 = 3м; L =
6см = 0,06м; =
= – закон Гука
При малых деформациях относительное удлинение
пропорционально приложенному напряжению. (Слайд
20)
Е – модуль Юнга – модуль упругости.
Сформулируем физический смысл модуля Юнга.
Пусть относительное удлинение = 1; тогда = 2; L = 2L0,
следовательно, Е = .
Модуль Юнга численно равен приложенному
напряжению при = 1.
Модуль Юнга – это напряжение, при котором
первоначальная длина увеличивается в 2 раза.
–
напряжение; {E} = {} = {Па}
Если напряжение превысит определенную для
данного материала величину, то после прекращения
действия силы тело не восстановит своей
первоначальной формы. Это напряжение называют
пределом упругости.
Закон Гука выполняется лишь до тех пор, пока
напряжение в материале не превысило предел
упругости.
Предел прочности – минимальное напряжение, при
котором происходит разрыв тела.
пр – предел
прочности.
Отношение предела прочности к допускаемому
напряжению называют запасом прочности (n).
n = .
Рассмотрим график зависимости абсолютного
удлинения от величины деформирующей силы
(диаграмма растяжения). (Слайд21)
Материалы, у которых область текучести
значительна, могут без разрушения выдерживать
большие деформации. Такие материалы называют пластичными
(пластилин, медь, золото).
Если же область текучести материала почти
отсутствует, он без разрушения может выдерживать
лишь небольшие деформации. Такие материалы
называют хрупкими (стекло, кирпич, бетон, чугун).
(Слайд 21)
Описывая строение кристаллов, мы до сих пор
пользовались их идеальными моделями. Отличие
реальных кристаллов от идеальных состоит в том,
что реальные кристаллы не обладают правильной
кристаллической решеткой. В них всегда
встречаются нарушения строгой периодичности в
расположении атомов. Эти нарушения называют дефектами
в кристаллах. (Слайд 22)
Дефекты образуются в процессе роста кристаллов
под влиянием теплового движения молекул,
механических воздействий, облучения потоками
частиц, из-за наличия примесей.
Точечные дефекты. Такие дефекты возникают
при замещении одного из атомов кристаллической
решетки атомом примеси (а), внедрения атома между
узлами решетки (б) или в результате образования
вакансий – отсутствия атома в одном из узлов
решетки (в). (Слайд 22). Наличие точечных
дефектов в кристалле сильно влияет на его
свойства.
В настоящее время знания о кристаллах и их
дефектах достигли такого уровня, что можно точно
предсказать, какова может быть прочность
различных материалов. Разработаны принципы
проектирования материалов с заранее заданными
свойствами. А это чрезвычайно важно для создания
сверхзвуковых самолетов, космических ракет,
дешевых и прочных автомобилей, тракторов и т.д.
Появилась возможность повышения прочности
материалов и тем самым уменьшения веса машин и
механизмов, увеличения их надежности.
Применение кристаллов
Применения кристаллов в науке и технике очень
разнообразны. Около 80% всех добываемых природных
алмазов и все искусственные алмазы используются
в промышленности.
Алмазные инструменты применяются для
обработки деталей из самых твердых материалов,
используются в буровых инструментах при
разведке и добыче полезных ископаемых. Алмазы
служат опорными камнями в хронометрах высшего
класса для морских судов и в других особо точных
приборах. На алмазных подшипниках не
обнаруживается никаких следов износа даже после
25 000 000 оборотов. (Слайд 23,24)
Исключительная роль выпала на долю кристаллов
в современной электронике. Большинство
полупроводниковых электронных приборов
изготовлено из кристаллов германия или кремния. (Слайд
25)
Новая область для широкого применения рубинов
в научных исследованиях и в технике открылась с
изобретением рубинового лазера – прибора, в
котором рубиновый стержень служит мощным
источником света, испускаемого в виде тонкого
светового пучка. (Слайд 26)
Сообщения учащихся:
Композиционные материалы (железобетон,
железографит, стеклопластик, коллаген). (Приложение 1).
III. Закрепление материала. (Слайд 27,28)
1. Какими свойствами обладают кристаллические
тела?
2. Какими свойствами обладают аморфные тела?
3. Почему в природе не бывает кристаллов
шарообразной формы? (Вследствие анизотропии
роста.)
4. Почему в таблице температур плавления
различных веществ нет температуры плавления
стекла? (Стекло – аморфное тело и не имеет
определенной точки плавления.)
5. Что называют деформацией?
6. Какого вида деформации испытывают:
А) ножки скамейки (сжатие);
Б) сиденье стула (изгиб);
В) натянутая струна гитары (растяжение);
Г) винт мясорубки (кручение);
Д) сверло (кручение и сжатие);
Е) зубья пилы (сдвиг).
IV. Решение задач. (Слайд29)
Задача:
Какой диаметр должен иметь стальной трос
подъемного крана, если максимальная масса
поднимаемого груза равна 10 т? предел
прочности стальной проволоки 8,5 108 Па, запас
прочности должен быть равен 6.
Ответ: 3 см.
Задача:
Чему равно абсолютное удлинение стального
троса длиной 10 м и площадью поперечного сечения
3см2 при подвешивании на него груза массой 6 т?
Модуль упругости стали равен 2 1011Па.
Ответ: 1 см.
V. Итоги урока. (Слайд 30-33).
VI. Домашнее задание. (Слайд 34).
- Параграфы 73,74. (Мякишев Г.Я. Физика: учеб. для 10 кл.
общеобразоват. учреждений: базовый и профильный
уровни). - Задачи № 609, 610, 611, 612. (Сборник задач по физике для
10-11 классов /Рымкевич А.П.) - Экспериментальное д/з: вырастить кристалл
- Приготовьте дома насыщенный раствор поваренной
соли. Профильтруйте его и поставьте на несколько
дней в теплое место. Из образовавшихся на дне
сосуда кристаллов выберите наиболее крупный и
прозрачный. Раствор еще раз профильтруйте и
положите в него один выбранный кристалл для
дальнейшего выращивания. - Приготовить сообщение на тему: “Жидкие
кристаллы”, “Применение жидких кристаллов”.
Источник