Какое свойство не является общим для всех щелочноземельных металлов
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются
легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be – 2s2
- Mg – 3s2
- Ca – 4s2
- Sr – 5s2
- Ba – 6s2
- Ra – 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be – BeO*Al2O3*6SiO2 – берилл
- Mg – MgCO3 – магнезит, MgO*Al2O3 – шпинель, 2MgO*SiO2 – оливин
- Ca – CaCO3 – мел, мрамор, известняк, кальцит, CaSO4*2H2O – гипс, CaF2 – флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия – способ получения металлов путем восстановления их оксидов алюминием)
MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- С оксидами других металлов
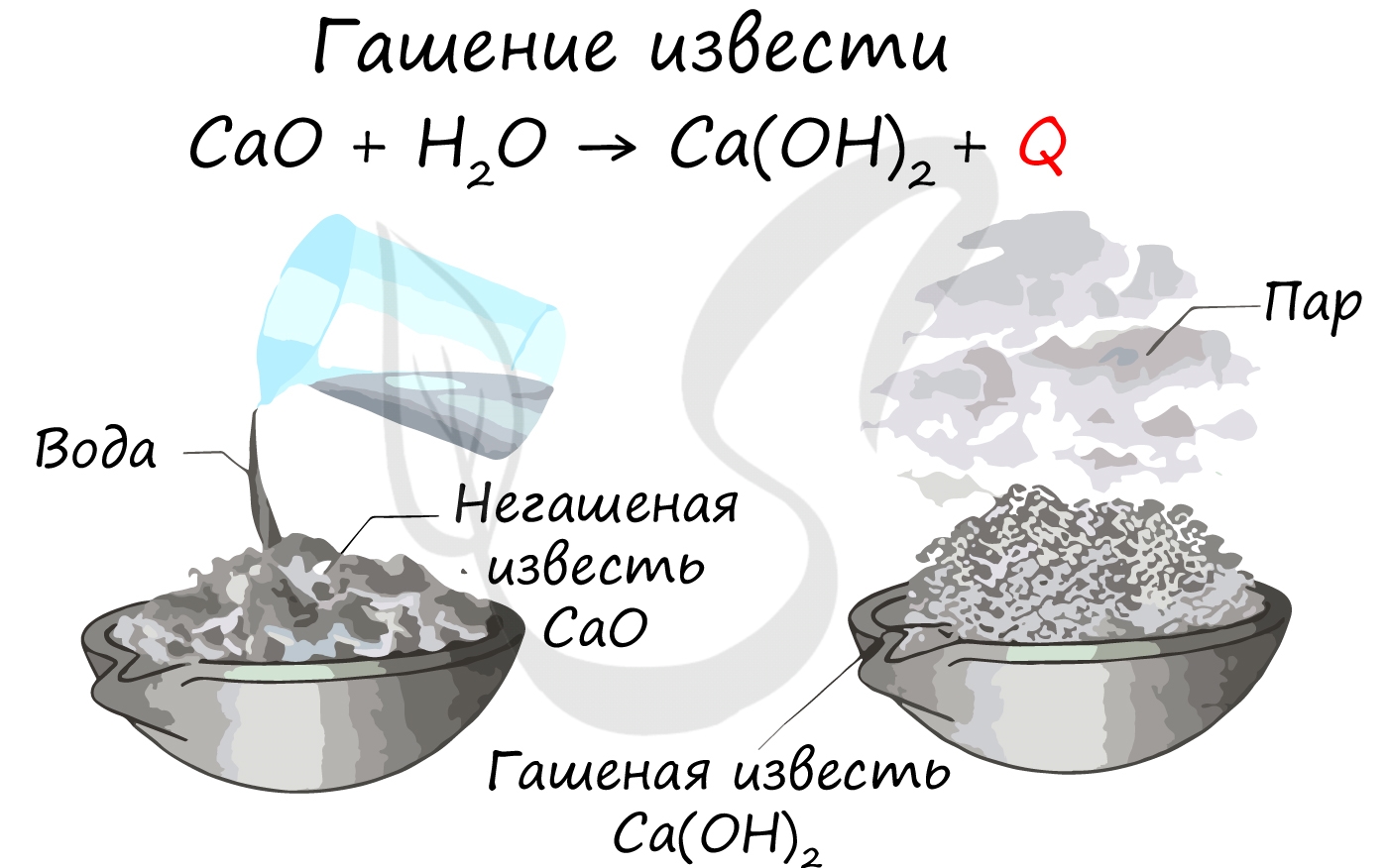
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов.
Магний реагирует с водой только при нагревании.
Ca + H2O → Ca(OH)2 + H2↑
Щелочноземельные металлы – активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород
из кислот:
Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I), серой. Степень окисления у щелочноземельных
металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
Ca + I2 → CaI2 (йодид кальция)
Mg + S → MgS (сульфид магния)
При нагревании реагируют с азотом, водородом и углеродом.
Ca + N2 → (t) Ca3N2 (нитрид кальция)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
MgCO3 → (t) MgO + CO2
Ca(NO3)2 → (t) CaO + O2 + NO2
Рекомендую взять на вооружение общую схему разложения нитратов:

Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO – амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- Реакция с водой
- Амфотерный оксид бериллия
BaO + HCl → BaCl2 + H2O
CaO + H2SO4 → CaSO4 + H2O
MgO + SO3 → MgSO4
CaO + CO2 → CaCO3
CaO + SiO2 → CaSiO3
В нее вступают все, кроме оксида бериллия.
CaO + H2O → Ca(OH)2
MgO + H2O → Mg(OH)2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей,
и с основаниями с образованием комплексных солей.
BeO + HCl → BeCl2 + H2O
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
BeO + Na2O → Na2BeO2

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия – амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
Ca(OH)2 + H2O + CO2 → Ca(HCO3)2 + H2O
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O

Реакция с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется
слабый электролит (вода).
Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Be(OH)2 + HCl → BeCl2 + H2O
Be(OH)2 + NaOH → Na2[Be(OH)4]
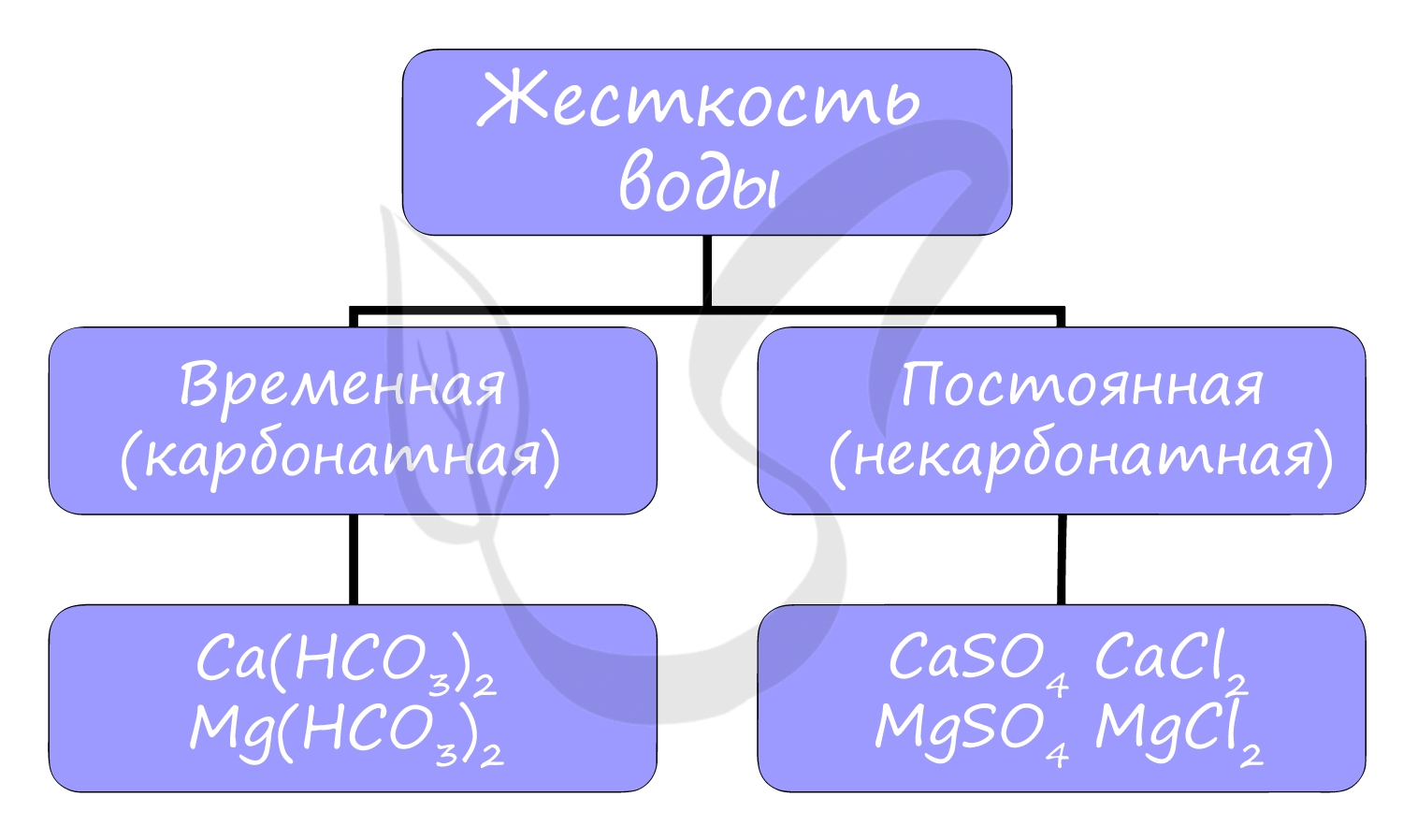
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящая от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов,
сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить – каждый день. Временная жесткость воды устраняется
обычным кипячением воды в чайнике, и известь на его стенках – CaCO3 – бесспорное доказательство устранения жесткости:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
CaCl2 + Na2CO3 → CaCO3↓ + NaCl
MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках
котлов, труб, чайника.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Опубликовано – 10 месяцев назад | По предмету
Химия |
автор Кобра73
Самые новые вопросы
Химия – 2 минуты назад
Найти массу сульфида алюминия, если 27 г алюминия реагируют с 50 г серы помогите пж по братски (((((9((9(9
Русский язык – 56 минут назад
Задание: подчеркнуть грамматические основы; найтидополнения; определить, чем они выражены.1)на лице тебе уж веет ранний утра холодок. (н. языков.)2) редеет ночного тумана покров. (н. языков.)3) через несколько дней меня выслушивал врач. (ю. олеша.)4) глубина впадины равна одиннадцати километрам.5) споры мы отложили на завтра.6) безродного пригрел и ввел в мое семейство. (а. грибоедов.)7)мы попросили девочку спеть.8)врач посоветовал отцу уехать на юг.
Геометрия – 1 час назад
Самостоятельная работа по теме «векторы» 1 вариант 2 вариант 1. из данных векторов укажите: 1) сонаправленные 1) противоположно направленные 2) равные 2) равные e а b c d m n k x z y 2. начертите два неколлинеарных вектора m и n . изобразите два вектора 1) сонаправленных с вектором n 1) сонаправленных с вектором m 2) противоположно направленных вектору m 2) противоположно направленных вектору n 3. начертите два вектора, имеющие равные длины и неколлинеарны противоположно направленные. равны ли эти вектора? 4. в равнобокой трапеции авсd точки m и n – середины боковых сторон ав и cd. равны ли векторы: 1) mb и nc 2) ab и cd 3) dn и nc 1) am и dn 2) ab и dc 3) mb и am самостоятельная работа по теме «векторы» 1 вариант 2 вариант 1. из данных векторов укажите: 1) сонаправленные 1) противоположно направленные 2) равные 2) равные e а b c d m n k x z y 2. начертите два неколлинеарных вектора m и n . изобразите два вектора 1) сонаправленных с вектором n 1) сонаправленных с вектором m 2) противоположно направленных вектору m 2) противоположно направленных вектору n 3. начертите два вектора, имеющие равные длины и неколлинеарны противоположно направленные. равны ли эти вектора? 4. в равнобокой трапеции авсd точки m и n – середины боковых сторон ав и cd. равны ли векторы: 1) mb и nc 2) ab и cd 3) dn и nc 1) am и dn 2) ab и dc 3) mb и am
Английский язык – 1 час назад
Exercise 1.match the words or phrases (1-7) with the definitions (a-g):1.inch 2.pound 3.convert4.kilogram5.ton6.cubic meter7.volume weighta. a calculation that shows the density of a packageb. a unit of weight that is equal to 2,000 poundsc. a unit of weight that is equal to 1,000 gramsd. a unit of length that is equal to one-twelfth of a foote. to exchange one system of weights and measures for anotherf. a metric unit of volume that is equal to 1,000 litersg. a unit of weight that is equal to 16 ounces or 4536 of a kilogramexercise 2. read the sentence pairs. choose which word or phrase best fits each blank:1. miles/metric system randy drove 80 _____ per hour down the freeway. in 1995, great britain partially switched over to the _______.2. foot/meter one hundred centimeters is equal to one _____. the ruler measured twelve inches, or one ________.помогите пожалуйста((((
Другие предметы – 3 часа назад
Помогите пожалуйста .человек свободен в выборе направления своих действий. деятельность человека подчинена объективным социальным законам.не противоречат ли друг другу эти утверждения?
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
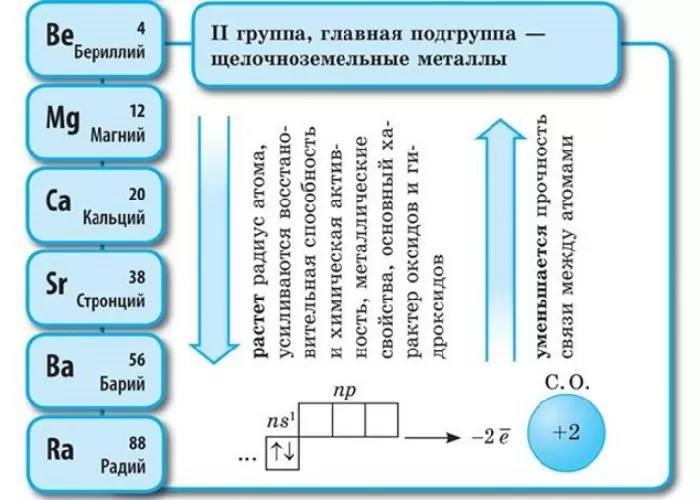
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
бериллий Be;
магний Mg;
кальций Ca;
стронций Sr;
барий Ba;
радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
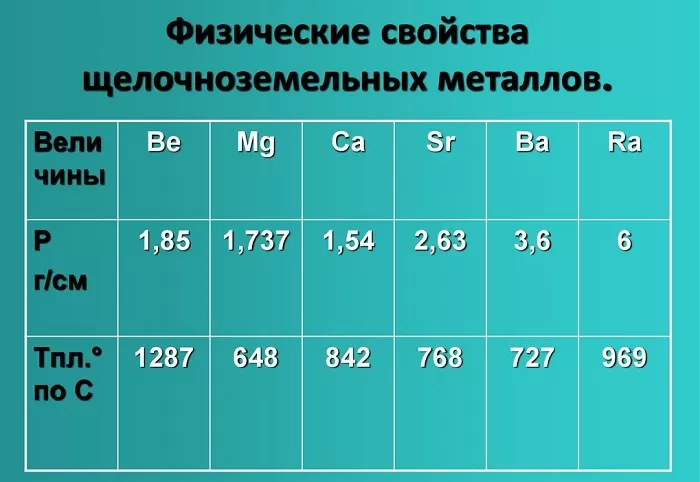
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:

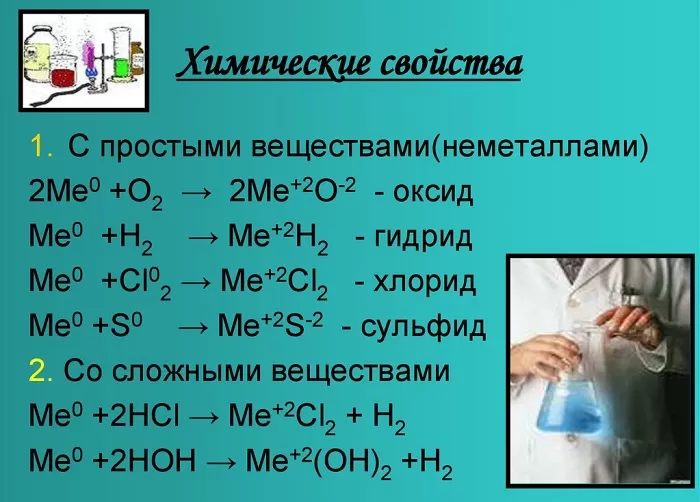
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
С кислородом образуют реакцию горения и оксид:
2Mg + O2 = 2MgO.
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
Mg + 2H2O = Mg(OH)2
+ H2,
Вa + 2H2O = Вa(OH)2
+ H2.
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2
— хлорид бериллия;
Ca + Br2 = CaBr2
— бромид кальция;
Sr + H2 = SrH2
— гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Ca — темно-оранжевый;
Sr — насыщенный красный;
Ba – светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Источник
К щелочноземельным металлам относятся металлы IIA группы Периодической системы Д.И. Менделеева – кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Кроме них в главную подгруппу II группы входят бериллий (Be) и магний (Mg). На внешнем энергетическом уровне щелочноземельных металлов находится два валентных электрона. Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов – ns2. В своих соединениях они проявляют
единственную степень окисления равную +2. В ОВР являются восстановителями, т.е. отдают электрон.
С увеличением заряда ядра атомов элементов, входящих в группу щелочноземельных металлов, энергия ионизации атомов уменьшается, а радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются.
Физические свойства щелочноземельных металлов
В свободном состоянии Be – металл серо-стального цвета, обладающий плотной гексагональной кристаллической решеткой, достаточно твердый и хрупкий. На воздухе Be покрывается оксидной пленкой, что придает ему матовый оттенок и снижает его химическую активность.
Магний в виде простого вещества представляет собой белый металл, который, также, как и Be, при нахождении на воздухе приобретает матовый оттенок за счет образующейся оксидной пленки. Mg мягче и пластичнее бериллия. Кристаллическая решетка Mg – гексагональная.
Ca, Ba и Sr в свободном виде – серебристо-белые металлы. При нахождении на воздухе мгновенно покрываются желтоватой пленкой, которая представляет собой продукты их взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, Ba и Sr – мягче.
Ca и Sr имею кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку.
Все щелочноземельные металлы характеризуются наличием металлического типа химической связи, что обуславливает их высокую тепло- и электропроводность. Температуры кипения и плавления щелочноземельных металлов выше, чем щелочных металлов.
Получение щелочноземельных металлов
Получение Be осуществляют по реакции восстановления его фторида. Реакция протекает при нагревании:
BeF2 + Mg = Be + MgF2
Магний, кальций и стронций получают электролизом расплавов солей, чаще всего – хлоридов:
CaCl2 = Ca + Cl2↑
Причем, при получении Mg электролизом расплава дихлорида для понижения температуры плавления в реакционную смесь добавляют NaCl.
Для получения Mg в промышленности используют металло- и углетермические методы:
2(CaO×MgO) (доломит) + Si = Ca2SiO4 + Mg
Основной способ получения Ba – восстановление оксида:
3BaO + 2Al = 3Ba + Al2O3
Химические свойства щелочноземельных металлов
Поскольку в н.у. поверхность Be и Mg покрыта оксидной пленкой – эти металлы инертны по отношению к воде. Ca, Sr и Ba растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства:
Ba + H2O = Ba(OH)2 + H2↑
Щелочноземельные металлы способны реагировать с кислородом, причем все они, за исключением бария, в результате этого взаимодействия образуют оксиды, барий
– пероксид:
2Ca + O2 = 2CaO
Ba + O2 = BaO2
Оксиды щелочноземельных металлов, за исключением бериллия, проявляют основные свойства, Be – амфотерные свойства.
При нагревании щелочноземельные металлы способны к взаимодействию с неметаллами (галогенами, серой, азотом и др.):
Mg + Br2 =2MgBr
3Sr + N2 = Sr3N2
2Mg + 2C = Mg2C2
Ca +S = CaS
2Ba + 2P = Ba3P2
Ba + H2 = BaH2
Щелочноземельные металлы реагируют с кислотами – растворяются в них:
Ca + 2HCl = CaCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Бериллий реагирует с водными растворами щелочей – растворяется в них:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑
Качественные реакции
Качественной реакцией на щелочноземельные металлы является окрашивание пламени их катионами: Ca2+ окрашивает пламя в темно-оранжевый цвет, Sr 2+ — в темно-красный, Ba2+ — в светло-зеленый.
Качественной реакцией на катион бария Ba2+ являются анионы SO42-, в результате чего образуется белый осадок сульфата бария
(BaSO4), нерастворимый в неорганических кислотах.
Ba2+ + SO42- = BaSO4↓
Примеры решения задач
Источник
