Какое свойство молекул доказывает диффузия

Научные опыты, с давних пор проводимые учеными всего мира, однозначно доказали, что частицы, из которых состоят все тела, находятся в постоянном движении.

Учение об этих мельчайших частичках, из которых состоит любое вещество (твердое, жидкое, газообразное), возникло в эпоху расцвета древних культур задолго до нашей эры. Знаменитые ученые и философы Демокрит, Эпикур, Анаксагор, Лукреций и другие сходились во мнении, что все состоит из мельчайших неделимых атомов, и разнообразные атомы образуют соответствующие разнообразные вещества. Ответ на вопрос: “Какие явления подтверждают движение молекул?” был найден позднее. В современную молекулярно-кинетическую теорию эти зародыши идей начинают оформляться только в XVIII веке нашей эры.
Какие явления подтверждают движение молекул?
Догадываться о том, что молекулы хаотично движутся, ученые начали давно. Но чтобы догадки стали чем-то более серьезным и получили научное обоснование, физики должны были себе и всему миру ответить на вопрос: “Какие явления подтверждают движение молекул?”
- Первое, что приходит в голову — это растворение.
- Второе — испарение.
- И третье, самое сложное — диффузия.
Диффузия
Диффузия — это взаимное проникновение молекул одного вещества в межмолекулярные пустоты другого вещества. В переводе с латыни термин “диффузия” обозначает “растекание, распространение”.
Частицы, из которых состоят тела (газообразные, жидкие, твердые), находятся на определенном расстоянии друг от друга и постоянно движутся.
Интересно, что большую часть объема всякого тела занимает свободное пространство. Чтобы понять масштаб, можно представить ядро атома в виде небольшого лесного ореха, тогда орбиты электронов этого атома будут приблизительно равны размерам большого катка или огромного бассейна.
Диффузия в газах
Быстрее всего происходит движение молекул в газах. При этом частицы движутся хаотично.
Диффузия происходит как между однородными газами, так и между газами, разными по концентрации.
Диффузия в жидкостях
Связь между молекулами жидкостей более прочная, чем в газах.

Если в стакан, наполовину наполненный раствором медного купороса, медленно и аккуратно добавить прозрачной воды, то сначала граница между синей и прозрачной жидкостью будет обозначена четко и резко. Спустя совсем небольшой промежуток времени вода начнет голубеть, граница размываться, а позже жидкость станет светло-голубой и практически однородной.
Диффузия в твердых телах
Движение молекул в твердых телах протекает очень медленно. Но все же, если, например, наплавить небольшое количество золота на свинцовый стержень и оставить его так при температуре не менее 300 градусов, то по прошествии суток молекулы золота проникнут в межмолекулярные пустоты свинца примерно на сантиметр.
Диффузия в условиях нагревания
При нагревании диффузия происходит намного быстрее, следовательно, можно сделать вывод, что чем выше поднимается температура тела, тем выше становится скорость движения молекул. Соответственно, чем быстрее движутся молекулы, тем выше поднимается температура тела. При температуре, близкой к абсолютному нулю, скорость движения частиц максимально снижается.
Примеры диффузии
Примеры диффузии встречаются в быту, в промышленности, в жизни человека и животных:

- процессы сварки и пайки;
- производство металлических сплавов;
- дыхание рыб и наземных беспозвоночных;
- поступление питательных веществ из кишечника в кровь;
- заражение вирусами и инфекциями;
- курение;
- извлечение сахара из свеклы и тростника;
- распространение запахов (парфюмерная промышленность, ароматерапия, религиозные обряды);
- общение насекомых;
- поражение слезоточивым и другими ядовитыми газами, газовые камеры в концлагерях;
- загрязнение окружающей среды;
- заваривание настоев, чая и кофе, приготовление настоек, компотов, сиропов, растворение сахара и соли;
- смешивание коктейлей;
- соление и маринование овощей и других продуктов;
- слезы от лука.
Диффузия: тест
- Какие явления подтверждают движение молекул? а) растворение, испарение, диффузия; б) диффузия, нагревание, склеивание.
- Может ли капля растительного масла покрыть океан? а) да; б) нет, она растечется настолько, насколько позволит толщина в одну молекулу.
- В каких телах диффузия течет быстрее? а) в газах; б) в жидкостях; в) в твердых телах; г) не имеет значения.
- Нагреваясь, жидкости, металлы и газы в объеме: а) увеличиваются; б) уменьшаются; в) не изменяются.
- Одинакова ли скорость молекул в неподвижном воздухе в жару и мороз? а) в мороз быстрее; б) в жару медленнее; в) в мороз медленнее; г) скорость не меняется.
- Какой вывод можно сделать, изучив материал о диффузии: а) молекулы всех веществ на Земле неподвижны; б) молекулы всех веществ движутся с той или иной скоростью.
- Зависит ли диффузия от температуры тел: а) с повышением температуры диффузия начинает протекать медленнее; б) с повышением температуры диффузия начинает происходить быстрее; в) диффузия никак не зависит от температуры.
Ответы: I — а; II — б; III — а; IV — а; V — в; VI — б; VII — б.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 апреля 2020; проверки требуют 11 правок.
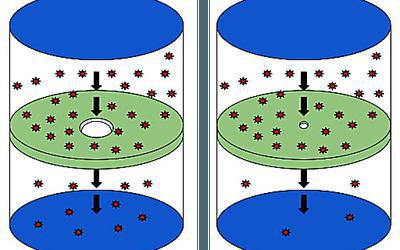
схема осмоса через полупроницаемую мембрану
Диффу́зия (лат. diffusio «распространение, растекание, рассеивание; взаимодействие») — процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого вещества, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму[1]. В некоторых ситуациях одно из веществ уже имеет выровненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (противоположно направлению вектора градиента концентрации).
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения. Важную роль диффузия частиц играет в физике плазмы.
Скорость протекания диффузии зависит от многих факторов. Так, в случае металлического стержня тепловая диффузия проходит с огромной скоростью. Если же стержень изготовлен из материала с низкой теплопроводностью (например, стекла), тепловая диффузия протекает медленно. Диффузия молекул в общем случае протекает ещё медленнее. Например, если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, Роберт Бойль показал, что если медь покрыть золотом, то будет происходить диффузия золота в медь. При этом при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет.[2] Другой пример – систематические исследования диффузии свинца в золото, проведенные Уильямом Робертсом-Остеном и опубликованные в 1896 г. Под грузом за пять лет свинцовый слиток проник в золотой слиток на один миллиметр.[3]
Первое систематическое экспериментальное исследование диффузии было выполнено Томасом Грэмом. Он изучал диффузию в газах, и это явление (Закон Грэма) было описано им в 1831–1833 гг.[4]
Первое количественное описание процессов диффузии было дано немецким физиологом А. Фиком в 1855 году.[3]
Большой вклад в теорию и практику исследования дифузионных процессов внес Я. И. Френкель, предложив и развив в 1926 году идею диффузии локальных дефектов (вакансий и межузельных атомов).[5]
Общее описание[править | править код]
Все виды диффузии подчиняются одним законам. Скорость диффузии пропорциональна площади поперечного сечения образца, а также разности концентраций, температур или зарядов (в случае относительно небольших величин этих параметров). Так, тепло будет в четыре раза быстрее распространяться через стержень диаметром в два сантиметра, чем через стержень диаметром в один сантиметр. Это тепло будет распространяться быстрее, если перепад температур на одном сантиметре будет 10 °C вместо 5 °C. Скорость диффузии пропорциональна также параметру, характеризующему конкретный материал. В случае тепловой диффузии этот параметр называется теплопроводность, в случае потока электрических зарядов — электропроводность. Количество вещества, которое диффундирует в течение определённого времени, и расстояние, проходимое диффундирующим веществом, пропорциональны квадратному корню продолжительности диффузии.
Диффузия представляет собой процесс на молекулярном уровне и определяется случайным характером движения отдельных молекул[6]. Скорость диффузии в связи с этим пропорциональна средней скорости молекул. В случае газов средняя скорость малых молекул больше, а именно она обратно пропорциональна квадратному корню из массы молекулы и растёт с повышением температуры. Диффузионные процессы в твёрдых телах при высоких температурах часто находят практическое применение. Например, в определённых типах электронно-лучевых трубок (ЭЛТ) применяется металлический торий, продиффундировавший через металлический вольфрам при 2000 °C.
Если в смеси газов масса одной молекулы в четыре раза больше другой, то такая молекула передвигается в два раза медленнее по сравнению с её движением в чистом газе. Соответственно, скорость диффузии её также ниже. Эта разница в скорости диффузии лёгких и тяжёлых молекул применяется, чтобы разделять субстанции с различными молекулярными весами. В качестве примера можно привести разделение изотопов. Если газ, содержащий два изотопа, пропускать через пористую мембрану, более лёгкие изотопы проникают через мембрану быстрее, чем тяжёлые. Для лучшего разделения процесс производится в несколько этапов. Этот процесс широко применялся для разделения изотопов урана (отделение 235U от основной массы 238U). Поскольку такой способ разделения требует больших энергетических затрат, были развиты другие, более экономичные способы разделения. Например, широко развито применение термодиффузии в газовой среде. Газ, содержащий смесь изотопов, помещается в камеру, в которой поддерживается пространственный перепад (градиент) температур. При этом тяжёлые изотопы со временем концентрируются в холодной области.
Модели диффузии[править | править код]
Уравнения Фика[править | править код]
С точки зрения термодинамики движущим потенциалом любого выравнивающего процесса является рост энтропии. При постоянных давлении и температуре в роли такого потенциала выступает химический потенциал , обусловливающий поддержание потока вещества. При этом поток частиц вещества пропорционален концентрации и градиенту потенциала:
~
Используя разложение химического потенциала по степеням концентрации, справедливое для газов и слабых растворов,
= …
можно показать, что ведущий член в выражении для потока частиц
которая показывает, что плотность потока вещества (измеренное, например, в моль·см-2с-1) пропорциональна коэффициенту диффузии [см2·с-1] и градиенту концентрации. Это уравнение выражает первый закон Фика. Второй закон Фика связывает пространственное и временно́е изменения концентрации (уравнение диффузии):
Коэффициент диффузии зависит от температуры. В ряде случаев в широком интервале температур эта зависимость представляет собой соотношение Эйнштейна.
Дополнительное поле, наложенное параллельно градиенту химического потенциала, нарушает стационарное состояние. В этом случае диффузионные процессы описываются нелинейным уравнением Фоккера — Планка. Процессы диффузии имеют большое значение в природе:
- питание, дыхание животных и растений;
- проникновение кислорода из крови в ткани человека.
Геометрическое описание уравнения Фика[править | править код]
Во втором уравнении Фика в левой части стоит скорость изменения концентрации во времени, а в правой части уравнения — вторая частная производная, которая выражает пространственное распределение концентрации, в частности, выпуклость функции распределения температуры, проецируемую на ось .
Уравнения Онзагера для многокомпонентной диффузии и термодиффузии[править | править код]
Законы Фика применимы для случая малых значений концентраций и градиентов концентрации .
В 1931 году Ларс Онзагер[7] предложил модель для описания процессов переноса многокомпонентной среды в случае линейных термодинамических неравновесных систем:
Здесь — поток i-й компоненты и — термодинамическая сила, — матрица кинетических коэффициентов.
Термодинамическая сила по Онзагеру определяется как градиент от частной производной энтропии (термин «сила» Онзагер брал в кавычки, поскольку здесь подразумевается «движущая сила»):
где — «термодинамические координаты».
Для тепло- и массопереноса мы можем положить (плотность внутренней энергии) и это концентрация -ой компоненты. Соответствующее значение движущих сил в таком случае выражаются следующим образом:
поскольку
Здесь — температура и — химический потенциал i-й компоненты. Следует отметить, что данное рассмотрение приводится без учета движения среды, поэтому мы здесь пренебрегаем членом с производной давления. Такое рассмотрение возможно в случае малых концентраций примесей с малыми градиентами.
В линейном приближении вблизи точки равновесия мы можем выразить термодинамические силы следующим образом:
Матрица кинетических коэффициентов должна быть симметричной (Теорема Онзагера) и положительно определенной (в случае роста энтропии).
Транспортное уравнение в таком случае может быть записано в следующем виде:
Здесь индексы относятся к внутренней энергии (0) и разным компонентам. Выражение в квадратных скобках является матрицей диффузионных(), термодиффузионных (, ) и температуропроводных () коэффициентов.
В изотермическом случае () и термодинамический потенциал выражается через свободную энергию (или свободную энтропию (англ.)русск.). Термодинамическая движущая сила для изотермичной диффузии определяется отрицательным градиентом химического потенциала , и матрица диффузионных коэффициентов выглядит следующим образом:
().
Существует произвол в выборе определения для термодинамических сил и кинетических коэффициентов, поскольку мы не можем измерить их отдельно, а только их комбинацию . Например, в оригинальной работе Онзагер[7] использовал дополнительный множитель (), тогда как в курсе теоретической физики Ландау и Лифшица[8] этот множитель отсутствует и сила имеет противоположный знак. Это различие можно учесть в формулах для вывода коэффициентов так, что они не повлияют на результаты измерения.
Недиагональная диффузия должна быть нелинейной[править | править код]
Формализм линейной необратимой термодинамики (Онзагера) генерирует систему линейных уравнений диффузии в виде
Если матрица коэффициентов диффузии диагональна, то эта система уравнений является лишь системой независимых уравнений Фика для различных компонент. Предположим, что диффузия не является диагональной, например, , и рассмотрим состояние, в котором . В этом состоянии . Если в некоторой точке то в течение короткого времени становится отрицательным в этой точке. Поэтому линейная недиагональная диффузии не сохраняет положительность концентраций. Недиагональные уравнения многокомпонентной диффузии должны быть нелинейными[9].
См. также[править | править код]
- Диффузия в кристалле
- Диффузия в плазме
- Диффузионное равновесие
- Вращательная диффузия
- Бомовская диффузия
- Осмос
- Солевые пальцы
- Парадокс Гиббса
- Поверхностная диффузия — процесс, связанный с перемещением частиц, происходящий на поверхности конденсированного тела в пределах первого поверхностного слоя атомов (молекул) или поверх этого слоя.
Примечания[править | править код]
- ↑ Б. С. Бокшейн. Атомы блуждают по кристаллу. С. 9—11
- ↑ L.W. Barr (1997), In: Diffusion in Materials, DIMAT 96, ed. H.Mehrer, Chr. Herzig, N.A. Stolwijk, H. Bracht, Scitec Publications, Vol.1, pp. 1–9.
- ↑ 1 2 H. Mehrer. Heroes and Highlights in the History of Diffusion // Diffusion Fundamentals. — 2009. — Т. 11, № 1. — С. 1–32.
- ↑ Diffusion Processes, Thomas Graham Symposium, ed. J.N. Sherwood, A.V. Chadwick, W.M.Muir, F.L. Swinton, Gordon and Breach, London, 1971.
- ↑ Тамм И. Е. Яков Ильич Френкель // Успехи физических наук. — 1962. — Т. LXXVI, № 3. — С. 414.
- ↑ J. Philibert (2005). One and a half century of diffusion: Fick, Einstein, before and beyond. Архивная копия от 13 декабря 2013 на Wayback Machine Diffusion Fundamentals, 2, 1.1-1.10.
- ↑ 1 2 Onsager L. Reciprocal Relations in Irreversible Processes. I (англ.) // Physical Review : journal. — 1931. — Vol. 37, no. 4. — P. 405—426. — doi:10.1103/PhysRev.37.405. — Bibcode: 1931PhRv…37..405O.
- ↑ Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — Издание 5-е. — М.: Физматлит, 2005. — 616 с. — («Теоретическая физика», том V). — ISBN 5-9221-0054-8.
- ↑ A.N. Gorban, H.P. Sargsyan and H.A. Wahab. Quasichemical Models of Multicomponent Nonlinear Diffusion (англ.) // Mathematical Modelling of Natural Phenomena : journal. — 2011. — Vol. 6, no. 5. — P. 184—262. — doi:10.1051/mmnp/20116509.
Литература[править | править код]
- Бокштейн Б. С. Атомы блуждают по кристаллу. — М.: Наука, 1984. — 208 с. — (Библиотечка «Квант». Вып. 28). — 150 000 экз.
Ссылки[править | править код]
- Диффузия примесных атомов на поверхности монокристалла
- Диффузия. Статья из Химической энциклопедии
Источник
Что такое диффузия?
Само слово «диффузия» латинского происхождения – «diffusio» в переводе с латыни означает «распространение, рассеивание». В физике под диффузией подразумевается процесс взаимопроникновения микрочастиц при соприкосновении разных материалов. Академическое определение того, что такое диффузия, звучит следующим образом: «Диффузия – это взаимное проникновение молекул одного вещества в межмолекулярные промежутки другого вещества вследствие их хаотичного движения и столкновения друг с другом». Какие свойства диффузии, причины ее возникновения, как проявляется этот процесс в разных веществах, об этом читайте далее.
Причины диффузии
Причиной возникновения диффузии является тепловое движение частиц (атомов, молекул, ионов и т. д.).
Чтобы более детально понять, как работают механизмы диффузии, рассмотрим это явление на конкретном примере. Если взять перманганат калия (в народе более известен как марганцовка) (KMnO4) и растворить в воде (H2O), то марганцовка в результате диссоциации распадется на K+ и MnO4-. Также важно заметить что молекула воды поляризирована и существует в виде сцепленных ионов H+ – OH-.
Из-за растворения марганцовки в воде произойдет хаотическое перемещение ионов обоих веществ, вследствие чего сцепленные ионы воды поменяют свой цвет и освободят место для других, еще не реагировавших ионов. Вода поменяет свой окрас и получит специфические свойства. Между водой и марганцовкой совершится диффузия.
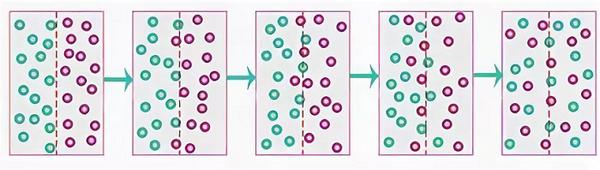
Вот так этот процесс выглядит схематически.
Причем движимые частицы во время диффузии, всегда распространяются равномерно по всему предоставленному объему. Сам процесс диффузии занимает определенное время.
Также важно знать, что явление диффузии происходит далеко не со всеми веществами. Например, если воду перемешать не с марганцовкой, а с маслом, то диффузии между ними не будет, так как молекулы масла электрически нейтральны. Образованию какого-то соединения с молекулами воды помешают сильные связи внутри молекулы масла.
Еще стоит заметить, что скорость диффузии значительно увеличится при увеличении температуры, что вполне логично, ведь с увеличением температуры возрастет скорость движения частиц внутри вещества и как следствие, повышается шанс их проникновения в молекулы другого вещества.
Формула диффузии
Процесс диффузии в двухкомпонентной системе записывается при помощи закона Фика, и соответствующего уравнения:
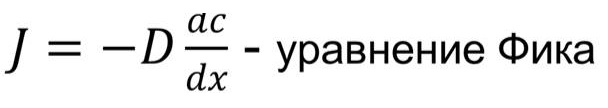
В этом уравнении J – плотность материала, D – коэффициент диффузии, а ac/dx – градиент концентрации двух веществ.
Коэффициентом диффузии называют физическую величину, которая численно равна количеству диффундирующего вещества, которое проникает за единицу времени через единицу поверхности, если разность плотностей на двух поверхностях, находящихся на расстоянии равном единице длины, равна единице. Важно заметить, что коэффициент диффузии зависит от температуры.
Диффузия в твердых телах
В твердых телах диффузия происходит очень медленно, если вообще происходит. Ведь для твердых тел характерно наличие кристаллической решетки, а все частицы расположены упорядочено.
Примером диффузии твердых тел может быть золото и свинец. Расположенные на расстояние 1 метра друг от друга, при комнатной температуре в 20 С, эти вещества будут понемногу проникать друг в друга, но будет это все идти очень медленно, подобная диффузия станет заметной не ранее чем через 4-5 лет.

Диффузия в жидкостях
Скорость протекания диффузии в жидкостях в разы выше, нежели в твердых телах. Связи между частицами в жидкости гораздо слабее (обычно их энергии хватает максимум на образование капель), и взаимному проникновению частиц в молекулы двух веществ ничто не мешает.
Правда то, как быстро будет проходить диффузия, зависит от характера и консистенции жидкостей, в более густых растворах она происходит медленнее, ведь чем гуще жидкость, тем более сильные в ней связи между молекулами и тем труднее молекулам и частицам проникать друг в друга. Например, смешивание двух жидких металлов может занять несколько часов, в то время как смешивание воды и марганцовки (из примера выше) осуществляется за минуту.

Диффузия в газах
В газах диффузия происходит еще быстрее, чем в жидкости, связи между частицами газообразных веществ практически отсутствуют, и никак не сцепленные частицы легко перемешиваются друг с другом, проникая в молекулы других газов. Небольшие коррективы при диффузии газов может вносить разве только гравитация.
Примеры диффузии в окружающем мире
Благодаря диффузии:
- поддерживается однородный состав атмосферного воздуха вблизи поверхности нашей планеты,
- происходит питание растений,
- осуществляется дыхание человека и животных.
Значимый биологический процесс – фотосинтез осуществляется, в том числе и при помощи диффузии: как мы знаем, благодаря энергии солнечного света вода разлагается хлорофиллами на составляющие, кислород, который выделяется при этом, попадает в атмосферу и поглощается всеми живыми организмами. Так вот, и сам процесс поглощения кислорода человеком и животными, и обмен веществ у растений, все это поддерживается диффузией, без которой не могла бы существовать сама Жизнь.
Но это в глобальном плане, в более простых вещах, мы можем наблюдать диффузию:
- В саду, где цветы источают свой аромат благодаря диффузии (их частицы перемешиваются с частицами окружающего воздуха).
- Растворяя сахар в чае или кофе, чай или кофе становится сладким благодаря диффузии.
- При резке лука у вас начнут слезиться глаза, происходит это тоже по причине диффузии, молекулы лука смешиваются с молекулами воздуха и ваши глаза на это реагируют.
Таких примером можно приводить еще много.
Диффузия, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Diffusion.
Источник
