Какое свойство белков лежит в основе раздражимости


КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Классификация белков. По форме молекул белки можно разделить на две большие группы – глобулярные (имеют сферическую форму) и фибриллярные (удлиненной формы). Так, глобулярными белками являются глобулины и альбумины крови, фибриноген, гемоглобин. Фибриллярные белки – кератин, коллаген, миозин и др. (рис. )
Белки, образованные только аминокислотами, называются простыми. Сложными являются белки, имеющие в своем составе компонент неаминокислотной природы. Это могут быть ионы металлов (Fe, Zn, Mg, Mn), липиды, нуклеотиды, сахара и др. Простыми белками являются сывороточный альбумин крови, фибрин, некоторые ферменты (трипсин) и др. Сложными белками являются липопротеины и гликопротеины (например, иммуноглобулины), а также большинство ферментов.
Денатурация и ренатурация белков[VV26] . Одно из основных свойств белков — способность изменять свою структуру и свойства под влиянием различных факторов (действие концентрированных кислот и щелочей, высокая температура и др.). Процесс нарушения природной конформации белков под влиянием каких-либо факторов без нарушения первичной структуры называется денатурацией(от лат. де — приставка, означающая потерю, и натура — природные свойства) (рис. ). Изменение структуры белка происходит вследствие разрыва водородных и ионных связей, стабилизирующих пространственные структуры. При денатурации могут утрачиваться четвертичная, третичная и даже вторичная структура. Денатурация сопровождается потерей биологической активности белка. При этом наблюдается уменьшение растворимости белка, изменение формы и размеров молекул, потеря ферментативной активности и т.д. Денатурирующими агентами являются: высокая температура, кислоты и щелочи, мочевина, спирты, фенол, хлорамин, соли тяжелых металлов и др.[VV27] Так, соли тяжелых металлов (кадмия, ртути и др.) при взаимодействии с белками образуют нерастворимые соединения, и белки выпадают в осадок.
Как правило, денатурация имеет необратимый характер. Хотя на первых ее стадиях, при условии прекращения действия повреждающих факторов, белок может восстановить свое первоначальное состояние. Это явление называется ренатурацией(от лат. ре — приставка, обозначающая возобновление). В организмах обычно наблюдается частичная обратимая денатурация белков.
Способность белков к обратимому изменению своей структуры в ответ на действие физических и химических факторов лежит в основе важнейшего свойства всех живых систем — раздражимости.
Под влиянием некоторых факторов (воздействие формалина, спирта, щелочей и др.) может происходит разрушение первичной структуры. Процесс разрушения первичной структуры белков, называемый деструкцией(от лат. де — и структура — строение), всегда необратимый.
Явление денатурации часто используется в биологических исследованиях и в медицине. При определении в биологическом материале низкомолекулярных соединений из раствора сначала удаляют белки. Для этого вызывают их денатурацию, осаждают или отфильтровывают.
В медицине денатурирующие агенты часто применяются для стерилизации медицинских инструментов и материалов в автоклавах (здесь денатурирующий агент – высокая температура). Их используют также в качестве антисептиков (спирт, фенол, хлорамин и др.) для очистки загрязненных материалов и поверхностей. То же происходит при обеззараживании ран, ссадин, царапин раствором йода или спиртом. На денатурации белков основано применение мышьяковистого ангидрида в стоматологической практике при лечении пульпита.
Функции белков. Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций, как структурных, так и метаболических.
Структурная.Белки входят в состав всех биологических мембран и органоидов клетки. Преимущественно из белков состоят хрящи, сухожилия. В их состав входит белок коллаген. Кератин – компонент перьев, волос, ногтей, когтей, рогов, копыт у высших животных. Эластин является компонентом связок, стенок кровеносных сосудов.
Каталитическая (ферментативная).Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетках живых организмов в сотни миллионов раз. Ферменты участвуют как в процессах синтеза, так и распада веществ. Они обеспечивают расщепление питательных веществ в пищеварительном тракте, фиксацию углерода при фотосинтезе и т.д.
Механизм действия ферментов объясняет теория активного центра.Согласно ей, в молекуле каждого фермента имеется один или более участков, в которых происходит тесный контакт между молекулами фермента и специфического вещества — субстрата (рис.). Активным центром выступает функциональная группа (например, ОН-группа серина), отдельная аминокислота либо сочетание нескольких (в среднем от 3 до 12), расположенных в определенном порядке аминокислотных остатков. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу точного соответствия их пространственных структур (как ключ и замок).
Молекула фермента вызывает ослабление определенных химических связей субстрата, и катализируемая реакция происходит с меньшими начальными затратами энергии, а следовательно, с намного большей скоростью. Ферменты ускоряют ход реакции без изменения ее общего результата за счет снижения энергии активации, т.е. в их присутствии затрачивается значительно меньше энергии для придания молекулам реакционной способности.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается собразованием конечных продуктов и свободного фермента, который сохраняет исходную структуру и свойства. Освободившийся при этом активный центр может принимать следующие новые молекулы субстрата. Именно поэтому ферменты требуются в крайне низких концентрациях.
Некоторые ферменты, помимо активного центра, имеют один или несколько регуляторных центров. С этими участками могут связываться молекулы, регулирующие активность фермента. Они носят название активаторов (от лат. активус — деятельностный).
Молекулы некоторых веществ, взаимодействуя с ферментом, снижают или блокируют его активность (рис. ). Такие вещества называются ингибиторами(от лат. ингибео – сдерживаю, останавливаю). Например, многие лекарственные препараты природного или синтетического происхождения являются ингибиторами определенных ферментов. Кроме того, в основе действия некоторых токсических веществ лежит ингибирование активного центра ферментов.
Транспортная.Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Молекулы белков, входящие в состав цитоплазматической мембраны, принимают участие в транспорте веществ в клетку и из нее.
Сократительная (или двигательная).Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин – обеспечивают работу мышц и немышечные внутриклеточные сокращения. Белок тубулин входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
Регуляторная.Некоторые пептиды и белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин регулирует содержание глюкозы в крови. Глюкагон регулирует расщепление гликогена до глюкозы, повышая ее содержание в крови.
Сигнальная.Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача информации в клетку. Примером может служить фитохром — светочувствительный белок, регулирующий фотопериодическую реакцию растений, и onсин — составная часть пигмента родопсина, находящегося в клетках сетчатки глаза.
Защитная.Специфические белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так в ответ на проникновение чужеродных тел — антигенов — в клетке вырабатываются антитела— особые белки, называемые иммуноглобулинами, которые обеспечивают иммунитет. Интерфероны защищают организм от вирусной инфекции. Фибриноген, тромбопластин и тромбин участвуют в свертывании крови и предотвращении кровопотери.
Токсическая.Многие живые существа в качестве собственной защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются ядами для других организмов. Токсины синтезируются в организме некоторых змей, лягушек, насекомых, грибов, растений, бактерий. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Энергетическая.Белки могут служить источником энергии в клетке (после гидролиза). При полном окислении 1 г белка выделяется 17,6 кДж энергии. Белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
С[VV28] белками могут взаимодействовать некоторые вещества и подавлять их функции. Такие вещества называются ингибиторами. Ингибиторами белковых функций являются многие яды. Так, например, ингибиторами белков-рецепторов постсинаптической мембраны, которые связываются с медиатором ацетилхолином при передаче нервного импульса в синапсах, являются мускарин (токсин мукора) и никотин. При этом нарушается проведение нервного импульса. Подобное действие оказывает также атропин – вещество, содержащееся в растениях красавки и белены. Атропин является ингибитором М-холинорецепторов. Учитывая, что связывание ацетилхолина с М-холинорецепторами вызывает сокращение многих гладких мышц, атропин используется как лекарственное средство, снимающее их спазм (спазмолитик). Однако при передозировке атропином могут наблюдаться двигательное и психическое возбуждение, галлюцинации, признаки понижения тонуса гладких мышц радужной оболочки глаз, бронхов, органов брюшной полости. Такой же эффект наблюдается при употреблении отваров белены (отсюда поговорка «белены объелся».
s1. Что общего и чем отличаются процессы денатурации и деструкции? 2. Чем обусловлено разнообразие свойств белков?[BЭ29] 3. Каковы основные биологические функции белков? 4. В чем состоит защитная функция белков? 5. Чем определяется двигательная функция белков? 6. Что такое ферменты? Почему без участия ферментов протекание большинства биохимических процессов в клетке было бы невозможным?
Дата добавления: 2014-01-04; Просмотров: 1930; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
Источник
Органические вещества
Органические вещества – это углеводы, липиды (жиры), белки и нуклеиновые кислоты.
В органических соединениях важным элементом выступает углерод. Многочисленные превращения молекул и образование различных крупных молекул органических соединений происходят благодаря уникальному свойству углеродных атомов. Это свойство заключается в том, что атомы углерода, имеющие четыре валентные связи, способны в определенном порядке объединяться в длинные цепи и замкнутые кольцевые структуры. Эти углеродные цепи и кольца являются “скелетами” сложных органических молекул.
Благодаря углероду возможно образование таких сложных и разнообразных соединений, как органические вещества.
В клетках живых организмов синтезируются всевозможные большие и малые органические молекулы. Малые молекулы называют мономерами (от греч. monos – “один” и meros – “часть”, “доля”). Мономеры, как строительные блоки, могут соединяться друг с другом, образуя полимеры (греч. polys – “многочисленный”). Все молекулы белков, жиров и нуклеиновых кислот являются полимерами, а углеводы могут быть и мономерами, и полимерами.
Белки
Из всех органических веществ основную массу в клетке (50–70%) составляют белки. Оболочка клетки и все ее внутренние структуры построены с участием молекул белков.
Белки, или протеины (греч. протос — первый),– это сложные (высокомолекулярные) органические вещества, молекулы которых состоят из мономеров (соединённых в цепочку аминокислот) и выполняющие в клетке важные функции. Другими словами, они представляют собой гигантские полимерные молекулы, мономерами которых являются аминокислоты.
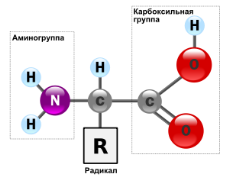 Аминокислоты — класс органических соединений, содержащих аминогруппу —NH2 и карбоксильную группу —COOH и вследствие этого проявляющих свойства как кислот, так и оснований.
Аминокислоты — класс органических соединений, содержащих аминогруппу —NH2 и карбоксильную группу —COOH и вследствие этого проявляющих свойства как кислот, так и оснований.
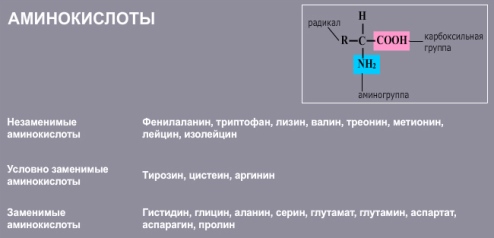
20 важнейших аминокислот служат мономерными звеньями, из которых построены все белки, соответствуют общей формуле RCH(NH2)COOH. Различают заменимые, незаменимые и условно заменимые аминокислоты.
Незаменимые аминокислоты не синтезируются в организме, а поступают в него в составе белков пищи. Их отсутствие или недостаток приводит к остановке роста, нарушениям обмена веществ и даже к гибели организма. Условно заменимые аминокислоты могут синтезироваться в организме из других аминокислот. Заменимые аминокислоты способны синтезироваться в организме в необходимом количестве.
При биосинтезе белка порядок и последовательность расположения аминокислот задаются последовательностью нуклеотидов ДНК.
В природе известно более 150 различных аминокислот, но в построении белков живых организмов обычно участвуют только 20. Благодаря особенностям своего химического строения аминокислоты способны соединяться друг с другом, образуя так называемую первичную структуру белка. Уникальность (специфичность) белка определяется именно последовательностью соединения определенных аминокислот.
Молекулы белков могут образовывать не только первичную структуру, но и вторичную, третичную и четвертичную. Рассмотрим возможные структуры белков на примере гемоглобина. Длинная нить последовательно присоединенных друг к другу аминокислот представляет первичную структуру молекулы белка (она отображает его химическую формулу). Обычно эта длинная нить туго скручивается в спираль, витки которой прочно соединены между собой водородными связями. Спирально скрученная нить молекулы – это вторичная структура молекулы белка. Такой белок уже трудно растянуть. Свернутая в спираль молекула белка затем скручивается в еще более плотную конфигурацию – третичную структуру. В результате такого многократного скручивания длинная и тонкая нить молекулы белка становится короче, толще и собирается в компактный комок – глобулу. Только глобулярный белок выполняет в клетке свои функции. У некоторых белков встречается еще более сложная форма – четвертичная структура.
Если нарушить структуру белка, например нагреванием или химическим воздействием, то он теряет свои качества и раскручивается. Этот процесс называется денатурацией. Если денатурация затронула только третичную или вторичную структуру, то она обратима: белок может снова закрутиться в спираль и уложиться в третичную структуру (явление ренатурации). При этом восстанавливаются функции данного белка. Это важнейшее свойство белков лежит в основе раздражимости живых систем, т.е. способности живых клеток реагировать на внешние или внутренние раздражители.
Функции белков. Многие белки выполняют роль катализаторов, которые ускоряют химические реакции, проходящие в клетке, и упорядочивают протекающие в ней процессы. Их называют ферментами. Ферменты участвуют в переносе атомов и молекул, в расщеплении и построении белков, жиров, углеводов и всех других соединений (т. е. в клеточном обмене веществ). Ни одна химическая реакция в живых клетках и тканях не обходится без участия ферментов.
| Каталитическая | Самый многочисленный и наиболее специализированный класс белков — ферменты. Они отвечают за работу точно согласованной системы взаимозависимых химических реакций, в результате совместного протекания которых возможна жизнь. Белки-ферменты ускоряют химические процессы в клетке. Все процессы в живых организмах осуществляются с помощью ферментов. Нарушение деятельности ферментов приводит к возникновению тяжёлых болезней. |
Структурная (строительная) | Белки участвуют в формировании клеточных и внеклеточных структур, например входят в состав клеточных мембран, волос (кератин), сухожилий (коллаген) и др. |
| Двигательная | Сократительные белки — актин и миозин — обеспечивают сокращения мышц у многоклеточных животных. Осуществляется движение ресничек и жгутиков у простейших животных. Перемещаются хромосомы при делении клетки. Происходит движение органов растений. |
| Транспортная | В клеточных мембранах присутствуют особые транспортные белки, способные связывать определённые вещества (глюкозу, аминокислоты) и переносить их внутрь клеток. Гемоглобин транспортирует кислород и частично углекислый газ. Белки сыворотки крови переносят различные биологически активные вещества, в том числе и гормоны, а также липиды и жирные кислоты. |
| Регуляторная | Некоторые гормоны имеют белковую природу. Например, инсулин, регулирующий уровень глюкозы в крови |
| Защитная | Иммуноглобулины (антитела) обладают способностью распознавать проникшие в организм чужеродные белки или микроорганизмы и обезвреживать их. Фибриноген и протромбин участвуют в процессе свертывания крови и предохраняют организм от кровопотерь. Токсины также отнесят к белкам, выполняющим защитную функцию |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Однако в качестве источника энергии белки используются организмом крайне редко, например, при очень длительном голодании. |
| Запасающая | Альбумин яиц и казеин молока — резервные белки животных |
| Сигнальная | В мембраны клеток встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды и передавать таким образом сигналы в клетку |
Белки выполняют в клетке множество функций: ферментативную, транспортную, структурную, защитную и другие. Без белков жизнь клетки невозможна.
Календарь
| « Ноябрь 2020 » | ||||||
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 | ||||||
Статистика
Онлайн всего: 9
Гостей: 9
Пользователей:
Источник
