Какое общее свойство есть у сахарозы и крахмала
Углеводы – группа природных органических соединений, химическая структура которых отвечает формуле
Cm(H2O)n. Входят в состав всех без исключения живых организмов.

Классификация
Углеводы подразделяются на
- Моносахариды
- Олигосахариды
- Полисахариды
Моносахариды (греч. monos — единственный + sacchar — сахар) – наиболее распространенная группа углеводов в природе,
содержащие в молекулах пять (пентозы) или шесть (гексозы) атомов углерода.
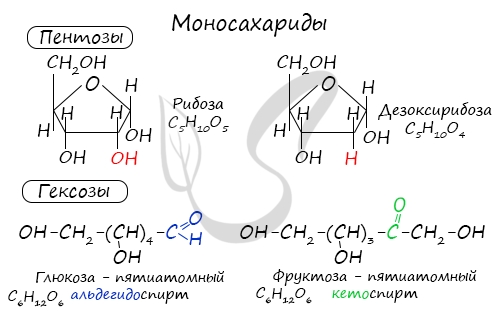
Из наиболее известных представителей к пентозам относятся рибоза и дезоксирибоза, к гексозам – глюкоза и фруктоза.
Олигосахариды (греч. ὀλίγος — немногий) – группа углеводов, в молекулах которых, содержится от 2 до 10 моносахаридных
остатков. Если в молекуле содержатся два моносахаридных остатка, ее называют дисахарид.
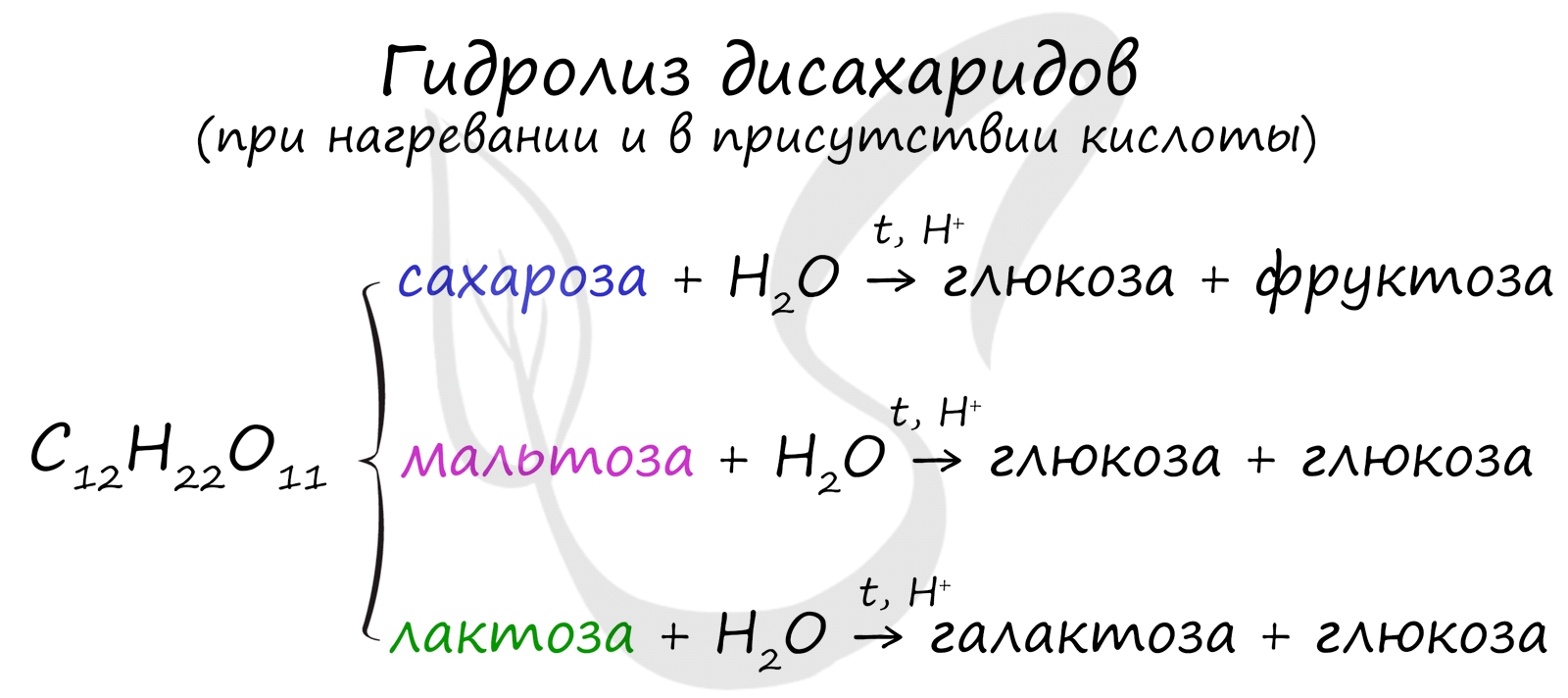
Наиболее известны следующие дисахариды: сахароза, лактоза, мальтоза. Они являются изомерами, их молекулярная
формула одинакова – C12H22O11.

Полисахариды (греч. poly – много) – природные биополимеры, молекулы которых состоят из длинных цепей (десятки, сотни
тысяч) моносахаридов.
Например, глюкоза – моносахарид, а крахмал, гликоген и целлюлоза – ее полимеры. Также к полимерам относится
хитин, пектин. Формула крахмала, целлюлозы – (C6H10O5)n

Моносахариды
Получение глюкозы возможно несколькими способами:
- Реакция Бутлерова
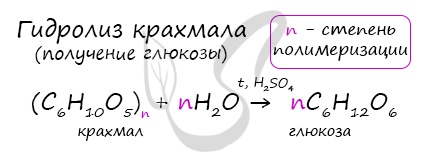
- Гидролиз крахмала
- Фотосинтез
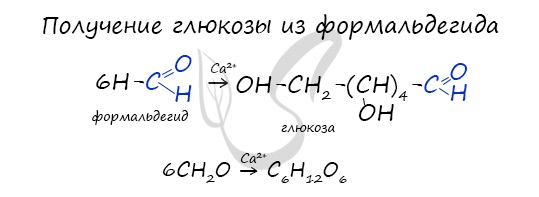
В присутствии ионов металла, молекулы формальдегида соединяются, образуя различные углеводы, например, глюкозу.
В присутствии кислоты и при нагревании, крахмал (полимер) распадается на мономеры – молекулы глюкозы.
Эту реакцию изобрела природа, для нее существует необыкновенный катализатор – солнечный свет (hν).
6CO2 + 6H2O → (hν) C6H12O6 + 6O2↑
По химическому строению глюкоза является пятиатомным альдегидоспиртом, а, значит, для нее характерны реакции и
альдегидов, и многоатомных спиртов.
- Реакции по альдегидной группе
- Реакции по гидроксогруппам
- Брожение глюкозы
Окисление глюкозы идет до глюконовой кислоты. Это можно осуществить с помощью реакций серебряного зеркала,
с гидроксидом меди II.
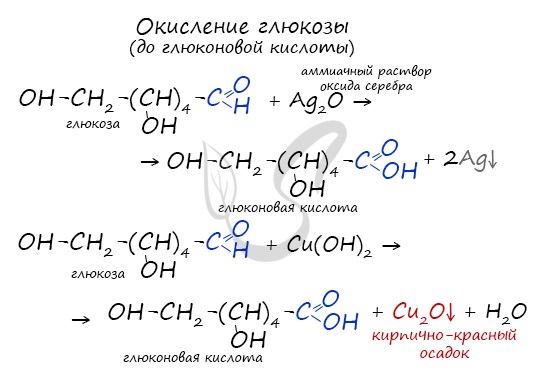
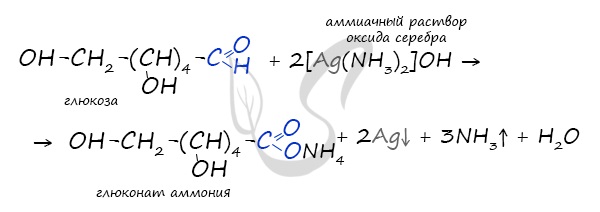
Обратите особое внимание на то, что при написании формулы аммиачного раствора в полном виде будет правильнее указать в продуктах не кислоту, а соль – глюконат аммония. Это связано с тем, что аммиак, обладающий основными свойствами, реагирует с глюконовой кислотой с образованием соли.
Восстановление глюкозы возможно до шестиатомного спирта сорбита (глюцита), применяемого в пищевой промышленности в
качестве сахарозаменителя. На вкус сорбит менее приятен, менее сладок, чем сахар.
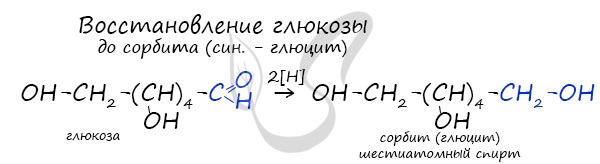
Глюкоза содержит пять гидроксогрупп, является многоатомным спиртом. Она вступает в качественную реакцию
для многоатомных спиртов – со свежеприготовленным гидроксидом меди II.
В результате такой реакции образуется характерное голубое окрашивание раствора.

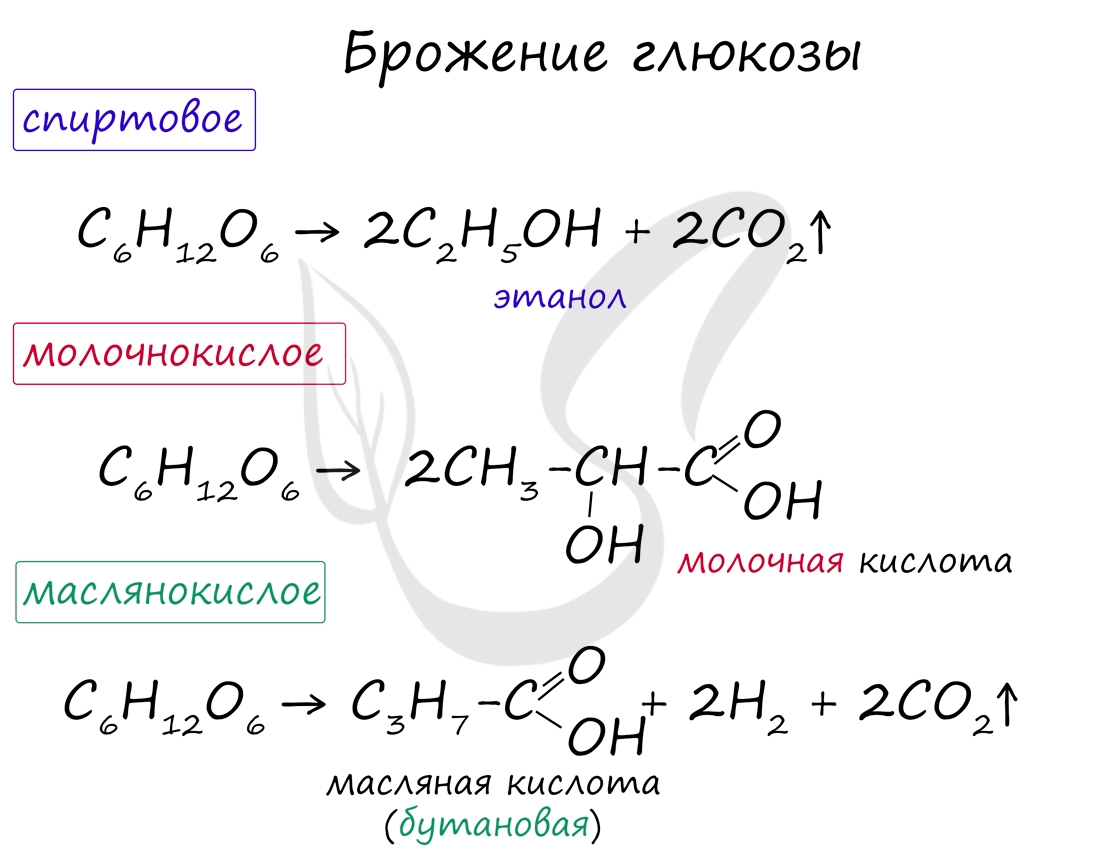
Возможны несколько вариантов брожения глюкозы: спиртовое, молочнокислое, маслянокислое. Эти виды брожения
имеют большое практическое значение и характерны для многих живых организмов, в частности бактерий.
Фруктоза является изомером глюкозы. В отличие от нее не вступает в реакции окисления – она является кетоспиртом,
а кетоны окислению до кислот не подвергаются.
Для нее характерна качественная реакция как многоатомного спирта – со свежеприготовленным гидроксидом меди II.
В реакцию серебряного зеркала фруктоза не вступает.
Применяется фруктоза как сахарозаменитель. Она в 3 раза слаще глюкозы и в 1,5 раза слаще сахарозы.

Дисахариды
Как уже было сказано ранее, наиболее известные дисахариды: сахароза, лактоза и мальтоза – имеют одну и ту же формулу –
C12H22O11.
При их гидролизе получаются различные моносахариды.

Полисахариды
Из множества реакций, более всего мне хотелось бы выделить гидролиз крахмала. В результате образуется глюкоза.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Глава 5. Углеводы
Строение дисахаридов
Наряду с моносахаридами в природе широко распространены дисахариды. Это всем хорошо известная сахароза (тростниковый или свекловичный сахар), лактоза (молочный сахар), мальтоза (солодовый сахар). Сам термин «дисахарид» красноречиво говорит о том, что в молекулах этих веществ между собой связаны два остатка моносахаридов, которые можно получить гидролизом молекулы дисахарида. Связывание двух моносахаридов в дисахарид может осуществляться либо за счёт гликозидных гидроксилов обоих моносахаридов (схема 5, а), либо с участием гликозидной гидроксильной группы одного и спиртовой гидроксильной группы другого моносахарида (схема 5, б).

В отличие от дисахаридов первого типа (а), вторые (б) обладают восстановительными свойствами.
Строение сахарозы и нахождение её в природе
Сахароза представляет собой дисахарид, образованный двумя молекулами гексоз: α-D-глюкозой и β-Б-фруктозой. В клетках растений сахароза образуется под действием ферментов за счёт отщепления молекулы воды от гликозидных гидроксилов двух моносахаридов.
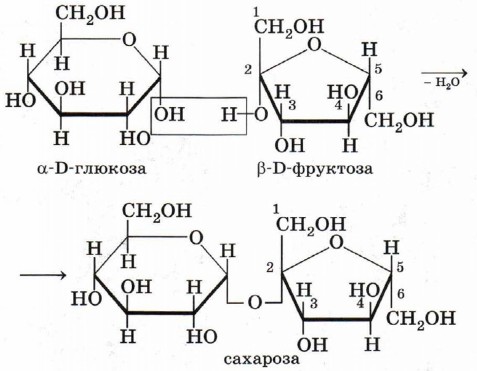
Какова молекулярная формула сахарозы? Для этого совсем необязательно считать число атомов каждого элемента в приведённой выше структурной формуле, можно поступить проще на основании элементарных рассуждений. Глюкоза и фруктоза являются изомерами, их молекулярные формулы С6Н12O6. При образовании молекулы сахарозы происходит отщепление одной молекулы воды. Остаётся вычесть из удвоенной формулы гексозы два атома водорода и атом кислорода — молекулярная формула сахарозы С12Н22О11:
C6H12O6 + C6H12O6 → C12H22O11 + Н2O.
Как вы уже знаете, образование сахарозы происходит в клетках растений под действием ферментов. Однако химики научились в пробирках осуществлять многие реакции, которые являются частью процессов, происходящих в живой природе. В 1953 г. французским химиком Р. Лемье впервые в лабораторных условиях был осуществлён синтез сахарозы, который современники назвали «покорением Эвереста органической химии ».

Конечно, подобные синтезы имеют чисто теоретическое значение, показывающее, как глубоко проникает человеческая мысль в тайны живой природы. В промышленности же сахарозу получают из сока сахарного тростника (содержание 14—16%), сахарной свёклы (16—21%) и некоторых других растений (рис. 61).
Сахароза представляет собой хорошо растворимое в воде белое кристаллическое вещество и имеет сладкий вкус.
Химические свойства сахарозы
Поскольку связь между остатками моносахаридов в сахарозе образована за счёт обоих гликозидных гидроксилов, она не обладает восстановительными свойствами и не даёт реакции «серебряного зеркала». У сахарозы сохраняются свойства многоатомных спиртов: она образует растворимые в воде сахараты с гидроксидами металлов, в частности, с гидроксидом кальция. Эта реакция используется для выделения и очистки сахарозы на сахарных заводах, о чём мы будем говорить чуть позже.
При нагревании водного раствора сахарозы в присутствии сильных кислот или под действием фермента инвертазы происходит гидролиз этого дисахарида с образованием смеси равных количеств глюкозы и фруктозы. Эта реакция обратна процессу образования сахарозы из моносахаридов:
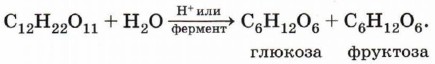
Полученная смесь называется инвертным сахаром и используется для производства карамели, подслащивания пищевых продуктов, для предотвращения кристаллизации сахарозы, получения искусственного мёда, производства многоатомных спиртов.
Производство сахарозы
Первые экспериментальные предприятия по производству сахарозы из сахарной свёклы появились в Германии и в России в 1802 г. Сложность технологии заключается в очистке сахарозы от многочисленных примесей органических веществ, присутствующих в соке растения. На помощь технологам пришли химики, предложившие использовать для этих целей замечательное свойство сахарозы — образовывать растворимый в воде сахарат кальция. Такой способ очистки получил название «известково-углекислотный метод» и широко используется на современных сахарных заводах.
На первом этапе вымытые корнеплоды измельчают в тонкую стружку и обрабатывают горячей водой. При этом в раствор помимо сахарозы переходят и другие органические вещества, главным образом, карбоновые кислоты.
Для удаления органических примесей к полученному раствору добавляют «известковое молоко» — суспензию гидроксида кальция в воде. Большинство кальциевых солей органических кислот малорастворимы и выпадают в осадок. Сахароза же образует растворимый в воде сахарат кальция и остаётся в растворе. Происходящие процессы можно условно выразить уравнениями:
2R—СООН + Са(ОН)2 → (R—СОО)2Са↓ + 2Н2O,
С12Н22О11 + Са(ОН)2 → С12Н20О11Са + 2Н2O.
Раствор сахарата кальция отделяют от осадка. Теперь необходимо вновь выделить сахарозу из сахарата. Для этого через раствор пропускают углекислый газ. Сахарат кальция разлагается на сахарозу и нерастворимый в воде карбонат кальция:
С12Н20О11Са + СO2 + Н2O —> С12Н22О11 + СаСO3↓.
Полученный после осаждения карбоната кальция раствор сахарозы упаривают в вакуумных аппаратах, выпадающие кристаллы сахарозы отделяют и высушивают. Однако полностью извлечь продукт не удаётся, часть его остаётся в растворе, который называется меласса. Этот раствор используется для получения лимонной и щавелевой кислот.
Полученная после известково-углекислотной очистки сахароза имеет желтоватый оттенок и называется сахар-сырец. Но на наш стол сахар попадает ослепительно белым. Для этого его ещё раз растворяют и нагревают с активированным углем. Красящие вещества удерживаются на поверхности угля, раствор обесцвечивается. Финалом производства является повторная кристаллизация упаренного раствора чистой сахарозы.
Вы никогда не задавались вопросом, как удаётся получить кристаллики сахарозы одного размера? Для этого в горячий концентрированный раствор вносят затравку — суспензию мелко измельчённой сахарозы в изопропиловом спирте. Каждая пылинка становится центром кристаллизации и одновременно начинает увеличиваться в размере. Задача технолога — точно рассчитать количество вносимой затравки, чтобы получились кристаллики нужного размера.
Продолжение >>>
Источник
Углеводы — органические соединения, чаще всего природного происхождения, состоящие только из углерода, водорода и кислорода.
Углеводы играют огромную роль в жизнедеятельности всех живых организмов.
Свое название данный класс органических соединений получил за то, что первые изученные человеком углеводы имели общую формулу вида Cx(H2O)y . Т.е. их условно посчитали соединениями углерода и воды. Однако позднее оказалось, что состав некоторых углеводов отклоняется от этой формулы. Например, такой углевод как дезоксирибоза имеет формулу С5Н10О4. В то же время существуют некоторые соединения, формально соответствующие формуле Cx(H2O)y, однако к углеводам не относящиеся, как, например, формальдегид (СН2О) и уксусная кислота (С2Н4О2).
Тем не менее, термин «углеводы» исторически закрепился за данным классом соединений, в связи с чем повсеместно используется и в наше время.
Классификация углеводов
В зависимости от способности углеводов расщепляться при гидролизе на другие углеводы с меньшей молекулярной массой их делят на простые (моносахариды) и сложные (дисахариды, олигосахариды, полисахариды).
Как легко догадаться, из простых углеводов, т.е. моносахаридов, нельзя гидролизом получить углеводы с еще меньшей молекулярной массой.
При гидролизе одной молекулы дисахарида образуются две молекулы моносахарида, а при полном гидролизе одной молекулы любого полисахарида получается множество молекул моносахаридов.
Химические свойства моносахаридов на примере глюкозы и фруктозы
Самыми распространенными моносахаридами являются глюкоза и фруктоза, имеющие следующие структурные формулы:
Как можно заметить, и в молекуле глюкозы, и в молекуле фруктозы присутствует по 5 гидроксильных групп, в связи с чем их можно считать многоатомными спиртами.
В составе молекулы глюкозы имеется альдегидная группа, т.е. фактически глюкоза является многоатомным альдегидоспиртом.
В случае фруктозы можно обнаружить в ее молекуле кетонную группу, т.е. фруктоза является многоатомным кетоспиртом.
Химические свойства глюкозы и фруктозы как карбонильных соединений
Все моносахариды могут реагировать в присутствии катализаторов с водородом. При этом карбонильная группа восстанавливается до спиртовой гидроксильной. Так, в частности, гидрированием глюкозы в промышленности получают искусственный подсластитель – гексаатомный спирт сорбит:
Молекула глюкозы содержит в своем составе альдегидную группу, в связи с чем логично предположить, что ее водные растворы дают качественные реакции на альдегиды. И действительно, при нагревании водного раствора глюкозы со свежеосажденным гидроксидом меди (II) так же, как и в случае любого другого альдегида, наблюдается выпадение из раствора кирпично-красного осадка оксида меди (I). При этом альдегидная группа глюкозы окисляется до карбоксильной – образуется глюконовая кислота:
Также глюкоза вступает и в реакцию «серебряного зеркала» при действии на нее аммиачного раствора оксида серебра. Однако, в отличие от предыдущей реакции вместо глюконовой кислоты образуется ее соль – глюконат аммония, т.к. в растворе присутствует растворенный аммиак:
Фруктоза и другие моносахариды, являющиеся многоатомными кетоспиртами, в качественные реакции на альдегиды не вступают.
Химические свойства глюкозы и фруктозы как многоатомных спиртов
Поскольку моносахариды, в том числе глюкоза и фруктоза, имеют в составе молекул несколько гидроксильных групп. Все они дают качественную реакцию на многоатомные спирты. В частности, в водных растворах моносахаридов растворяется свежеосажденный гидроксид меди (II). При этом вместо голубого осадка Cu(OH)2 образуется темно-синий раствор комплексных соединений меди.
Реакции брожения глюкозы
Спиртовое брожение
При действии на глюкозу некоторых ферментов глюкоза способна превращаться в этиловый спирт и углекислый газ:
Молочнокислое брожение
Помимо спиртового типа брожения существует также и немало других. Например, молочнокислое брожение, которое протекает при скисании молока, квашении капусты и огурцов:
Особенности существования моносахаридов в водных растворах
Моносахариды существуют в водном растворе в трех формах – двух циклических (альфа- и бета-) и одной нециклической (обычной). Так, например, в растворе глюкозы существует следующее равновесие:
Как можно видеть, в циклических формах отсутствует альдегидная группа, в связи с тем что она участвует в образовании цикла. На ее основе образуется новая гидроксильная группа, которую называют ацетальным гидроксилом. Аналогичные переходы между циклическими и нециклической формами наблюдаются и для всех других моносахаридов.
Дисахариды. Химические свойства.
Общее описание дисахаридов
Дисахаридами называют углеводы, молекулы которых состоят из двух остатков моносахаридов, связанных между собой за счет конденсации двух полуацетальных гидроксилов либо же одного спиртового гидроксила и одного полуацетального. Связи, образующиеся таким образом между остатками моносахаридов, называют гликозидными. Формулу большинства дисахаридов можно записать как C12H22O11.
Наиболее часто встречающимся дисахаридом является всем знакомый сахар, химиками называемый сахарозой. Молекула данного углевода образована циклическими остатками одной молекулы глюкозы и одной молекулы фруктозы. Связь между остатками дисахаридов в данном случае реализуется за счет отщепления воды от двух полуацетальных гидроксилов:
Поскольку связь между остатками моносахаридов образована при конденсации двух ацетальных гидроксилов, для молекулы сахара невозможно раскрытие ни одного из циклов, т.е. невозможен переход в карбонильную форму. В связи с этим сахароза не способна давать качественные реакции на альдегиды.
Подобного рода дисахариды, которые не дают качественные реакции на альдегиды, называют невосстанавливающими сахарами.
Тем не менее, существуют дисахариды, которые дают качественные реакции на альдегидную группу. Такая ситуация возможна, когда в молекуле дисахарида остался полуацетальный гидроксил из альдегидной группы одной из исходных молекул моносахаридов.
В частности, в реакцию с аммиачным раствором оксида серебра, а также гидроксидом меди (II) подобно альдегидам вступает мальтоза. Связано это с тем, что в её водных растворах существует следующее равновесие:
Как можно видеть, в водных растворах мальтоза существует в виде двух форм – с двумя циклами в молекуле и одним циклом в молекуле и альдегидной группой. По этой причине мальтоза, в отличие от сахарозы, дает качественную реакцию на альдегиды.
Гидролиз дисахаридов
Все дисахариды способны вступать в реакцию гидролиза, катализируемую кислотами, а также различными ферментами. В ходе такой реакции из одной молекулы исходного дисахарида образуется две молекулы моносахарида, которые могут быть как одинаковыми, так и различными в зависимости от состава исходного моносахарида.
Так, например, гидролиз сахарозы приводит к образованию глюкозы и фруктозы в равных количествах:
А при гидролизе мальтозы образуется только глюкоза:
Дисахариды как многоатомные спирты
Дисахариды, являясь многоатомными спиртами, дают соответствующую качественную реакцию с гидроксидом меди (II), т.е. при добавлении их водного раствора ко свежеосажденному гидроксиду меди (II) нерастворимый в воде голубой осадок Cu(OH)2 растворяется с образованием темно-синего раствора.
Полисахариды. Крахмал и целлюлоза
Полисахариды — сложные углеводы, молекулы которых состоят из большого числа остатков моносахаридов, связанных между собой гликозидными связями.
Есть и другое определение полисахаридов:
Полисахаридами называют сложные углеводы, молекулы которых образуют при полном гидролизе большое число молекул моносахаридов.
В общем случае формула полисахаридов может быть записана как (C6H10O5)n.
Крахмал – вещество, представляющее собой белый аморфный порошок, не растворимый в холодной воде и частично растворимый в горячей с образованием коллоидного раствора, называемого в быту крахмальным клейстером.
Крахмал образуется из углекислого газа и воды в процессе фотосинтеза в зеленых частях растений под действием энергии солнечного света. В наибольших количествах крахмал содержится в картофельных клубнях, пшеничных, рисовых и кукурузных зернах. По этой причине указанные источники крахмала и являются сырьем для его получения в промышленности.
Целлюлоза – вещество, в чистом состоянии представляющее собой белый порошок, не растворимый ни в холодной, ни в горячей воде. В отличие от крахмала целлюлоза не образует клейстер. Практически из чистой целлюлозы состоит фильтровальная бумага, хлопковая вата, тополиный пух. И крахмал, и целлюлоза являются продуктами растительного происхождения. Однако, роли, которые они играют в жизни растений, различны. Целлюлоза является в основном строительным материалом, в частности, главным образом ей образованы оболочки растительных клеток. Крахмал же несет в основном запасающую, энергетическую функцию.
Химические свойства крахмала и целлюлозы
Горение
Все полисахариды, в том числе крахмал и целлюлоза, при полном сгорании в кислороде образуют углекислый газ и воду:
Образование глюкозы
При полном гидролизе как крахмала, так и целлюлозы образуется один и тот же моносахарид – глюкоза:
Качественная реакция на крахмал
При действии йода на что-либо, в чем содержится крахмал, появляется синее окрашивание. При нагревании синяя окраска исчезает, при охлаждении появляется вновь.
При сухой перегонке целлюлозы, в частности древесины, происходит ее частичное разложение с образованием таких низкомолекулярных продуктов как метиловый спирт, уксусная кислота, ацетон и т.д.
Поскольку и в молекулах крахмала, и в молекулах целлюлозы имеются спиртовые гидроксильные группы, данные соединения способны вступать в реакции этерификации как с органическими, так и с неорганическими кислотами:
Источник
