Какое общее химическое свойство присуще сложным эфирам

Сложные эфиры являются производными карбоновых или неорганических кислот, в молекуле которых атом водорода в гидроксильной группе замещён радикалом. Такое строение обуславливает химические свойства сложных эфиров.

Виды
Сложные эфиры карбоновых кислот делятся на три общие группы:
- фруктовые эфиры – жидкости, содержащие не более восьми атомов углерода (C3H7-COO-C2H5 – этиловый эфир масляной кислоты)
- жиры – жидкие (масла) и твёрдые вещества, включающие 9-19 атомов углерода и содержащие глицерин и остатки жирных кислот;
- воски – твёрдые вещества, включающие 15-45 атомов углерода.
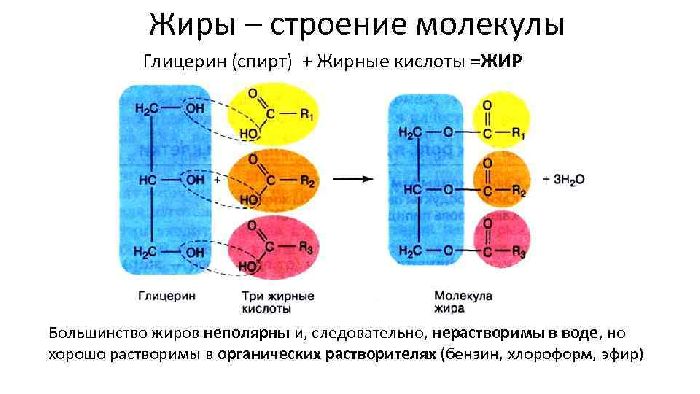
Рис. 1. Строение молекул жиров.
Привычные в быту масла – смеси, состоящие из глицерина и остатков различных жирных кислот.
Получение
Сложные эфиры получают с помощью реакции этерификации из спиртов и карбоновых кислот:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Это наиболее важная реакция, которая обратима в ряде случаев: взаимодействуя с водой, образованный сложный эфир вновь распадается на начальные вещества.
Также сложные эфиры получают взаимодействием:
- ангидридов со спиртами:
(CH3CO)2O + 2C2H5OH → 2CH3COOC2H5 + H2O;
- солей карбоновых кислот с галогенуглеводородами:
CH3(CH2)10COONa + CH3Cl → CH3(CH2)10COOCH3 + NaCl;
- карбоновых кислот к алкенам:
CH3COOH + CH2=CH2 → CH3COOCH2CH3 + H2O.
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.
Химические свойства
Свойства сложных эфиров и жиров обусловлены наличием в молекуле функциональной карбоксильной группы -COOH. Основные химические свойства эфиров представлены в таблице.
Реакция | Описание | Уравнение |
Гидролиз | Обратная реакция этерификации – расщепление в водной среде на спирт и кислоту. При нагревании с водой в кислой среде разлагаются на кислоту и спирт. Эфиры «омыляются» под действием раствора щёлочи, образуя органическую соль и спирт. В этом случае реакция необратима |
|
Восстановление (гидрирование) | При присоединении водорода сложные спирты восстанавливаются до спиртов | СН3-СОО-CH2-CH3 (этилацетат) + 2H2 → 2C2H5OH (этанол) |
Присоединение (галогенирование) | Реакция возможна при наличии в молекуле двойных связей. Атомы галогенов присоединяются к местам разрыва связей | СН3СООСН=СН2 (виниловый эфир уксусной кислоты) + Br2 → Br-CH2-C H(Br)-COOH-CH2 |
Замещение | При взаимодействии с аммиаком группа -СОН замещается аминогруппой. Образуются амид и спирт | CH3-COO-CH3 (метилацетат) + NH3 → CH3-C(NH2)=O (амид уксусной кислоты) + CH3-OH (метанол) |
Горение | При полном сгорании образуется углекислый газ и вода | 2CH3-COO-CH3 + 7O2 → 6CO2 + 6H2O |
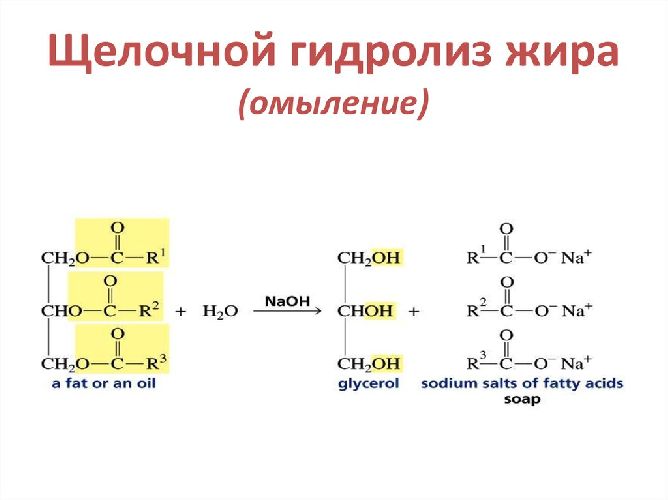
Рис. 2. Схема омыления жиров.
Сложные эфиры применяются в качестве ароматизаторов в медицине, парфюмерии, пищевой промышленности. Они входят в состав ягод, фруктов, пчелиного воска.

Рис. 3. Эфирные масла.
Что мы узнали?
Сложные эфиры в зависимости от строения являются жидкостями или твёрдыми веществами. Свойства соединений обуславливаются наличием карбоксильной группы -СООН. Сложные эфиры вступают в реакции горения, замещения, присоединения, восстановления. Под действием воды разлагаются на карбоновые кислоты и спирты (реакция обратная этерификации).
Тест по теме
Оценка доклада
Средняя оценка: 4.2. Всего получено оценок: 76.
Источник
Ñëîæíûå ýôèðû – ñîåäèíåíèÿ, ó êîòîðûõ àòîì âîäîðîäà çàìåùåí óãëåâîäîðîäíûì ðàäèêàëîì. Îáùàÿ ôîðìóëà:

Èçîìåðèÿ ñëîæíûõ ýôèðîâ.
Äëÿ ñëîæíûõ ýôèðîâ õàðàêòåðíû ñëåäóþùèå âèäû èçîìåðèè: èçîìåðèÿ óãëåðîäíîé öåïè, èçîìåðèÿ ïîëîæåíèÿ ñëîæíîýôèðíîé ãðóïïèðîâêè –ÑÎ-Î-, ìåæêëàññîâàÿ èçîìåðèÿ:



Ôèçè÷åñêèå ñâîéñòâà ñëîæíûõ ýôèðîâ.
Ñëîæíûå ýôèðû ïðåäñòàâëÿþò ñîáîé ëåòó÷èå, ìàëîðàñòâîðèìûå è ïðàêòè÷åñêè íåðàñòâîðèìûå â âîäå æèäêîñòè. Ìíîãèå èìåþò ïðèÿòíûé çàïàõ.
Ñëîæíûå ýôèðû èìåþò áîëåå íèçêóþ òåìïåðàòóðó êèïåíèÿ, ÷åì ñîîòâåòñòâóþùèå êèñëîòû. Ñëîæíûå ýôèðû âûñøèõ æèðíûõ êèñëîò è ñïèðòîâ – âîñêîîáðàçíûå âåùåñòâà, íå èìåþò çàïàõà è íåðàñòâîðèìû â âîäå, íî õîðîøî ðàñòâîðèìû â îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ.
Õèìè÷åñêèå ñâîéñòâà ñëîæíûõ ýôèðîâ.
1. Ðåàêöèÿ ãèäðîëèçà (îìûëåíèÿ).
2. Ýòåðèôèêàöèÿ:

Ãèäðîëèç óñêîðÿåòñÿ ïîä äåéñòâèåì ùåëî÷åé, è ãèäðîëèç íåîáðàòèì:


3. Ðåàêöèÿ âîññòàíîâëåíèÿ:

4. Ðåàêöèÿ îáðàçîâàíèÿ àìèäîâ.

Ðåàêöèÿ ýòåðèôèêàöèÿ ñëîæíûõ ýôèðîâ.
Ýòåðèôèêàöèÿ – îáðàòèìûé ïðîöåññ. Ïðÿìàÿ ðåàêöèÿ – ýòî îáðàçîâàíèå ñëîæíîãî ýôèðà, îáðàòíàÿ – êèñëîòíûé ãèäðîëèç.  ðåçóëüòàòå ïðîèñõîäèò àêòèâàöèÿ ìîëåêóëû êàðáîíîâîé êèñëîòû. Áåíçîéíàÿ êèñëîòà ïðîòîíèðóåòñÿ ïî àòîìó êèñëîðîäà êàðáîíèëüíîé ãðóïïû. Ïðîòîíèðîâàíèå ïðèâîäèò ê ïðåâðàùåíèþ ÷àñòè÷íîãî ïîëîæèòåëüíîãî çàðÿäà íà àòîìå óãëåðîäà êàðáîêñèëüíîé ãðóïïû.

Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Ñîåäèíåíèÿ õèìè÷åñêèõ ýëåìåíòîâ | |
| Àëêàíû, âîäà, ãàëîãåíû, ìûëà, æèðû, ãèäðîêñèäû; îêñèäû, õëîðèäû, ïðîèçâîäíûå õèìè÷åñêèõ ýëåìåíòîâ òàáëèöû Ìåíäåëååâà | |
| Ñîåäèíåíèÿ õèìè÷åñêèõ ýëåìåíòîâ | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Êàðáîíèëüíûå ñîåäèíåíèÿ. | |
| Îðãàíè÷åñêèå ñîåäèíåíèÿ, â ñîñòàâ êîòîðûõ âõîäèò Ñ=Î ãðóïïà, íàçûâàþò êàðáîíèëüíûìè ñîåäèíåíèÿìè . | |
| Êàðáîíèëüíûå ñîåäèíåíèÿ. | |
Êàðáîíîâûå êèñëîòû. | |
| Êàðáîíîâûìè êèñëîòàìè íàçûâàþò ñîåäèíåíèÿ, â êîòîðûõ ñîäåðæèòñÿ êàðáîêñèëüíàÿ ãðóïïà: . | |
| Êàðáîíîâûå êèñëîòû. | |
Источник
booksonchemistry.com -> Добавить материалы на сайт -> Другое
-> Гара Н.Н.
-> “Контрольные и проверочные работы по химии” -> 17
Гара Н.Н., Зуева М.В. Контрольные и проверочные работы по химии — М.: Дрофа, 2001. — 144 c.
ISBN 5-7107-4830-7
Скачать (прямая ссылка): kontroliproverochnierabotipohimii2001.pdfПредыдущая 1 .. 11 12 13 14 15 16 17 > 18 19 20 21 22 23 .. 38 >> Следующая
CH4 + 202-> CO2 + 2Н20 + 890 кДж.
3. Вычислите массу раствора 63%-ной азотной кислоты, затраченной на получение 50 г тринитроклет-чатки. Ar(N) = 14, Мг(тринитроцеллюлозы) — 297.
4. Какое количество вещества гидроксида меди (II) может быть получено из 50 г 40% -ного раствора гидроксида натрия и 100 г сульфата меди (И)? Ar (Cu) = 64, Ar (S) = 32, Ar (Na) = 23.
5. Вычислите объем оксида углерода (IV) (н. у.), полученного при полном сгорании 1620 кг крахмала. Мг(элементарного звена крахмала) =162.
6. Вычислите объем кислорода и воздуха (н. у.), израсходованных на окисление метанола, учитывая, что
62получили при этом 400 г 40% -ного раствора формальдегида. Мг( формальдегида) = 30.
КОНТРОЛЬНАЯ РАБОТА № 4
Вариант I
1. Какое общее химическое свойство присуще сложным эфирам, сахарозе, крахмалу? Ответ подтвердите уравнениями химических реакций.
2. Напишите уравнения химических реакций для осуществления превращений, соответствующих схеме:
1 2 крахмал-*• глюкоза-* этиловый спирт
3
I г
глюконовая кислота
3. Докажите, что глюкоза представляет собой многоатомный спирт. Напишите одно характерное уравнение химической реакции.
4. Вычислите массу кислоты, полученной при взаимодействии 37,5 г 40% -ного раствора формальдегида с 120 г гидроксида меди (II). Ar(Cu) = 64, ^(формальдегида) = 30.
Вариант II
1. Сравните состав, строение молекул и химические свойства глюкозы и сахарозы. Ответ подтвердите уравнениями химических реакций.
2. Напишите уравнения химических превращений, соответствующих схеме:
12 з сахароза-* глюкоза <-целлюлоза-> динитрок-
летчатка
3. Чем отличается по составу растительный жир от животного? Как получить из жидкого жира твердый? Напишите уравнение химической реакции.
4. Какова масса спирта, который может быть получен из 300 кг древесных опилок, содержащих 50% примесей (расчет ведите по одному структурному звену молекулы целлюлозы), а выход спирта от теоретически возможного составляет 70% ? Мг(элементарного звена целлюлозы) = 162, Мг(спирта) = 46.
63Вариант III
1. Сравните состав, строение молекул и химические свойства крахмала и целлюлозы. Ответ подтвердите уравнениями химических реакций.
2. Напишите уравнения химических превращений, соответствующих схеме:
і 2 триолеин-> тристеарин-* стеариновая
3
кислота-> стеарат натрия
3. Докажите, что глюкоза обладает свойствами альдегидов. Запишите одно уравнение химической реакции.
4. Какая масса уксусно-этилового эфира может быть получена при взаимодействии 69 г этилового спирта и 75 г технической уксусной кислоты, массовая доля примесей в которой равна 20% ? Mr (спирта) = 46, Mr (уксусной кислоты) = 60, Mr (уксусно-этилового эфира) = 88.
Вариант IV
1. Какое общее химическое свойство присуще жирам, сахарозе, целлюлозе? Ответ подтвердите уравнениями химических реакций.
2. Как получить хозяйственное мыло из парафина? Ответ подтвердите уравнениями химических реакций.
3. Напишите уравнение химической реакции спиртового брожения глюкозы.
4. Какая масса гидроксида меди (II) может выпасть в осадок, если проводить реакцию между 260 г сульфата меди (II) и 200 г 40% -ного раствора гидроксида натрия? Ar (Cu) = 64, Ar (S) = 32, Ar (Na) = 23.
Дополнительные задания
1. При сжигании 5,6 л органического вещества получили 16,8 л оксида углерода (IV) (н. у.) и 13,5 г паров воды. Плотность газообразования органического вещества 1,875 г/л. Определите формулу исходного вещества.
2. Какую массу глюкозы можно получить из 81 кг крахмала, если выход глюкозы от теоретически возможного составил 75% ? Расчет ведите на одно элементарное звено крахмала. Mr (элементарного звена крахмала) = 162, Mr (глюкозы) = 180.
3. Какой объем кислорода и воздуха (н. у.) будет израсходован на полное горение 1 л формальдегида?11 класс
Тема: «Азотсодержащие органические соединения»
ПРОВЕРОЧНЫЕ РАБОТЫ Нитросоединения
Вариант I
1. Какие органические соединения относят к классу нитросоединений? Приведите примеры, назовите эти вещества. Напишите уравнение химической реакции получения одного из нитросоединений.
2. Какие химические превращения носят названия реакций а) Бутлерова, б) Кучерова, в) Зелинского, г) Зимина? Напишите уравнения этих химических реакций.
3. Для проведения реакции нейтрализации взяли 0,3 моль азотной кислоты и 40 г гидроксида натрия. Какое количество вещества нитрата натрия можно получить в этой реакции? Ar(N) = 14, Ar(Na) = 23.
Вариант II
1. Какие из веществ, формулы которых:
H2CO-NOs I
a) H-CO-NO2 б) H3C-CH2-NH2 в) NH4NO3 H2CO — NO2
г)
он
CH*
3—763
65относятся к классу нитросоединений? Назовите их. Напишите уравнение химической реакции получения одного из нитросоединений.
2. Какие химические реакции получили название:
а) гидратация; б) гидрогенизация; в) дегидратация; г) полимеризация, д) этерификация? Напишите по одному примеру уравнений этих химических реакций.
3. Вычислите количество вещества гидроксида меди (И), которое можно получить, если для реакции взять 40 г сульфата меди (И) и 0,2 моль гидроксида натрия. Ar (Cu) = 64, Ar (S) = 32.
Предыдущая 1 .. 11 12 13 14 15 16 17 > 18 19 20 21 22 23 .. 38 >> Следующая
Авторские права © 2011 BooksOnChemistry. Все права защищены.
Источник
