Какое количество вещества нитрата натрия содержится в растворе объемом 1 л

Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % – го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % – го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % – го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С – ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С – ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С – ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон – ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 – ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль


 С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
 5 . С 3 = 2,2 моль/0,5л =4,4 М
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 – ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль


 ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р – ра = 146 г/0,38 = 384 г
m р – ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m

 воды = 150 г
воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С – ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С – ? 

 2. m в-ва = 1090 г ∙ 0,1 = 109 г
2. m в-ва = 1090 г ∙ 0,1 = 109 г

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ

 р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра – ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω

 р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 – ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V

 р-ра = 120 мл = 0,12 л
р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 – ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра – 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
 V р-ра 1 – ?
V р-ра 1 – ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 – ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
 7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
 m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра – ?
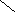
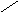 5. 15,7 % 10 м.ч
5. 15,7 % 10 м.ч
 10 %
10 %
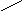

0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


 7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 – ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
 ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω  – ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
– ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
 4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
 Ответ: 3,65 М
Ответ: 3,65 М 
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
 4. С = 6 моль / 1 л = 6 М
4. С = 6 моль / 1 л = 6 М
О твет: 6 М
твет: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
 4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 – ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
 8.С = 1,21 моль / 0, 0683 л = 17,7 М
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
Источник
ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. | Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. | Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. ω3 (NaCl) = 32,5 %. |
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
Источник
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:

здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды.»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
Решение:
Примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,285 = 28,5 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 28,5 = 71,5 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 28,5/71,5⋅100 = 39,86 г вещества на 100 г воды.
Ответ: χ = 39,86 г вещества на 100 г воды.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
Решение:
Примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,285 = 28,5 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 28,5 = 71,5 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 28,5/71,5⋅100 = 39,86 г вещества на 100 г воды.
Ответ: χ = 39,86 г вещества на 100 г воды.
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
3Na2S + 2AlCl3 + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
Na2S + 2HCl = 2NaCl + H2S
Ответ: ω(NaCl) = 13,336%
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KCl
AlCl3 + 3NH3∙H2O = Al(OH)3 + 3NH4Cl
Ответ: ω(NH4Cl) = 19,9255%
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
(NH4)2CO3 + 2NaOH = 2NH3 + 2H2O + Na2CO3
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2 + H2O
Ответ: ω(NH4Cl) = 26,62%
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Ответ: ω(CaCl2) = 3,1%
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
FeSO4 + BaCl2 = BaSO4 + FeCl2
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
Ответ: ω(NH3) = 3,11%
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
Al2(SO4)3 + 6NH3∙H2O = 2Al(OH)3 + 3(NH4)2SO4
Al2(SO4)3 + 8NaOH = 2Na[Al(OH)4] + 3Na2SO4
Ответ: ω(Na2SO4) = 14,48%
17. Растворимость безво
