Какое количество нейтронов содержится в атоме 31 15 p

Количество протонов в ядре атома всегда равно порядковому номеру химического элемента в таблице Менделеева.
Количество нейтронов равно разности округленной атомной массы элемента и его порядкового номера
neutron = atom_massa – number
Но эта математическая формула не всегда корректна. Возьмем, к примеру медь. Порядковый номер элемента – 29. Атомная масса – 63,546.
Округляем атомную массу – получаем 64. Вычисляем число нейтронов по вышеприведенной формуле: 64 – 29 = 35.
Но на самом деле
изотоп 64Cu является нестабильным изотопом (период полураспада – 12,7 часа). А стабильных изотопов меди
два: 63Cu (34 нейтрона) и 65Cu (36 нейтронов)
Так что, для получения более точных данных лучше пользоваться справочными таблицами.
В нижеприведенной таблице указано количество протонов и нейтронов в ядрах стабильных изотопов химических элементов, а также атомная масса этих изотопов.
Таблица количества протонов и нейтронов
* отмечены нестабильные изотопы, но с большим периодом полураспада (сопоставивым с возрастом Вселенной или большим)
| Изотоп | Кол-во протонов | Кол-во нейтронов | Атомная масса изотопа |
|---|---|---|---|
| 1H | 1 | 0 | 1.00782503223 |
| 2H | 1 | 1 | 2.01410177812 |
| 3He | 2 | 1 | 3.0160293191 |
| 4He | 2 | 2 | 4.00260325415 |
| 6Li | 3 | 3 | 6.015122795 |
| 7Li | 3 | 4 | 7.01600455 |
| 9Be | 4 | 5 | 9.0121822 |
| 10B | 5 | 5 | 10.012936862 |
| 11B | 5 | 6 | 11.009305167 |
| 12C | 6 | 6 | 12 |
| 13C | 6 | 7 | 13.0033548378 |
| 14N | 7 | 7 | 14.0030740048 |
| 15N | 7 | 8 | 15.0001088982 |
| 16O | 8 | 8 | 15.99491461956 |
| 17O | 8 | 9 | 16.9991317 |
| 18O | 8 | 10 | 17.999161 |
| 19F | 9 | 10 | 18.99840322 |
| 20Ne | 10 | 10 | 19.9924401754 |
| 21Ne | 10 | 11 | 20.99384668 |
| 22Ne | 10 | 12 | 21.991385114 |
| 23Na | 11 | 12 | 22.9897692809 |
| 24Mg | 12 | 12 | 23.9850417 |
| 25Mg | 12 | 13 | 24.98583692 |
| 26Mg | 12 | 14 | 25.982592929 |
| 27Al | 13 | 14 | 26.98153863 |
| 28Si | 14 | 14 | 27.9769265325 |
| 29Si | 14 | 15 | 28.9764947 |
| 30Si | 14 | 16 | 29.97377017 |
| 31P | 15 | 16 | 30.97376163 |
| 32S | 16 | 16 | 31.972071 |
| 33S | 16 | 17 | 32.97145876 |
| 34S | 16 | 18 | 33.9678669 |
| 36S | 16 | 20 | 35.96708076 |
| 35Cl | 17 | 18 | 34.96885268 |
| 37Cl | 17 | 20 | 36.96590259 |
| 36Ar | 18 | 18 | 35.967545106 |
| 38Ar | 18 | 20 | 37.9627324 |
| 40Ar | 18 | 22 | 39.9623831225 |
| 39K | 19 | 20 | 38.96370668 |
| 40K * | 19 | 21 | 39.96399848 |
| 41K | 19 | 22 | 40.96182576 |
| 40Ca | 20 | 20 | 39.96259098 |
| 42Ca | 20 | 22 | 41.95861801 |
| 43Ca | 20 | 23 | 42.9587666 |
| 44Ca | 20 | 24 | 43.9554818 |
| 46Ca | 20 | 26 | 45.9536926 |
| 48Ca * | 20 | 28 | 47.952534 |
| 45Sc | 21 | 24 | 44.9559119 |
| 46Ti | 22 | 24 | 45.9526316 |
| 47Ti | 22 | 25 | 46.9517631 |
| 48Ti | 22 | 26 | 47.9479463 |
| 49Ti | 22 | 27 | 48.94787 |
| 50Ti | 22 | 28 | 49.9447912 |
| 50V * | 23 | 27 | 49.9471585 |
| 51V | 23 | 28 | 50.9439595 |
| 50Cr | 24 | 26 | 49.9460442 |
| 52Cr | 24 | 28 | 51.9405075 |
| 53Cr | 24 | 29 | 52.9406494 |
| 54Cr | 24 | 30 | 53.9388804 |
| 55Mn | 25 | 30 | 54.9380451 |
| 54Fe | 26 | 28 | 53.9396105 |
| 56Fe | 26 | 30 | 55.9349375 |
| 57Fe | 26 | 31 | 56.935394 |
| 58Fe | 26 | 32 | 57.9332756 |
| 59Co | 27 | 32 | 58.933195 |
| 58Ni | 28 | 30 | 57.9353429 |
| 60Ni | 28 | 32 | 59.9307864 |
| 61Ni | 28 | 33 | 60.931056 |
| 62Ni | 28 | 34 | 61.9283451 |
| 64Ni | 28 | 36 | 63.927966 |
| 63Cu | 29 | 34 | 62.9295975 |
| 65Cu | 29 | 36 | 64.9277895 |
| 64Zn | 30 | 34 | 63.9291422 |
| 66Zn | 30 | 36 | 65.9260334 |
| 67Zn | 30 | 37 | 66.9271273 |
| 68Zn | 30 | 38 | 67.9248442 |
| 70Zn | 30 | 40 | 69.9253193 |
| 69Ga | 31 | 38 | 68.9255736 |
| 71Ga | 31 | 40 | 70.9247013 |
| 70Ge | 32 | 38 | 69.9242474 |
| 72Ge | 32 | 40 | 71.9220758 |
| 73Ge | 32 | 41 | 72.9234589 |
| 74Ge | 32 | 42 | 73.9211778 |
| 75As | 33 | 42 | 74.9215965 |
| 74Se | 34 | 40 | 73.9224764 |
| 76Se | 34 | 42 | 75.9192136 |
| 77Se | 34 | 43 | 76.919914 |
| 78Se | 34 | 44 | 77.9173091 |
| 80Se | 34 | 46 | 79.9165213 |
| 82Se * | 34 | 48 | 81.9166994 |
| 79Br | 35 | 44 | 78.9183371 |
| 81Br | 35 | 46 | 80.9162906 |
| 78Kr * | 36 | 42 | 77.9203648 |
| 80Kr | 36 | 44 | 79.916379 |
| 82Kr | 36 | 46 | 81.9134836 |
| 83Kr | 36 | 47 | 82.914136 |
| 84Kr | 36 | 48 | 83.911507 |
| 86Kr | 36 | 50 | 85.91061073 |
| 85Rb | 37 | 48 | 84.911789738 |
| 87Rb * | 37 | 50 | 86.909180527 |
| 84Sr | 38 | 46 | 83.913425 |
| 86Sr | 38 | 48 | 85.9092602 |
| 87Sr | 38 | 49 | 86.9088771 |
| 88Sr | 38 | 50 | 87.9056121 |
| 89Y | 39 | 50 | 88.9058483 |
| 90Zr | 40 | 50 | 89.9047044 |
| 91Zr | 40 | 51 | 90.9056458 |
| 92Zr | 40 | 52 | 91.9050408 |
| 94Zr | 40 | 54 | 93.9063152 |
| 93Nb | 41 | 52 | 92.9063781 |
| 92Mo | 42 | 50 | 91.906811 |
| 94Mo | 42 | 52 | 93.9050883 |
| 95Mo | 42 | 53 | 94.9058421 |
| 96Mo | 42 | 54 | 95.9046795 |
| 97Mo | 42 | 55 | 96.9060215 |
| 98Mo | 42 | 56 | 97.9054082 |
| 100Mo * | 42 | 58 | 99.907477 |
| 96Ru | 44 | 52 | 95.907598 |
| 98Ru | 44 | 54 | 97.905287 |
| 99Ru | 44 | 55 | 98.9059393 |
| 100Ru | 44 | 56 | 99.9042195 |
| 101Ru | 44 | 57 | 100.9055821 |
| 102Ru | 44 | 58 | 101.9043493 |
| 104Ru | 44 | 60 | 103.905433 |
| 103Rh | 45 | 58 | 102.905504 |
| 102Pd | 46 | 56 | 101.905609 |
| 104Pd | 46 | 58 | 103.904036 |
| 105Pd | 46 | 59 | 104.905085 |
| 106Pd | 46 | 60 | 105.903486 |
| 108Pd | 46 | 62 | 107.903892 |
| 110Pd | 46 | 64 | 109.905153 |
| 107Ag | 47 | 60 | 106.905097 |
| 109Ag | 47 | 62 | 108.904752 |
| 106Cd | 48 | 58 | 105.906459 |
| 108Cd | 48 | 60 | 107.904184 |
| 110Cd | 48 | 62 | 109.9030021 |
| 111Cd | 48 | 63 | 110.9041781 |
| 112Cd | 48 | 64 | 111.9027578 |
| 113Cd * | 48 | 65 | 112.9044017 |
| 114Cd | 48 | 66 | 113.9033585 |
| 116Cd * | 48 | 68 | 115.904756 |
| 113In | 49 | 64 | 112.904058 |
| 115In * | 49 | 66 | 114.903878 |
| 112Sn | 50 | 62 | 111.904818 |
| 114Sn | 50 | 64 | 113.902779 |
| 115Sn | 50 | 65 | 114.903342 |
| 116Sn | 50 | 66 | 115.901741 |
| 117Sn | 50 | 67 | 116.902952 |
| 118Sn | 50 | 68 | 117.901603 |
| 119Sn | 50 | 69 | 118.903308 |
| 120Sn | 50 | 70 | 119.9021947 |
| 122Sn | 50 | 72 | 121.903439 |
| 124Sn | 50 | 74 | 123.9052739 |
| 121Sb | 51 | 70 | 120.9038157 |
| 123Sb | 51 | 72 | 122.904214 |
| 120Te | 52 | 68 | 119.90402 |
| 122Te | 52 | 70 | 121.9030439 |
| 123Te | 52 | 71 | 122.90427 |
| 124Te | 52 | 72 | 123.9028179 |
| 125Te | 52 | 73 | 124.9044307 |
| 126Te | 52 | 74 | 125.9033117 |
| 128Te * | 52 | 76 | 127.9044631 |
| 130Te * | 52 | 78 | 129.9062244 |
| 127I | 53 | 74 | 126.904473 |
| 124Xe * | 54 | 70 | 123.905893 |
| 126Xe | 54 | 72 | 125.904274 |
| 128Xe | 54 | 74 | 127.9035313 |
| 129Xe | 54 | 75 | 128.9047794 |
| 130Xe | 54 | 76 | 129.903508 |
| 131Xe | 54 | 77 | 130.9050824 |
| 132Xe | 54 | 78 | 131.9041535 |
| 134Xe | 54 | 80 | 133.9053945 |
| 136Xe * | 54 | 82 | 135.907219 |
| 133Cs | 55 | 78 | 132.905451933 |
| 130Ba * | 56 | 74 | 129.9063208 |
| 132Ba | 56 | 76 | 131.9050613 |
| 134Ba | 56 | 78 | 133.9045084 |
| 135Ba | 56 | 79 | 134.9056886 |
| 136Ba | 56 | 80 | 135.9045759 |
| 137Ba | 56 | 81 | 136.9058274 |
| 138Ba | 56 | 82 | 137.9052472 |
| 138La * | 57 | 81 | 137.907112 |
| 139La | 57 | 82 | 138.9063533 |
| 136Ce | 58 | 78 | 135.907172 |
| 138Ce | 58 | 80 | 137.905991 |
| 140Ce | 58 | 82 | 139.9054387 |
| 142Ce | 58 | 84 | 141.909244 |
| 141Pr | 59 | 82 | 140.9076528 |
| 142Nd | 60 | 82 | 141.9077233 |
| 143Nd | 60 | 83 | 142.9098143 |
| 144Nd * | 60 | 84 | 143.9100873 |
| 145Nd | 60 | 85 | 144.9125736 |
| 146Nd | 60 | 86 | 145.9131169 |
| 148Nd | 60 | 88 | 147.916893 |
| 150Nd * | 60 | 90 | 149.920891 |
| 144Sm | 62 | 82 | 143.911999 |
| 147Sm * | 62 | 85 | 146.9148979 |
| 148Sm * | 62 | 86 | 147.9148227 |
| 149Sm | 62 | 87 | 148.9171847 |
| 150Sm | 62 | 88 | 149.9172755 |
| 152Sm | 62 | 90 | 151.9197324 |
| 154Sm | 62 | 92 | 153.9222093 |
| 151Eu * | 63 | 88 | 150.9198502 |
| 153Eu | 63 | 90 | 152.9212303 |
| 152Gd * | 64 | 88 | 151.919791 |
| 154Gd | 64 | 90 | 153.9208656 |
| 155Gd | 64 | 91 | 154.922622 |
| 156Gd | 64 | 92 | 155.9221227 |
| 157Gd | 64 | 93 | 156.9239601 |
| 158Gd | 64 | 94 | 157.9241039 |
| 160Gd | 64 | 96 | 159.9270541 |
| 159Tb | 65 | 94 | 158.9253468 |
| 156Dy | 66 | 90 | 155.924283 |
| 158Dy | 66 | 92 | 157.924409 |
| 160Dy | 66 | 94 | 159.9251975 |
| 161Dy | 66 | 95 | 160.9269334 |
| 162Dy | 66 | 96 | 161.9267984 |
| 163Dy | 66 | 97 | 162.9287312 |
| 164Dy | 66 | 98 | 163.9291748 |
| 165Ho | 67 | 98 | 164.9303221 |
| 162Er | 68 | 94 | 161.928778 |
| 164Er | 68 | 96 | 163.9292 |
| 166Er | 68 | 98 | 165.9302931 |
| 167Er | 68 | 99 | 166.9320482 |
| 168Er | 68 | 100 | 167.9323702 |
| 170Er | 68 | 102 | 169.9354643 |
| 169Tm | 69 | 100 | 168.9342133 |
| 168Yb | 70 | 98 | 167.933897 |
| 170Yb | 70 | 100 | 169.9347618 |
| 171Yb | 70 | 101 | 170.9363258 |
| 172Yb | 70 | 102 | 171.9363815 |
| 173Yb | 70 | 103 | 172.9382108 |
| 174Yb | 70 | 104 | 173.9388621 |
| 176Yb | 70 | 106 | 175.9425717 |
| 175Lu | 71 | 104 | 174.9407718 |
| 176Lu * | 71 | 105 | 175.9426863 |
| 174Hf * | 72 | 102 | 173.940046 |
| 176Hf | 72 | 104 | 175.9414086 |
| 177Hf | 72 | 105 | 176.9432207 |
| 178Hf | 72 | 106 | 177.9436988 |
| 179Hf | 72 | 107 | 178.9458161 |
| 180Hf | 72 | 108 | 179.94655 |
| 181Ta | 73 | 108 | 180.9479958 |
| 180W * | 74 | 106 | 179.946704 |
| 182W | 74 | 108 | 181.9482042 |
| 183W | 74 | 109 | 182.950223 |
| 184W | 74 | 110 | 183.9509312 |
| 186W | 74 | 112 | 185.9543641 |
| 185Re | 75 | 110 | 184.952955 |
| 187Re * | 75 | 112 | 186.9557531 |
| 184Os | 76 | 108 | 183.9524891 |
| 186Os * | 76 | 110 | 185.9538382 |
| 187Os | 76 | 111 | 186.9557505 |
| 188Os | 76 | 112 | 187.9558382 |
| 189Os | 76 | 113 | 188.9581475 |
| 190Os | 76 | 114 | 188.9581475 |
| 192Os | 76 | 116 | 191.9614807 |
| 191Ir | 77 | 114 | 190.960594 |
| 193Ir | 77 | 116 | 191.962605 |
| 190Pt * | 78 | 112 | 189.959932 |
| 192Pt | 78 | 114 | 191.961038 |
| 194Pt | 78 | 116 | 193.9626803 |
| 195Pt | 78 | 117 | 194.9647911 |
| 196Pt | 78 | 118 | 195.9649515 |
| 198Pt | 78 | 120 | 197.967893 |
| 197Au | 79 | 118 | 196.9665687 |
| 196Hg | 80 | 116 | 195.965833 |
| 198Hg | 80 | 118 | 197.966769 |
| 199Hg | 80 | 119 | 198.9682799 |
| 200Hg | 80 | 120 | 199.968326 |
| 201Hg | 80 | 121 | 200.9703023 |
| 202Hg | 80 | 122 | 201.970643 |
| 204Hg | 80 | 124 | 203.9734939 |
| 203Tl | 81 | 122 | 202.9723442 |
| 205Tl | 81 | 124 | 204.9744275 |
| 204Pb | 82 | 122 | 203.9730436 |
| 206Pb | 82 | 124 | 205.9744653 |
| 207Pb | 82 | 125 | 206.9758969 |
| 208Pb | 82 | 126 | 207.9766521 |
| 209Bi * | 83 | 126 | 208.9803987 |
| 232Th * | 90 | 142 | 232.0380553 |
| 235U * | 92 | 143 | 235.0439299 |
Другие таблицы
Таблица синусов и косинусов
Таблица тангенсов и котангенсов
Источник
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1] Определить количество нейтронов в атоме — довольно просто. Все, что вам нужно сделать для расчета количества нейтронов в атоме или изотопе, — это следовать нашим инструкциям и держать под рукой периодическую таблицу.
Определение числа нейтронов в атомах (не изотопах)
1
Найдите элемент в периодической таблице. Для примера мы будем рассматривать осмий (Os), который находится в шестом периоде (шестой ряд сверху).
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер — это количество протонов в одном атоме этого элемента. Для осмия это число 76, то есть в одном атоме осмия содержится 76 протонов.
- Число протонов неизменно, именно оно и делает элемент элементом.
3
Найдите атомную массу элемента. Это число обычно находится под символом элемента. Обратите внимание, что в варианте периодической системы в нашем примере атомная масса не приведена (это не всегда так; во многих вариантах периодической системы атомная масса указана). Атомная масса осмия — 190,23.
4
Округлите атомную массу до ближайшего целого числа. В нашем примере 190,23 округляется до 190.
- Атомная масса — среднее число изотопов конкретного элемента, обычно она не выражается целым числом.
5
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. Цифры после десятичной запятой относятся к очень малой массе электронов в атоме. В нашем примере: 190 (атомный вес) – 76 (число протонов) = 114 (число нейтронов).
6
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
- N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
- N = M – n
Определение числа нейтронов в изотопах
1
Найдите элемент в периодической таблице. В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер – это количество протонов в одном атоме этого элемента. Углерод находится под номером 6, то есть один атом углерода имеет шесть протонов.
3
Найдите атомную массу. В случае изотопов делать это очень просто, так как они названы в соответствии с их атомной массой. В нашем случае у углерода 14С атомная масса равна 14. Теперь мы знаем атомную массу изотопа; последующий процесс расчета такой же, как и для определения числа нейтронов в атомах (не изотопах).
4
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) – 6 (число протонов) = 8 (число нейтронов).
5
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
- N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
- N = M – n
Советы
- Протоны и нейтроны составляют практически абсолютную массу элементов, в то время как электроны и прочие частицы составляют крайне незначительную массу (эта масса стремится к нулю). Так как один протон имеет примерно ту же массу, что и один нейтрон, а атомное число представляет собой число протонов, то можно просто вычесть число протонов от общей массы.
- Осмий — металл в твердом состоянии при комнатной температуре, получил свое название от греческого слова «osme» — запах.
- Если вы не уверены, что значит какое-то число в периодической таблице, запомните: таблица, как правило, строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и растет на одну единицу слева направо, заканчиваясь на 118 (Оганесон). Это потому, что число протонов в атоме определяет сам элемент и такое число — наиболее легкий способ систематизации элементов (например, атом с 2 протонами — всегда гелий, так же, как и атом с 79 протонами — всегда золото).
Об этой статье
Эту страницу просматривали 145 142 раза.
Была ли эта статья полезной?
Источник
Варианты контрольных работ по «Химии»

Варианты контрольных работ по «Химии» Задание к контрольной работе составлено в 4 вариантах. Студент должен выполнить работу по варианту, номер которого соответствует начальной букве фамилии. Вариант 1
Подробнее
Банк заданий 11 класс химия

Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Подробнее
Содержание учебного курса за I полугодие

Рабочая программа по предмету химия для 8 класса Учитель: Чурина Ирина Николаевна Электронная почта: churinairina2@yandex.ru Учебник Химия 8 класс О.С. Габриелян (базовый уровень) Содержание учебного курса
Подробнее
Важнейшие окислители и восстановители

Важнейшие окислители и восстановители Весьма важным является определение самой возможности протекания ОВР, а также установление продуктов реакции. В связи с этим следует отметить, что направление протекания
Подробнее
Диагностическая работа 1 по ХИМИИ

Район Город (населенный пункт) Школа Класс Фамилия Имя Отчество Диагностическая работа 1 по ХИМИИ 21 ноября 2011 года 9 класс Вариант 1 Химия. 9 класс. Вариант 1 2 Инструкция по выполнению работы На выполнение
Подробнее
Пояснительная записка

Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
Подробнее
Банк заданий химия 9 класс

Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
Подробнее
Зачет по теме «Химическая связь» 11класс

Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
Подробнее
ID_589 1/6 neznaika.pro

Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
Подробнее
ЗАДАНИЕ 3. Примеры решения задач

ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
Подробнее
1-3 1,2,3, стр.8. 2, стр. 32

Муниципальное образовательное учреждение открытая (сменная) общеобразовательная школа 94 Химия 9 класс Программные вопросы Внимание! Тренировочные работы и задания из учебника выполняются в отдельной тетради
Подробнее
1) IV 2) V 3) VI 4) VII

2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
Подробнее
Авторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова

УДК 373.167.1:54 12+ ББК 24я72 Я11 Авторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова Модульный курс «Я сдам ЕГЭ!» создан авторским коллективом
Подробнее
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ИСПЫТАНИЙ ПО ХИМИИ

Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской
Подробнее
ФОНД ОЦЕНОЧНЫХ СРЕДСТВ

Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа 1» Приложение 2 к ООП ООО ФОНД ОЦЕНОЧНЫХ СРЕДСТВ по текущей аттестации предмет: Химия. 9 класс Составители: Домнарева
Подробнее
с. Веселая Лопань, 2015 год

Муниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
Подробнее
РАБОЧАЯ ПРОГРАММА по химии для 8-9 классов

Муниципальное бюджетное общеобразовательное учреждение города Абакана «Средняя общеобразовательная школа 1» РАБОЧАЯ ПРОГРАММА по химии для 8-9 классов. Рабочая программа по химии для 8-9 классов является
Подробнее
Источник
Задача 206.
Символ одного из изотопов элемента 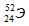 . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 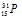
Ответ: 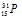 .
.
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
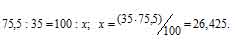
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
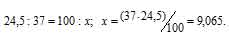
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
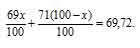
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
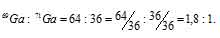
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
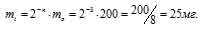
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после распада, находим из формулы:
N% = 2-n. N0. 100%, где
N% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
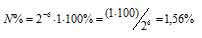
Ответ: 1,56%.
Задача 214.
Период полураспада 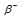 – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
– радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение: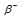 – распаду предшествует процесс
– распаду предшествует процесс 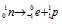 , протекающий в ядре; таким образом,
, протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
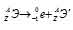
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
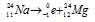
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
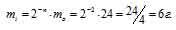
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18г.
Источник
