Какое из соединений азота проявляет только окислительные свойства

 Азот — элемент 2-го периода V А-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0,-3, +3 и +5, реже +2 и +4 и др. состояние Nvсчитается относительно устойчивым.
Азот — элемент 2-го периода V А-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0,-3, +3 и +5, реже +2 и +4 и др. состояние Nvсчитается относительно устойчивым.
Шкала степеней окисления у азота:
+5 — N2O5, NO3, NaNO3, AgNO3
+4 — NO2
+3 – N2O3, NO2, HNO2, NaNO2, NF3
+2 — NO
+1 – N2O
0 — N2
-3 — NH3, NH4, NH3 * H2O, NH2Cl, Li3N, Cl3N.
Азот обладает высокой электроотрицательностью (3,07), третий после F и O. Проявляет типичные неметаллические (кислотные) свойства, образуя при этом различные кислородсодержащие кислоты, соли и бинарные соединения, а так же катион аммония NH4 и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2
Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.
Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
N2 + 3F2 = 2NF3, N2 + O2 ↔ 2NO
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt )
N2 + 3H2 ↔ 2NH3 + 92 кДж
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N-3H4N3O2(T) = N20 + 2H2O (60-70)
NH4Cl(p) + KNO2(p) = N20↑ + KCl +2H2O (100˚C)
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3
Бинарное соединение , степень окисления азота равна – 3. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3] (sp3-гибридизация). Наличие у азота в молекуле NH3 донорской пары электронов на sp3-гибридной орбитали обуславливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4. Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л H2O при 20˚C); доля в насыщенном растворе равна 34% по массе и 99% по объему, pH= 11,8.
Весьма реакционноспособный, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N-3) и окислительные (за счет H+1) свойства. Осушается только оксидом кальция.
Качественные реакции – образование белого «дыма» при контакте с газообразным HCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
2NH3(г) ↔ N2 + 3H2
NH3(г) + H2O ↔ NH3 * H2O (р)↔ NH4++ OH—
NH3(г) + HCl(г) ↔ NH4Cl(г) белый «дым»
4NH3 + 3O2 (воздух) = 2N2 + 6 H2O (сгорание)
4NH3 + 5O2 = 4NO+ 6 H2O (800˚C, кат. Pt/Rh)
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O (500˚C)
2 NH3 + 3Mg = Mg3N2 +3 H2 (600 ˚C )
NH3(г) + CO2(г) + H2O = NH4HCO3 (комнатная температура, давление)
Получение. В лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью: Ca(OH)2 + 2NH4Cl = CaCl2+ 2H2O +NH3
Или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности аммиак получают из азота с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.

Гидрат аммиака NH3 *H2O. Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3 и H2O, связанные слабой водородной связью. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4 и анион OH). Катион аммония имеет правильно-тетраэдрическое строение (sp3-гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет N-3) в концентрированном растворе. Вступает в реакцию ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным HCl. Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
В 1 М растворе аммиака содержится в основном гидрат NH3 *H2O и лишь 0,4% ионов NH4 OH (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4 OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате.
Уравнения важнейших реакций:
NH3 H2O (конц.) = NH3↑ + H2O (кипячение с NaOH)
NH3 H2O + HCl (разб.) = NH4Cl + H2O
3(NH3 H2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3 NH4Cl
8(NH3 H2O) (конц.) + 3Br2(p) = N2↑ + 6 NH4Br + 8H2O (40-50˚C)
2(NH3 H2O) (конц.) + 2KMnO4 = N2↑ + 2MnO2↓ + 4H2O + 2KOH
4(NH3 H2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 H2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4H2O
6(NH3 H2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6H2O
Разбавленный раствор аммиака (3-10%-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5 – 25%-ный) – аммиачный раствор (выпускается промышленностью).
Оксиды азота
Монооксид азота NO
Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ-связь (N꞊O) , в твердом состоянии димер N2О2 со связью N-N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Малорастворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами . весьма реакционноспособная смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты.
Уравнения важнейших реакций:
2NO + O2(изб.) = 2NO2 (20˚C)
2NO + C(графит) = N2 + CО2 (400- 500˚C)
10NO + 4P(красный) = 5N2 + 2P2O5 (150- 200˚C)
2NO + 4Cu = N2 + 2 Cu2O (500- 600˚C)
Реакции на смеси NO и NO2:
NO + NO2 +H2O = 2HNO2(p)
NO + NO2 + 2KOH(разб.) = 2KNO2 + H2O
NO + NO2 + Na2CO3 = 2Na2NO2 + CО2 (450- 500˚C)
Получение в промышленности: окисление аммиака кислородом на катализаторе, в лаборатории — взаимодействие разбавленной азотной кислоты с восстановителями:
8HNO3 + 6Hg = 3Hg2(NO3)2 + 2NO↑ + 4 H2O
или восстановлении нитратов:
2NaNO2 + 2H2SO4 + 2NaI = 2NO↑ + I2↓ + 2 H2O + 2Na2SO4
Диоксид азота NO2
Кислотный оксид, условно отвечает двум кислотам — HNO2 и HNO3 (кислота для N4 не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2О4 (тетраоксид диазота). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит.
Уравнение важнейших реакций:
2NO2 ↔ 2NO + O2
4NO2(ж) + H2O = 2HNO3 + N2О3 (син.) (на холоду)
3 NO2 + H2O = 3HNO3 + NO↑
2NO2 + 2NaOH(разб.) = NaNO2 + NaNO3 + H2O
4NO2 + O2+ 2 H2O = 4 HNO3
4NO2 + O2 + KOH = KNO3 + 2 H2O
2NO2 + 7H2 = 2NH3 + 4 H2O (кат. Pt, Ni)
NO2 + 2HI(p) = NO↑ + I2↓ + H2O
NO2 + H2O + SO2 = H2SO4 + NO↑ (50- 60˚C)
NO2 + K = KNO2
6NO2 + Bi(NO3)3 + 3NO (70- 110˚C)
Получение: в промышленности — окислением NO кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO3 (конц.,гор.) + S = H2SO4 + 6NO2↑ + 2H2O
5HNO3 (конц.,гор.) + P (красный) = H3PO4 + 5NO2 ↑ + H2O
2HNO3 (конц.,гор.) + SO2 = H2SO4 + 2 NO2 ↑
Оксид диазота N2O
Бесцветный газ с приятным запахом («веселящий газ»), N꞊N꞊О, формальная степень окисления азота +1, плохо растворим в воде. Поддерживает горение графита и магния:
2N2O + C = CO2 + 2N2 (450˚C)
N2O + Mg = N2 + MgO (500˚C)
Получают термическим разложением нитрата аммония:
NH4NO3 = N2O + 2 H2O (195- 245˚C)
применяется в медицине, как анастезирующее средство.
Триоксид диазота N2O3
При низких температурах –синяя жидкость, ON꞊NO2, формальная степень окисления азота +3. При 20 ˚C на 90% разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2 , при нагревании реагирует иначе:
3N2O3 + H2O = 2HNO3 + 4NO↑
Со щелочами дает соли HNO2, например NaNO2.
Получают взаимодействием NO c O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO2 + NO = N2O3)
при сильном охлаждении. «Нитрозные газы» и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы.
Пентаоксид диазота N2O5
Бесцветное, твердое вещество, O2N – O – NO2, степень окисления азота равна +5. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид:
N2O5 + H2O = 2HNO3
N2O5 + 2NaOH = 2NaNO3 + H2
Получают дегидротацией дымящейся азотной кислоты:
2HNO3 + P2O5 = N2O5 + 2HPO3
или окислением NO2 озоном при -78˚C:
2NO2 + O3 = N2O5 + O2
Азотная кислота
Нитриты и нитраты
Нитрит калия KNO2. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуя бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO2— обесцвечивание фиолетового раствора MnO4 и появление черного осадка при добавлении ионов I. Применяется в производстве красителей, как аналитический реагент на аминокислоты и йодиды, компонент фотографических реактивов.
уравнение важнейших реакций:
2KNO2(т) + 2HNO3(конц.) = NO2↑ + NO↑ + H2O + 2KNO3
2KNO2 (разб.)+ O2(изб.) → 2KNO3 (60-80 ˚C)
KNO2 + H2O + Br2 = KNO3 + 2HBr
5NO2— + 6H+ + 2MnO4— (фиол.) = 5NO3— + 2Mn2+ (бц.) + 3H2O
3 NO2— + 8H+ + CrO72- = 3NO3— + 2Cr3+ + 4H2O
NO2—(насыщ.) + NH4+(насыщ.)= N2↑ + 2H2O
2NO2— + 4H+ + 2I—(бц.) = 2NO↑ + I2(черн.) ↓ = 2H2O
NO2—(разб.) + Ag+ = AgNO2 (светл.желт.)↓
Получение впромышленности – восстановлением калийной селитры в процессах:
KNO3 + Pb = KNO2 + PbO (350-400˚C)
KNO3 (конц.) + Pb(губка) + H2O = KNO2+ Pb(OH)2↓
3 KNO3 + CaO + SO2 = 2 KNO2 + CaSO4 (300 ˚C)
Hитраткалия KNO3
Техническое название калийная, или индийская соль, селитра. Белый, плавится без разложения при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо-эффектом, = -36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO2, в щелочной среде до NH3). Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений.
2KNO3 = 2KNO2 + O2 (400- 500 ˚C)
KNO3 + 2H0 (Zn, разб. HCl) = KNO2 + H2O
KNO3 + 8H0 (Al, конц. KOH) = NH3↑ + 2H2O + KOH (80 ˚C)
KNO3 + NH4Cl = N2O↑ + 2H2O + KCl (230- 300 ˚C)
2 KNO3 + 3C (графит) + S = N2 + 3CO2 + K2S (сгорание)
KNO3 + Pb = KNO2 + PbO (350 — 400 ˚C)
KNO3 + 2KOH + MnO2 = K2MnO4 + KNO2 + H2O (350 — 400 ˚C)
Получение: в промышленности
4KOH (гор.) + 4NO2 + O2 = 4KNO3 + 2H2O
и в лаборатории:
KCl + AgNO3 = KNO3 + AgCl↓

Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония.
Азотная кислота — строение и химические свойства
Источник
Азот – неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
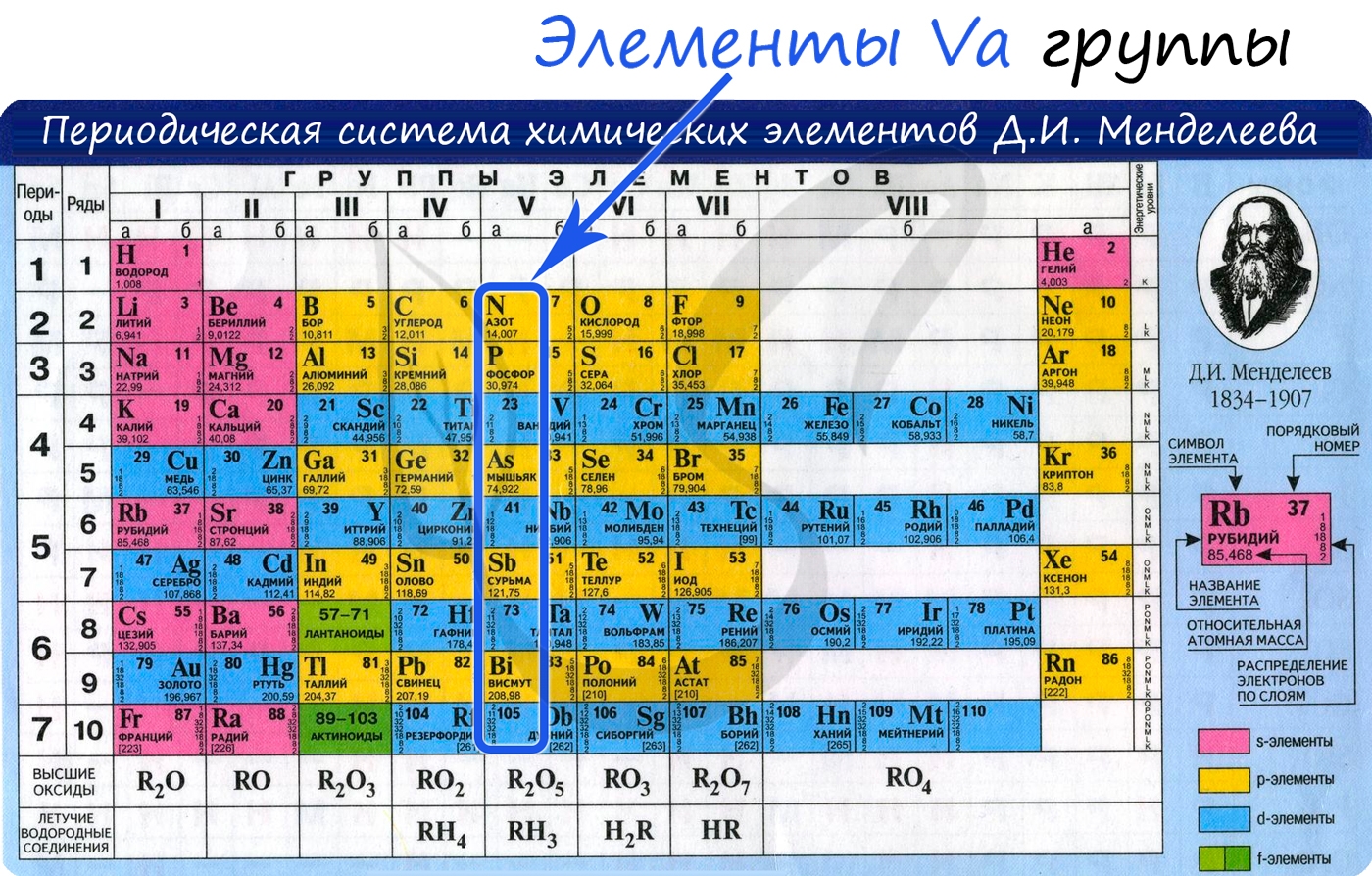
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма – полуметалл, висмут – металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N – 2s22p3
- P – 3s23p3
- As – 4s24p3
- Sb – 5s25p3
- Bi – 6s26p3
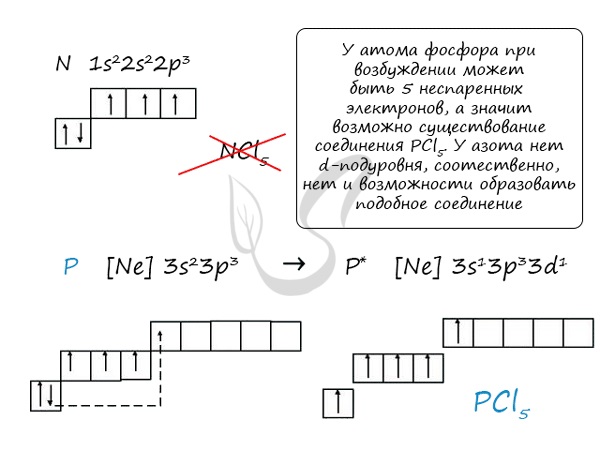
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно – возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух – во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 – индийская селитра, калиевая селитра
- NaNO3 – чилийская селитра, натриевая селитра
- NH4NO3 – аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
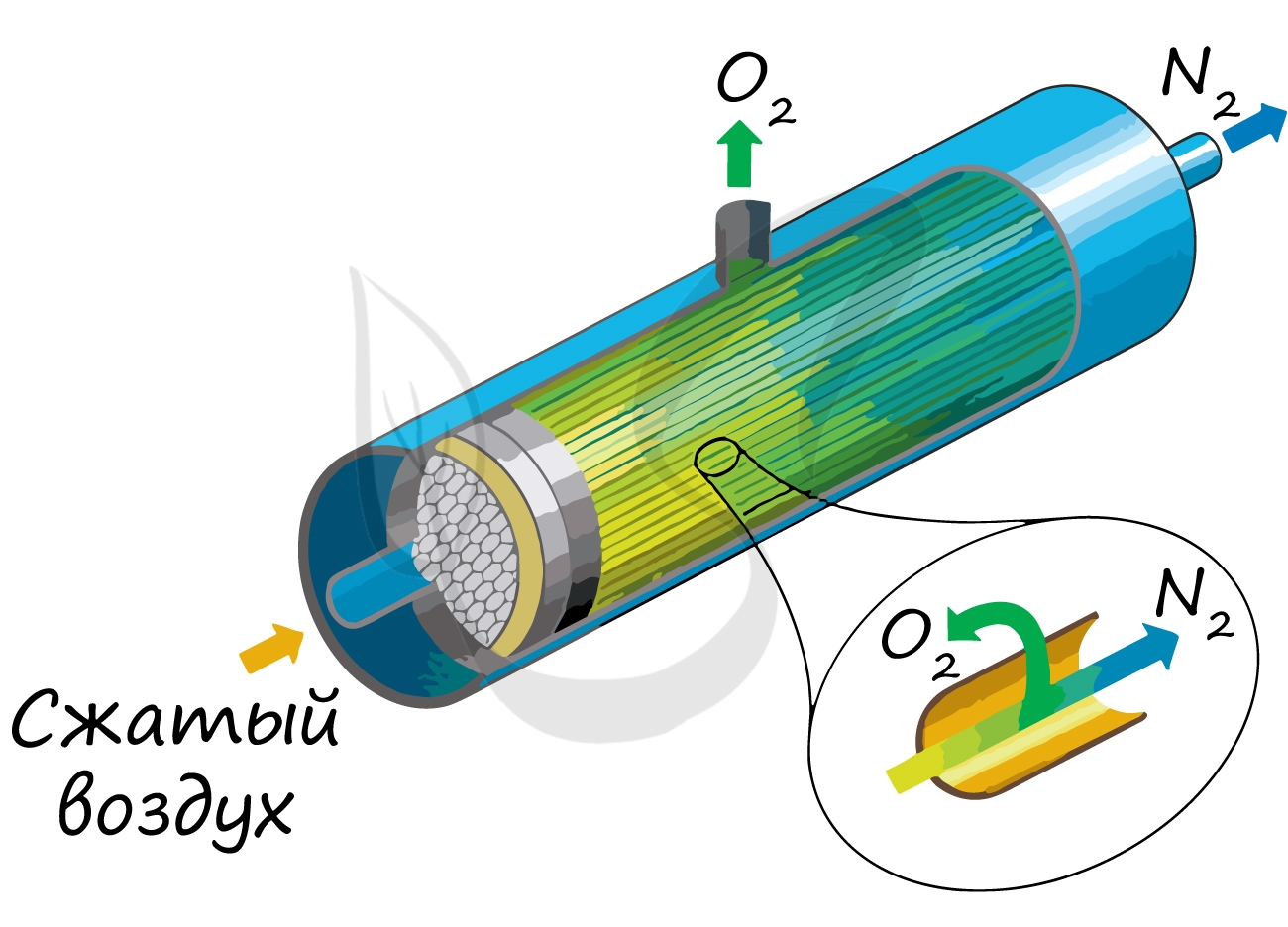
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает – он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
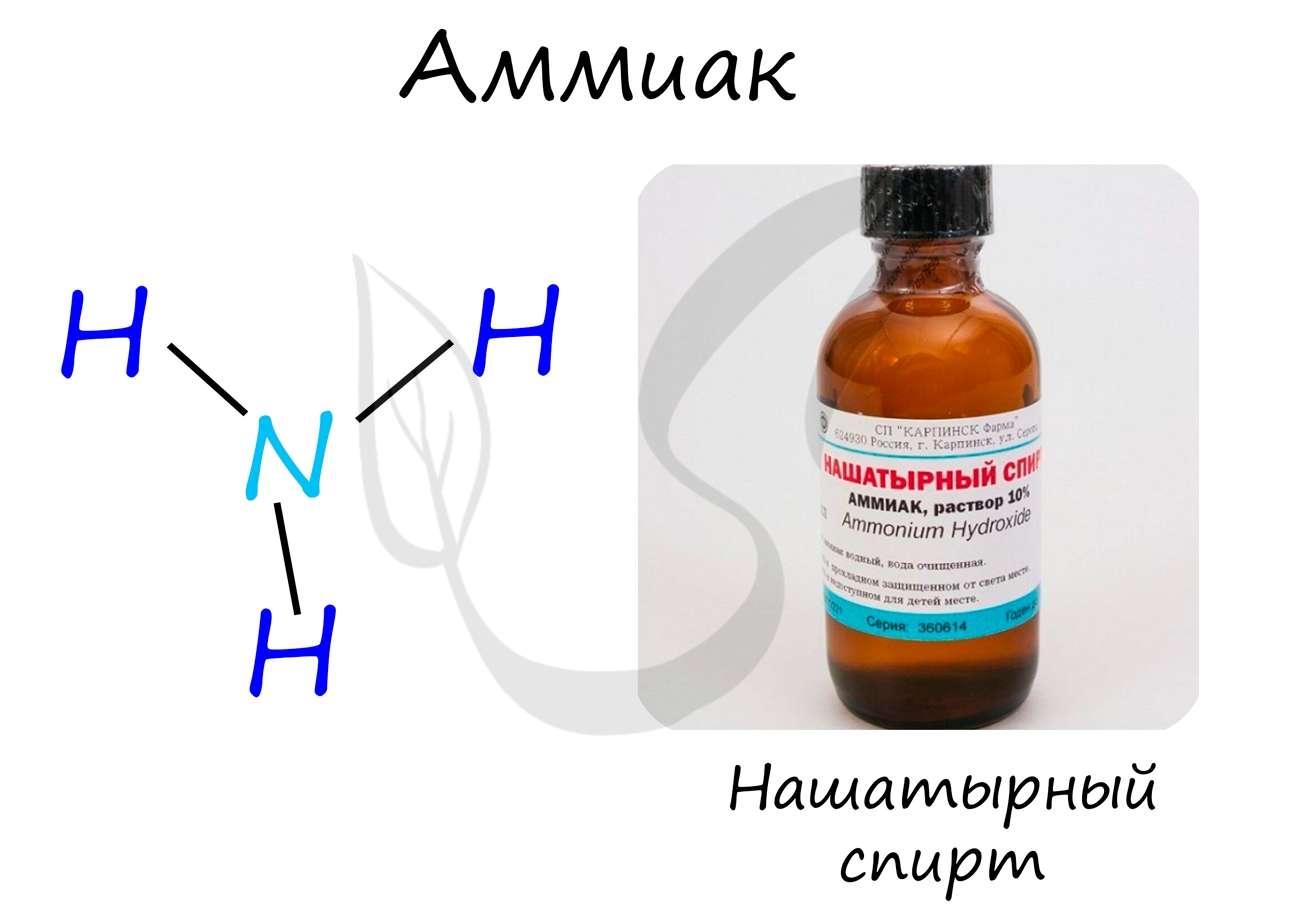
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение – гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода – реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония – NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I – N2O
Закись азота, веселящий газ – N2O – обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II – NO
Окись азота – NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях – в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа – оксида азота IV – NO2.
NO + O2 → NO2

Оксид азота III – N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем
охлаждением полученной смеси газов до температуры – 36 °C.
As2O3 + HNO3 → H3AsO4 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота – HNO2, соли которой называются нитриты (NO2-).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV – NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 – на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам – азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
