Какое из органических веществ проявляет амфотерные свойства

Амфотерность – это очень важная тема школьного курса химии, которая очень часто бывает недопонята учениками старших классов. Если так происходит, в дальнейшем, это может привести к серьезным проблемам на уроках, так как в химии все новые темы базируются на предыдущих.
Сегодня, я хочу поговорить об амфотерности, наиболее простым и доступным языком. Надеюсь, что эта статья сможет стать полезна учащимся школ, проходящим эту тему, учителям при ее объяснение и всем, кто просто хочет разобраться в химии по каким либо причинам.
Начнем мы вот с чего. Есть такие версии Таблицы Менделеева, в которых химические элементы разделены по цветам. Например, периодическая система из школьных учебников по химии от автора О.С. Габриеляна выглядит так:
В ней, черным цветом обозначены знаки металлов, образующих основные оксиды и основания, красным – знаки неметаллов, зеленым – знаки металлов, обладающих амфотерными свойствами.
Теперь вспоминаем другое, когда мы проходили основания, мы должны были заметить, что их образует метал, которому соответствует основный оксид, например:
Na – Na2O – NaOH
K – K2O – KOH
Ca – CaO – Ca(OH)2
Все эти металлы, в периодической системе Д,И. Менделеева обозначены черным цветом.
Так же мы должны были заметить, что в основе кислот лежат неметаллы, которым соответствуют кислотные оксиды, например:
S – SO3 – H2SO4
N – N2O5 – HNO3
P – P2O5 – H3PO4
Cl – Cl2O7 – HCLO4
Все они обозначены в Таблице красным цветом.
Однако, у нас остаются еще и зеленые элементы, которые являются металлами, образующими амфотерные оксиды и гидроксиды. Что же это значит? Давайте начнем с определения амфотерных веществ.
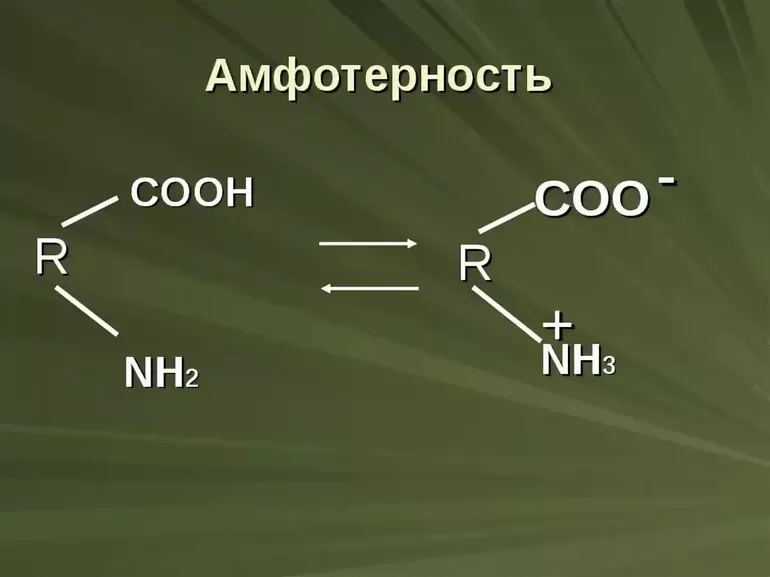
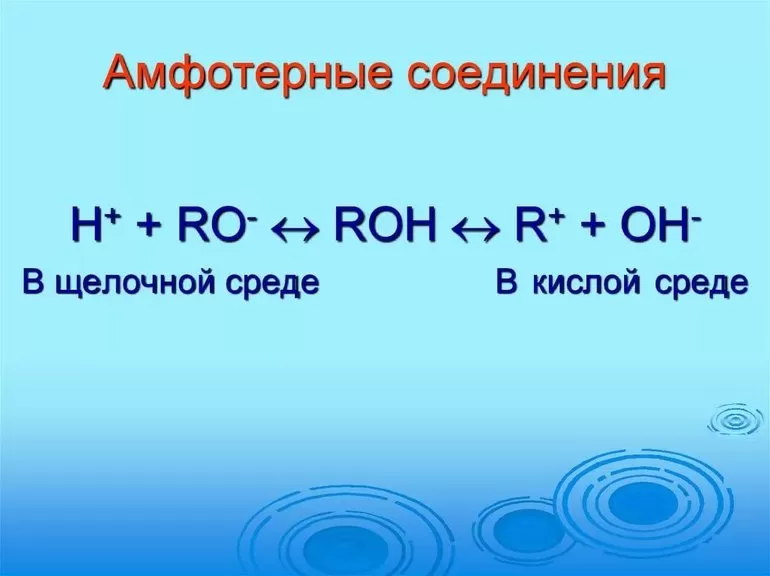
Амфотерные вещества (от греч. Амфотеро – и тот, и другой) – это вещества, которые в зависимости от условий реакций проявляют основные или кислотные свойства.
Чтобы это понять, в школах часто предлагают провести такой эксперимент (или подобный). Возьмем любую водорастворимую соль цинка и добавим в нее немного щелочи, в результате реакции образуется осадок:
ZnCl2 + NaOH = NaCl + Zn(OH)2 (осадок)
Помимо прочего, этот осадок амфотерный гидроксид и сейчас мы это докажем.
Отфильтруем осадок и поместим небольшое его количество в две пробирки. В пробирку №1 добавим несколько миллилитров раствора серной кислоты. При этом осадок растворится, значит реакция будет идти:
Zn(OH)2 + H2SO4 (p-p) = ZnSO4 + 2H2O
В пробирку №2 с высушенным гидроксидом цинка добавим кристаллический гидроксид натрия и нагреем смесь. При этом мы будем наблюдать протекание химической реакции, которая записывается согласно следующей схеме:
Zn(OH)2 + 2NaOH =(сплавление)= Na2ZnO2(цинкат натрия) + H2O
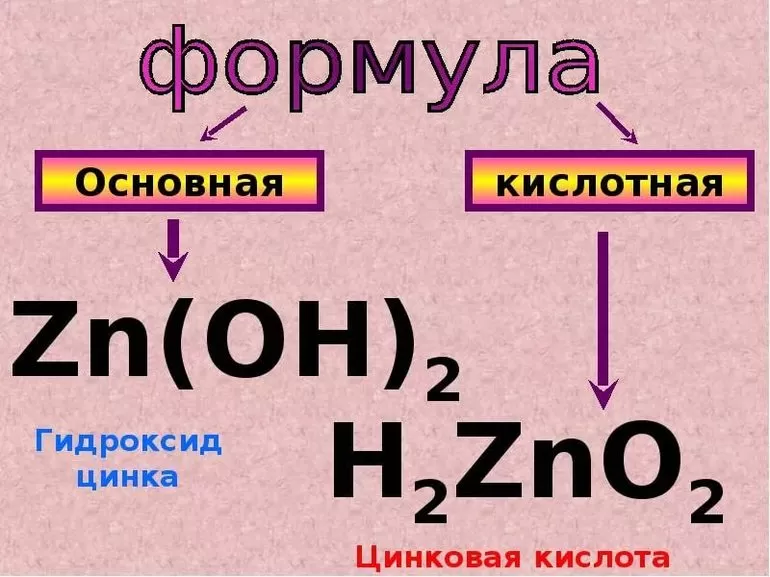
При этом гидроксид цинка проявил свои кислотные свойства, поэтому реакция прошла так. Для простоты написания реакций мы даже можем представить амфотерные гидроксиды в их кислотной форме, например:
Zn(OH)2 – H2ZnO2
H2ZnO2 + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Кстати оксид цинка в точно таких же условиях, поведет себя как кислотный оксид:
ZnO + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Так же точно, дело будет обстоять и с другими амфотерными гидроксидами, например гидроксид алюминия можно представить в форме двух кислот:
Реакция гидроксида алюминия с кислотой будет протекать стандартно:
Al(OH)3 + 3HCL = AlCl3 + 3H20
Реакция гидроксида алюминия со щелочью, будет протекать по схеме:
Al(OH)3 + NaOH =(сплавление)= NaAlO2 + H2O
В данном случае берем остаток метаалюминиевой кислоты, так как очевидно, что при сплавление будет удаляться вода.
Стоит учесть, что в расплаве и растворе данные реакции будут протекать по разному.
Амфотерный гидроксид + Раствор щелочи = Комплексная соль
Al(OH)3 + NaOH → Na[Al(OH)4]
Реакция оксида алюминия и самого алюминия с раствором щелочи будет протекать по следующей схеме:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Точно такие же реакции будут давать другие амфотерные металы, их оксиды и гидроксиды с растворами щелочей, например цинк:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Все очень просто 🙂
Однако, не стоит забывать еще одно очень важное правило. Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Похожем образом дело обстоит и с другими элементами. Например, то же железо может проявлять степени окисления 2+, 3+ и 6+. Но зная правило, мы не растеряемся и отнесем гидроксид железа (II) к основаниям, а гидроксид железа (III) к амфотерным гидроксидам.
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Так как эти элементы могут проявляться в разных степенях окисления, их называют переходными элементами или переходными металлами.
Вот собственно и все.
До новых встреч, уважаемые читатели!
Источник
Амфотерность (от др.-греч. амфотеро — «двойственный»,
«обоюдный») — способность некоторых соединений проявлять в зависимости от
условий как кислотные, так и основные свойства.
Понятие амфотерность как характеристика
двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л.
Тенаром.
Амфотерными называются
оксиды и гидроксиды, которые проявляют и основные и кислотные свойства в
зависимости от условий.
Наиболее
часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды):
ZnO,
Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO,
Sn(OH)2, Al2O3, Al(OH)3, Fe2O3,
Fe(OH)3, Cr2O3, Cr(OH)3
Свойства амфотерных соединений
запомнить не сложно: они взаимодействуют с
ОСНОВНЫЕ СВОЙСТВА
При взаимодействии с кислотами все просто. Амфотерные соединения ведут себя как основания:
Оксиды:
Al2O3 + 6HCl =
2AlCl3 + 3H2O;
ZnO + H2SO4 = ZnSO4 +
H2O;
BeO + HNO3 = Be(NO3)2 +
H2O
Гидроксиды:
Fe(OH)3 + 3HCl = FeCl3 +
3H2O;
Pb(OH)2 + 2HCl = PbCl2 +
2H2O
Таким образом, при описании основных свойств записывают хорошо знакомые уравнения реакций обмена.
КИСЛОТНЫЕ СВОЙСТВА
Сложней для понимания реакция со щелочью. Рассмотрим на примере взаимодействия гидроксида цинка с гидроксидом калия при сплавлении. Амфотерные соединения взаимодействуя с основаниями, ведут себя как кислоты. Вот и запишем гидроксид
цинка Zn(OH)2 как
кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он –
кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) = K2ZnO2 + 2H2O
Полученное
вещество K2ZnO2 называется метацинкат калия (или просто
цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но
для собственного удобства мы про это забудем).
Гидроксид цинка записывать в виде H2ZnO2 не принято. Пишем как обычно Zn(OH)2,
но подразумеваем (для собственного удобства), что это кислота H2ZnO2:
2KOH(тв.) + Zn(OH)2(тв.)
= K2ZnO2 + 2H2O
С гидроксидами при сплавлении, в которых
2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) =Na2BeO2 + 2H2O (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) = Na2PbO2 + 2H2O (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя OH– группами (Al(OH)3, Cr(OH)3, Fe(OH)3) немного
иначе.
Разберем
на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH = H2O + KAlO2
(метаалюминат калия, или просто алюминат)
Но гидроксид алюминия HAlO2 записывать нельзя, записываем как обычно, но подразумеваем кислоту HAlO2:
Al(OH)3(тв.) + KOH(тв.) = 2H2O + KAlO2 (метаалюминат калия)
То
же самое и с гидроксидом хрома (при сплавлении):
Cr(OH)3 → H3CrO3 → HCrO2;
Cr(OH)3(тв.) + KOH(тв.) = 2H2O + KCrO2
(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли
хромовой кислоты).
*С гидроксидами содержащими четыре группы
ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3;
Pb(OH)4 → H4PbO4 → H2PbO3
Следует
помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью
окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4,Pb(OH)4).
Оксид | Гидроксид | Гидроксид в виде | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ |
* Выше было рассмотрено взаимодействие амфотерных соединений с твердыми щелочами при сплавлении, т.е. в отсутствии воды. При взаимодействии с растворами щелочей образуются комплексные соединения:
Al(OH)3 + KOH → K[Al(OH)4]
(тетрагидроксоалюминат калия);
Al(OH)3 + 3KOH → K3[Al(OH)6]
(гексагидроксоалюминат калия).
С растворами щелочей реагируют и амфотерные оксиды. Следует обратить внимание, что в уравнении реакции вода записывается, как исходное вещество, т.е. в левой части уравнения:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6].
Продукты реакций относятся к классу солей и являются растворимыми. Следовательно, при диссоциации распадаются на катион металла и анионы кислотных остатков
[Al(OH)4]- или [Al(OH)6]3-.
Какой продукт писать, не имеет значения. Главное чтобы все индексы были верно проставлены и сумма всех зарядов равнялась нулю.
ПЕРЕХОДНЫЕ МЕТАЛЛЫ
Элементы, образующие амфотерные оксиды и гидроксиды, относятся к металлам. Они как все металлы реагируют с разбавленными кислотами:
2Al + 6HCl = 2AlCl3 + 3H2;
Zn + H2SO4 = ZnSO4 + H2
Наиболее активные металлы, образующие амфотерные оксиды и гидроксиды (алюминий, берилий, цинк), реагируют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
ТРЕНИРУМСЯ!!!
Амфотерные гидроксиды
Амфотерные оксиды
Химические свойства амфотерных гидроксидов
Химические свойства амфотерных оксидов
Источник

Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
В концепции электролитической диссоциации, когда происходит распадение проводящего вещества на отдельные ионы при сплавлении или растворении, субстанция реагирует по кислотному механизму или основным свойствам. В первом случае отщепляются частицы гидроксония, Н+, во втором варианте отделяются гидроксид-анионы, ОН-. Электролиты получают ионы одновременно из нейтральных молекул и атомов, процесс проходит под совместным действием кислотных и генеральных качеств вещества. В этом случае проводящие смеси имеют название амфолитов.
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
- элементы головных подгрупп (алюминий, бериллий, сурьма, галлий, селен, мышьяк);
- участники дополнительных подвидов (вольфрам, цинк, молибден).
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
- заряженная (цвиттер-ион);
- незаряженная форма.
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.

Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
- гидроксиды слабо растворяются в водной среде, поэтому не способствуют приобретению водой основных или кислотных характеристик;
- оксид-гидроксиды имеют особенности, типичные для электроположительных веществ;
- гидроксиды активных металлических групп чаще проявляют характеристики акцепторов элементарных частиц;
- по мере перехода к неметаллам свойства переходят от типичных оснований к амфотерным связкам, т. е. вещества выступают донорами протонов;
- в категории основных гидроксидов с положительными катионами существует ионная спайка, а кислород присоединяется к водороду с помощью ковалентной связи;
- в группе кислотных оксидов кислород имеет ковалентную связь с положительными электрочастицами, а с водородом соединяется полярной сцепкой ионов.
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.

В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.

Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.

Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
- А1 (0Н)3 имеет небольшое показание в области диссоциации, как основание, и представляет собой амфотерный проводящий электролит.
- Оа (0Н)3 является дуалистическим гидроксидом с неизменной константой распада, которая характеризует вещество в качестве основания и одновременно кислоты.
- Переход от Оа (0Н)3 к Т1 (0Н)3 происходит постепенно, также равномерно изменяется реакция в сторону кислотного взаимодействия в результате увеличения металлизации.
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.

В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.
Источник
