Какое число молекул содержится в 1м3

Решениие задач по химии на закон Авогадро
Задача 53.
Сопоставить числа молекул, содержащихся в 1г NH3 и в 1г N2. В каком случае и во сколько раз число молекул больше?
Решение:
В одном моле любого вещества содержится 6,02 . 1023 молекул этого вещества.
Рассчитаем содержание количества вещества в 1г NH3 и N2 по формуле:

 (B) – количество вещества (В);
(B) – количество вещества (В);
m(B)- масса вещества (В);
M(B) – Молярная масса вещества (В).
М(NH3) = 17г/моль, M(N2) = 28г/моль.
Тогда

Число молекул NH3 больше числа молекул N2, так как  (NH3) >
(NH3) > (N2) . Теперь рассчитаем, во сколько раз число молекул NH3 больше числа молекул N2:
(N2) . Теперь рассчитаем, во сколько раз число молекул NH3 больше числа молекул N2:

Ответ: в 1,65 раз число молекул NH3 больше числа молекул N2.
Задача 54.
Выразить в граммах массу одной молекулы диоксида серы.
Решение:
Находим молекулярную массу диоксида серы:
M(SO2) = 32 + (16 . 2) = 64г/моль.
Молекулярная масса численно составляет массу одного моля вещества, а значит, вес одного моля численно равен молекулярной массе и составляет 64г. Известно, что в одном моле любого вещества содержится 6,02 . 1023 молекул данного вещества. Исходя из этого, рассчитаем массу в граммах одной молекулы диоксида серы:

Ответ: масса одной молекулы диоксида серы равна.
Задача 55.
Одинаково ли число молекул в 0,001кг Н2 и в 0,001кг О2? В 1 моле Н2 и в 1 моле 02? В 1л Н2 и в 1л О2 при одинаковых условиях?
Решение:
Молекулярные массы водорода и кислорода равны соответственно 2г/моль и 32г/моль. Отсюда находим количество водорода и кислорода, зная их массы:

Один моль любого вещества содержит 6,02 .1023 молекул. Следовательно, в 0,001кг водорода и в 0,001кг кислорода содержится разное число молекул:

Так как имеется по одному молю водорода и кислорода, то количество молекул веществ будет одинаково:

Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда рассчитаем количество молекул вещества, содержащихся в 1л водорода и в 1л кислорода:

Ответ: а) в 0,001кг водорода и в 0,001кг кислорода содержится разное число молекул; б) в одном моле водорода и в одном моле кислорода содержится одинаковое число молекул: в) в одном литре водорода и в одном литре кислорода содержится одинаковое число молекул.
Задача 56.
Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 .1023 молекул. Отсюда рассчитаем количество молекул вещества, содержащихся в 1мл водорода из пропорции:

Ответ: 2,69 .1019 молекул.
Задача 57.
Какой объем при нормальных условиях занимают 27 .1021 молекул газа?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда находим какой объём при нормальных условиях занимают 27 .1021 молекул газа, составив пропорцию:

Ответ: V=1л.
Задача 58.
Каково соотношение объемов, занимаемых 1 молем О2 и 1 молем О3 (условия одинаковые)?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Следовательно соотношение объёмов, занимаемых одним молем О2 и одним молем О3 иметь вид:

Ответ: 1:1
Задача 59.
Взяты равные массы кислорода, водорода и метана при одинаковых условиях. Найти отношение объемов взятых газов.
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Мольные массы кислорода, водорода и метана, соответственно равны 32 г/моль; 2г/моль; 16 г/моль.
Так как массы кислорода, водорода и метана одинаковы при одинаковых условиях, то отношение объёмов взятых газов находим из пропорции:

Ответ: 1:16:2.
Задача 60.
На вопрос, какой объем займет 1моль воды при нормальных условиях, получен ответ: 22,4л. Правильный ли это ответ?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Так как вода при нормальных условиях находится в жидкой, а не в газообразной фазе, то ответ, что 1моль воды займёт 22,4л не правильный. Учитывая, что молярная масса воды равна 18г/моль, а плотность равна единице, то правильный ответ будет равен:

Ответ: 18мл.
Задача 61.
Сколько молекул диоксида углерода находится в 1л воздуха, если объемное содержание СО2 составляет 0,03% (условия нормальные)?
Решение:
При нормальных условиях углекислый газ, содержащийся в 1л воздуха, занимает объём 0,0003л. Зная, что мольный объём любого газа занимает 22,4л, рассчитаем число молей углекислого газа в 0,0003л из пропорции:

Учитывая, что в одном моле вещества содержится 6,02 . 1023 молекул, находим число молекул в 0,0003л газа:

Ответ: 8,07 .1018 молекул.
Источник
1
Сколько молекул содержится в 1 см3 воды? Какова масса молекулы воды? Каков приблизительный размер молекулы воды?
Ответ и решение
n = 3,33·1022 1/см3; m = 2,99·10-26 кг; a = 3,11·10-10 м.
Масса 1 моля воды составляет 18 г, а его объем V — 18 см3. В 1 моле воды содержится число молекул, равное постоянной Авогадро NА = 6·1023. Число молекул в 1 см3n = NА/V = 3,33·1022. Масса одной молекулы m = 18/NА = 3·10-26 кг. Объем V0 одной молекулы приблизительно равен 1/n см3. Тогда размер молекулы составит
.
2
Хорошо откачанная лампа накаливания объемом 10 см3 имеет трещину, в которую ежесекундно проникает миллион частиц газа. Сколько времени понадобится для наполнения лампы до нормального давления, если скорость проникновения газа остается постоянной? Температура 0 °С.
Ответ и решение
t ≈ 8,5 млн. лет.
Найдем число частиц газа, необходимое для наполнения лампы:
N = VNЛ = 10·2,69·1019 см3·см-3 = 2,69·1020,
где V – объем лампы, NЛ – постоянная Лошмидта.
Время, необходимое для наполнения лампы со скоростью v = 106 с-1, равно:
t = N/v = 2,69·1020/(106·с-1) = 2,69·1014 c ≈ 8,5 млн. лет.
3
За 10 суток полностью испарилось из стакана 100 г воды. Сколько в среднем вылетало молекул с поверхности воды за 1 с?
Ответ и решение
≈ 3,8·1018 молекул в секунду.
Переведем время t испарения воды из суток в секунды:
t = 10 сут. = 8,64·105 с.
Поскольку 1 моль воды имеет массу 18 г, то, используя постоянную Авогадро, можно найти число N молекул в 100 г воды:
N = NА·100/18 = 3,3·1024 шт.
Теперь найдем скорость v испарения воды:
v = N/t ≈ 3,8·1018 c-1.
4
В озеро средней глубиной 10 м и площадью 10 км2 бросили кристаллик поваренной соли NaCl массой 0,01 г. Сколько ионов хлора оказалось бы в наперстке воды объемом 2 см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась в озере?
Ответ и решение
≈ 2·106 ионов.
1 моль поваренной соли имеет массу 58,5 г, из которых 23 г — масса натрия, а 35,5 г — масса хлора. Чтобы рассчитать массу хлора в брошенном кристаллике хлора, решим систему из двух уравнений:
m(Na) + m(Cl) = 0,01
m(Na)/m(Cl) = 0,65
Из системы получим, m(Cl) = 6·10-3 г.
Теперь можно вычислить число частиц хлора N(Cl):
N(Cl) = NA· 6·10-3/35,5 ≈ 1020 ионов хлора.
Число ионов хлора в наперстке будет меньше полученного числа во столько раз, во сколько раз объем наперстка меньше объема озера. Найдем это число:
N = 1020·2·10-6/108 = 2·106 ионов хлора в наперстке.
5
Кристаллы поваренной соли NaCl кубической системы состоят из чередующихся атомов (ионов) Na и Cl.

Определить наименьшее расстояние между их центрами. Молярная масса поваренной соли ν = 58,5 г/моль, а ее плотность ρ = 2,2 г/см3.
Ответ и решение
r = 2,83·10-8 см.
Найдем сторону a куба, который занимает объем одного моля поваренной соли:
a =  = 3 см.
= 3 см.
Найдем, какое число ионов натрия и хлора приходится на одно ребро куба (общее число ионов натрия и хлора в 1 моле поваренной соли равно удвоенному числу молекул NaCl, т.е. 2NА):
n = 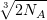 ≈ 108 ионов.
≈ 108 ионов.
Теперь найдем расстояние между ионами:
l = a/n = 2,83·10-8 см.
6
Кубическая кристаллическая решетка железа содержит один атом железа на элементарный куб, повторяя который, можно получить всю решетку кристалла. Определить расстояние между ближайшими атомами железа, если плотность железа ρ = 7,9 г/см3, атомная масса А = 56.
Ответ и решение
2,3·10-8 см.
Найдем сторону a куба, который занимает объем одного моля железа:
a =  = 1,9 см.
= 1,9 см.
Найдем, какое число атомов железа приходится на одно ребро куба (общее число атомов железа в 1 моле равно NА):
n = ≈ 8,4·107 атомов.
≈ 8,4·107 атомов.
Теперь найдем расстояние между атомами железа:
l = a/n = 2,3·10-8 см.
7
На пути молекулярного пучка стоит «зеркальная» стенка. Найти давление, испытываемое этой стенкой, если скорость молекул в пучке v = 103 м/с, концентрация n = 5·1017 1/м3, масса m = 3,32·10-27 кг. Рассмотреть три случая: а) стенка расположена перпендикулярно скорости пучка и неподвижна; б) пучок движется по направлению, составляющему со стенкой угол α = 45°; в) стенка движется навстречу молекулам со скоростью u = 50 м/с.
Ответ
а) pа ≈ 3,3·10-3 Па; б) pб ≈ 2,4·10-3 Па; в) pв ≈ pа.
8
Как изменилось бы давление в сосуде с газом, если бы внезапно исчезли силы притяжения между его молекулами?
Ответ
Источник
Решениие задач по химии на закон Авогадро
Задача 53.
Сопоставить числа молекул, содержащихся в 1г NH3 и в 1г N2. В каком случае и во сколько раз число молекул больше?
Решение:
В одном моле любого вещества содержится 6,02 . 1023 молекул этого вещества.
Рассчитаем содержание количества вещества в 1г NH3 и N2 по формуле:

 (B) – количество вещества (В);
(B) – количество вещества (В);
m(B)- масса вещества (В);
M(B) – Молярная масса вещества (В).
М(NH3) = 17г/моль, M(N2) = 28г/моль.
Тогда

Число молекул NH3 больше числа молекул N2, так как  (NH3) >
(NH3) > (N2) . Теперь рассчитаем, во сколько раз число молекул NH3 больше числа молекул N2:
(N2) . Теперь рассчитаем, во сколько раз число молекул NH3 больше числа молекул N2:

Ответ: в 1,65 раз число молекул NH3 больше числа молекул N2.
Задача 54.
Выразить в граммах массу одной молекулы диоксида серы.
Решение:
Находим молекулярную массу диоксида серы:
M(SO2) = 32 + (16 . 2) = 64г/моль.
Молекулярная масса численно составляет массу одного моля вещества, а значит, вес одного моля численно равен молекулярной массе и составляет 64г. Известно, что в одном моле любого вещества содержится 6,02 . 1023 молекул данного вещества. Исходя из этого, рассчитаем массу в граммах одной молекулы диоксида серы:

Ответ: масса одной молекулы диоксида серы равна.
Задача 55.
Одинаково ли число молекул в 0,001кг Н2 и в 0,001кг О2? В 1 моле Н2 и в 1 моле 02? В 1л Н2 и в 1л О2 при одинаковых условиях?
Решение:
Молекулярные массы водорода и кислорода равны соответственно 2г/моль и 32г/моль. Отсюда находим количество водорода и кислорода, зная их массы:

Один моль любого вещества содержит 6,02 .1023 молекул. Следовательно, в 0,001кг водорода и в 0,001кг кислорода содержится разное число молекул:

Так как имеется по одному молю водорода и кислорода, то количество молекул веществ будет одинаково:

Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда рассчитаем количество молекул вещества, содержащихся в 1л водорода и в 1л кислорода:

Ответ: а) в 0,001кг водорода и в 0,001кг кислорода содержится разное число молекул; б) в одном моле водорода и в одном моле кислорода содержится одинаковое число молекул: в) в одном литре водорода и в одном литре кислорода содержится одинаковое число молекул.
Задача 56.
Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 .1023 молекул. Отсюда рассчитаем количество молекул вещества, содержащихся в 1мл водорода из пропорции:

Ответ: 2,69 .1019 молекул.
Задача 57.
Какой объем при нормальных условиях занимают 27 .1021 молекул газа?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда находим какой объём при нормальных условиях занимают 27 .1021 молекул газа, составив пропорцию:

Ответ: V=1л.
Задача 58.
Каково соотношение объемов, занимаемых 1 молем О2 и 1 молем О3 (условия одинаковые)?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Следовательно соотношение объёмов, занимаемых одним молем О2 и одним молем О3 иметь вид:

Ответ: 1:1
Задача 59.
Взяты равные массы кислорода, водорода и метана при одинаковых условиях. Найти отношение объемов взятых газов.
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Мольные массы кислорода, водорода и метана, соответственно равны 32 г/моль; 2г/моль; 16 г/моль.
Так как массы кислорода, водорода и метана одинаковы при одинаковых условиях, то отношение объёмов взятых газов находим из пропорции:

Ответ: 1:16:2.
Задача 60.
На вопрос, какой объем займет 1моль воды при нормальных условиях, получен ответ: 22,4л. Правильный ли это ответ?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Так как вода при нормальных условиях находится в жидкой, а не в газообразной фазе, то ответ, что 1моль воды займёт 22,4л не правильный. Учитывая, что молярная масса воды равна 18г/моль, а плотность равна единице, то правильный ответ будет равен:

Ответ: 18мл.
Задача 61.
Сколько молекул диоксида углерода находится в 1л воздуха, если объемное содержание СО2 составляет 0,03% (условия нормальные)?
Решение:
При нормальных условиях углекислый газ, содержащийся в 1л воздуха, занимает объём 0,0003л. Зная, что мольный объём любого газа занимает 22,4л, рассчитаем число молей углекислого газа в 0,0003л из пропорции:

Учитывая, что в одном моле вещества содержится 6,02 . 1023 молекул, находим число молекул в 0,0003л газа:

Ответ: 8,07 .1018 молекул.
Источник
