Какими свойствами отличаются изомеры

Различия изомеров по свойствам.
Понятие изомерии является в современной химии одним из основных. Впервые учащиеся с ним знакомятся в курсе органической химии, обычно в 10 классе. В учебниках различия свойств изомеров приводится по мере последовательного изучения веществ различных классов и в результате, к моменту завершения курса, в лучшем случае сохраняются лишь разрозненные сведения, освещающие этот вопрос.
В настоящей работе сделана попытка обобщения данного материала, что может быть полезным на итоговых уроках по курсу органической химии, особенно при профильном обучении в свете новых ФГОС, а также на факультативах и элективных курсах по предмету.
В основу систематизации различий изомеров по свойствам были положены параметры, характеризующие именно эти различия, а не классы соединений. Это освещает проблему с несколько иной стороны и дает учителю возможность как использовать приведенные ниже примеры, так и предложить учащимся подобрать примеры собственные, что, конечно, поможет выработать взгляд на курс органической химии как на единое целое.
Традиционно, описывать различие изомеров начинают с физических свойств веществ, принадлежащих к разным классам, например, этанола и диметилового эфира. Вместе с тем, это можно показать и на примере веществ одного класса. Так натуральный каучук (цис- изомер) эластичен, тогда как гуттаперча (транс- изомер) обладает лишь пластичностью.
Различия по температурам кипения можно показать как на примере алканов
2,2-диметилбутан кипит при 50о С, а н- гексан при 69о С. Такое различие показывает, что разветвленные изомеры имеют температуры кипения ниже, чем неразветвленные.
Геометрические изомеры – малеиновая и фумаровая кислоты – плавятся при разных температурах ( соответственно, 130,5о C и 187о С). Видимо играет роль характер водородных связей. У малеиновой кислоты преобладают внутримолекулярные, а у фумаровой – межмолекулярные водородные связи.
Изомеры различаются и скоростями однотипных реакций в которые они вступают. В частности, 2-метилбутан в реакциях радикального галогенирования более активен, чем 2,2-диметилпропан, так как было установлено, что водород при третичном атоме углерода замещается легче, нежели при первичном.
Эти же кинетические различия проявляются и в реакциях электрофильного замещения у аренов. Пропилбензол галогенируется или нитруется медленнее, чем изопропилбензол, ведь более разветвленный радикал проявляет индуктивный эффект большей величины, что облегчает подобные реакции.
Изомеры, имеющие одну и ту же функциональную группу могут вести себя по разному. Пара-метилфенол легко нейтрализуется раствором щелочи, тогда как бензиловый спирт со щелочами практически не реагирует. В этом, в частности, проявляется разница в поведении фенольного и спиртового гидроксила.
Таутомерные формы глюкозы различаются, например, отношением к реактиву Толленса. В реакцию серебряного зеркала вступает только линейная форма, тогда как циклические формы этой реакции не дают.
Возможно у изомеров протекание реакций с одним и тем же реагентом, но по различным механизмам. Галогенирование пропена протекает по электрофильному механизму, а механизм галогенирования циклопропана, видимо, радикальный.
Образование продуктов разных классов также может иллюстрировать различия изомеров по свойствам. Пентадиен-1,4 при гидратации образует непредельный двухатомный спирт, а любой изомерный алкин – кетон.
Направление реакций при действии одного реагента на изомеры может быть различным. В амиде молочной кислоты при действии хлороводорода гидроксил замещается хлором, аминогруппа при этом сохраняется. Аминопропионовая кислота же охотно образует соль – гидрохлорид.
Возможно также образование разного числа продуктов реакции. При гидрогалогенировании бутена-1, как и в других подобных реакциях, несмотря на правило Марковникова, все равно образуется два продукта, один из которых преобладает. Бутен-2 образует единственный продукт.
В заключение, следует отметить, что приведенные примеры далеко не исчерпывают рассматриваемую тему. Ведь изомерия возможна и для неорганических соединений. Гремучая кислота (НОNС) сильно отличается по свойствам от циановой кислоты (НОСN). Цис и транс формы дихлордиамминплатины обладают принципиально разной противоопухолевой активностью. «Изомерию», если можно так выразиться, можно встретить даже в русском языке, ведь слова НОС и СОН; ПАЛЬТО и ЛАПОТЬ; АПЕЛЬСИН и СПАНИЕЛЬ по сути дела тоже «изомерны».
В.О.Воробьев, учитель химии ГОУ №77, методист ИМЦ Петроградского района Санкт-Петербурга.
Источник
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Источник
Изомерия (от др.-греч. ἴσος — равный + μέρος — доля, часть) — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Исторические сведения[править | править код]
В итоге дискуссии Ю. Либиха и Ф. Вёлера в 1823 году было установлено, что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO (англ.)русск.) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 году ввёл термин «изомерия» и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (то есть, в современных терминах, молекуле).
Подлинное объяснение изомерия получила лишь во 2-й половине XIX века на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия[править | править код]
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеродной цепи (углеродного скелета)[править | править код]
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия[править | править код]
Валентная изомерия — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы (межклассовая изомерия)[править | править код]
Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
Изомерия положения[править | править код]
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Метамерия[править | править код]
Метамерия — вид структурной изомерии, для которого характерно различное распределение углеродных атомов между несколькими углеводородными радикалами, разделёнными в молекуле гетероатомом. Метамерия известна в рядах алифатических простых эфиров, сложных эфиров, тиоспиртов и аминов. В настоящее время термин используется редко.
На данный вид изомерии ещё указывал А. М. Бутлеров, называя его «изомерия нецельных структур».
Пример: CH3CH2OCH2CH3 — диэтиловый эфир и CH3OCH2CH2CH3 — метилпропиловый эфир.
Пространственная изомерия (стереоизомерия)[править | править код]
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Для обозначения пространственных изомеров разных типов разработана стереохимическая номенклатура, собранная в разделе E номенклатурных правил ИЮПАК по химии[источник не указан 3591 день].
Этот тип изомерии подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерия (оптическая изомерия)[править | править код]
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идёт об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6′-динитро-2,2′-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Диастереомерия[править | править код]
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ—диастереомерия[править | править код]
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
π—диастереомерия (геометрическая изомерия)[править | править код]
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Изомеризация[править | править код]
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией. Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырьё для производства капрона).
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (−)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров это обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени — числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов — более 500 (известно из них около 70), пространственных изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы.
Литература[править | править код]
- Физер Л., Физер М. Органическая химия. Углубленный курс. т. 1. пер. с англ., Под ред. д. х. н. Н. С. Вульфсона. Изд. «Химия». М., 1969.
- Пальм В. А. Введение в теоретическую органическую химию, М., 1974;
- Соколов В. И. Введение в теоретическую стереохимию, М., 1979;
- Сланина 3. Теоретические аспекты явления изомерии в химии, пер. с чешского, М., 1984;
- Потапов В. М. Стереохимия М., 1988.
- Большой энциклопедический словарь. Химия. Изд.: Большая Российская энциклопедия, 2003, ISBN 5-85270-253-6
См. также[править | править код]
- Таутомерия
- Хиральность
- Асимметрический атом
- Модели орбиталей
- Раскристаллизация энантиомеров
Источник

Определение понятия

В 1823 году завязался спор между учеными Ф. Велером и Ю. Либихом из-за разных свойств одного вещества — AgCNO. Эта формула соответствовала и гремучему, и циановокислому серебру. Второй подобный случай произошел с Й. Берцелиусом. Он исследовал виноградную и винную кислоты и в 1830 году впервые использовал термин «изомерия». Это явление ученый объяснил тем, что простые атомы таблицы Менделеева по-разному распределяются в молекуле.
И лишь во второй половине XIX века появилось подлинное определение термина. В его основание легли стереохимическое учение Я. Вант-Гоффа и теории строения А. Бутлерова. Первый выявил пространственную изомерию, второй — структурную. Сегодня это название носит явление, которое заключается в существовании соединений с одинаковой массой и атомным составом, но разным расположением в пространстве и строением.
Структурный тип
Существует несколько типов изомерии. Структурным является тот, при котором различия наблюдаются в химическом строении молекулы. Сюда можно отнести несколько видов:
- углеродного скелета;
- валентную;
- межклассовую;
- положения;
- метамерию.
Разный порядок связи атомов обуславливает изомерию углеродного скелета. Самые простые примеры для этого случая: бутан и изобутан. Формула первого — СН3-СН2-СН2-СН3, а второго — (СН3)3СН. Сюда же можно отнести такие вещества, как фенантрен и антрацен, метилциклопропан и циклобутан. А также структурная изомерия характерна для гомологического ряда алканов.
Валентной изомерией называется вид структурной, при котором атомы переходят из одного в другой только благодаря перераспределению связей. То есть у каждого вещества есть свои изомеры: у бензола это призман, бензол Дьюара и бензвален.
Если отличается характер функциональной группы, то говорят о межклассовом типе. К нему относят диметиловый эфир и этанол: СН3-О-СН3 и СН3-СН2-ОН. Отличия в положении одних и тех же кратных связей или функциональных групп при общем углеродном скелете — характерные черты одноименной изомерии. Основные примеры: 4-хлорбутановая кислота или 2-хлорбутановая кислота.
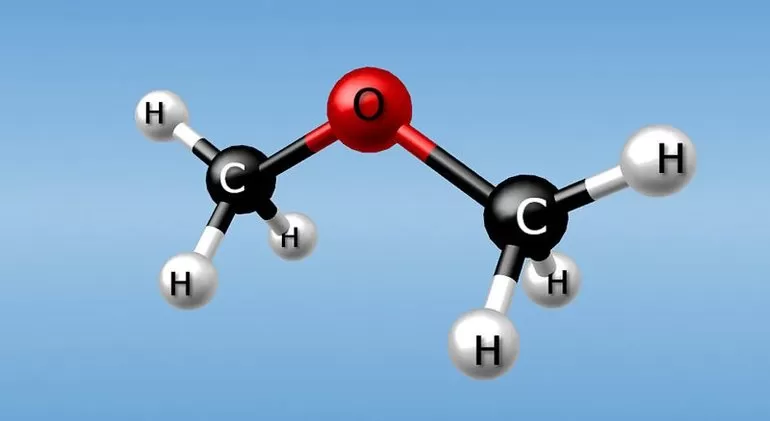
Метамерия — еще один вид изомерии органических соединений. Его особенности заключаются в том, что атомы углерода по-разному распределяются между углеводородными радикалами, которые разделены гетероатомом. Известен этот тип в числе простых и сложных эфиров, аминов и тиоспиртов. Но сегодня это понятие редко используется. А. Бутлеров называл явление изомерией нецельных структур, а наглядными примерами служат диэтиловый и метилпропиловый эфир: СН3СН2ОСН2СН3 и СН3ОСН2СН2СН3.
Особенности стереоизомерии

Причина возникновения пространственной или стереоизомерии — молекулы различаются в пространственной конфигурации, но имеют абсолютно одинаковое химическое строение. Их обозначают с помощью специальной стереохимической номенклатуры, собранной в разделе Е правил ИЮПАК.
Эту группу делят на несколько видов:
- энантиомерия или оптическая изомерия;
- диастереомерия;
- геометрический тип.
Если комбинация пространственных изомеров не составляет пару антиподов, то их относят к диастереомерам. Такие молекулы имеют различную конфигурацию элементов хиральности.
Подобные вещества: D -манноза и D -глюкоза, винная и мезовинная кислота. Другие виды стереоизомерии лучше рассмотреть более детально.
Геометрический вид
Геометрическая классификация характеризуется одинаковым порядком соединения атомов при разном их расположении. В таких изомерах стереогенная группа — это малые циклы или кратная связь. Но они могут существовать только при наличии функциональных соединений. Названия такого явления могут отличаться — транс и цис изомерия.
В первом случае отличающиеся заместители находятся по разные стороны от двойной связи. А во втором одинаковые элементы при разных углеродных атомах имеют общее место расположения. Разные заместители обозначают латинскими буквами E — entgegen или Z — zusammen. Если необходимо установить тип конфигурации, то определяют старшинство атомов, сравнивают их порядковые числа.

Пометку буквой Z имеют изомеры, в которых оба старших заместителя расположены на одной стороне связи. А у E-молекул они находятся по разным бокам. Пример расчетов: вещество с формулой 1-бром-1-хлор-2-нитроэтилена, старшие заместители — Н с номером 1, Br (35), N (7) и Cl (17). В первом атоме углерода главнее бром (35), во втором — азот (7). Они находятся по разным сторонам, поэтому изомер относится к группе E. А если старший заместитель у первого атома Cl (17), а у второго Br (35), то это Z-изомер.
Иногда элементы одинаковы, они связаны с ненасыщенными атомами углерода, тогда необходимо сравнивать второй и третий слой молекулы. Если в конкретном примере заместители одинаковы, то нужно рассматривать следующие группы.
Оптическая группа
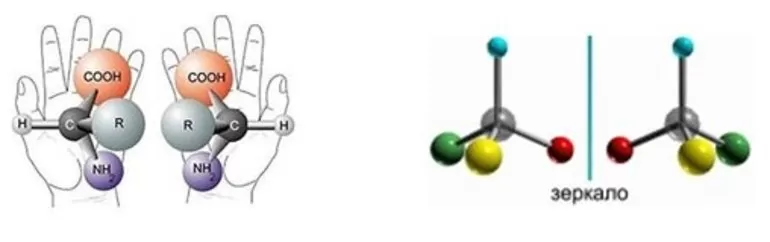
В 19 веке ученые выявили, что при пропускании поляризованных лучей через некоторые виды веществ, они отклоняют плоскость света на определенный угол. Есть также два соединения, которые искажают поляризацию на углы, одинаковые по величине, но разные по знаку. Эти молекулы получили название оптических изомеров — энантиомеров или антиподов.
Если в составе смеси содержится одинаковое количество изомеров, которые вращаются в разные стороны, то ее называют рацемической. Вещества, содержащие один и более асимметричных атомов углерода, считаются оптически активными. Два таких изомера отличаются, как какой-либо предмет и его отражение в зеркале. Если их наложить друг на друга, то они не совпадут — хиральные молекулы. Но иногда они полностью идентичны — ахиральные вещества.
К хиральным, кроме углерода, относятся соединения с атомами кремния, фосфора, азота. У них есть общая черта — стереогенная плоскость или ось. Изобразить такие изомеры можно с помощью уравнений Фишера. Ключевые моменты построения:
- проекции связей, направленных от зрителя, рисуют вертикальной пунктирной линией;
- устремленные к наблюдателю — горизонтальная черта;
- центр их пересечения называется хиральным — это асимметричный атом углерода;
- на концах линий изображают заместители.
В этой схеме не нужно рисовать символ атома углерода. Но если центром является другая частица, то ее необходимо подписать. При изображении заместителей строго соблюдают их пространственное расположение.
Химические превращения

Явление, при котором структурные изомеры превращаются один в другой, называют изомеризацией. Эти процессы особенно важны в промышленности. Есть особая технология превращения алканов в изоалканы, что повышает октановое число моторного топлива. Пентан изомеризуется в изопентан, затем его дегидрируют и создают изопрен.
Перегруппировки внутри молекул также считаются изомеризацией. Большое значение в промышленности имеет явление Бекмана — циклогексаноноксим переходит в капролактам, так называется сырье для изготовления капрона.
Рацемизацией является процесс взаимного превращения энантиомеров. Следствие этого явления — исчезновение оптической активности из-за появления эквимолярной смеси отрицательных и положительных форм. Диастереомеры при взаимопревращении образуют тремодинамически устойчивую смесь. А процесс с конформационными изомерами называется одноименным равновесием.
Изомерия приводит к увеличению известных и потенциально возможных соединений. Ученые выявили более 500 видов структурных дециловых спиртов, 1500 пространственных изомеров. Для подсчетов используются специальные математические формулы, а при рассмотрении проблем химического явления применяют топологические методы.
Источник
