Какими свойствами обладало вещество из электронов

Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
По электропроводящим свойствам все вещества можно разделить на проводники, изоляторы и полупроводники; такая классификация обусловлена раположением электронов в атомах этих веществ.
При формировании кристаллических решеток твердых тел из атомов различных веществ валентные электроны, расположенные на внешних орбитах атомов, различным образом взаимодействуют друг с другом и, как следствие, ведут себя по-разному (см. Зонная теория проводимости твердых тел и Теория молекулярных орбиталей). Таким образом, свобода валентных электронов перемещаться внутри вещества обусловливается его молекулярно-кристаллической структурой. В целом же, по электропроводящим свойствам все вещества можно (с некоторой долей условности) подразделить на три категории, каждая из которых обладает ярко выраженными характеристиками поведения валентных электронов под воздействием внешнего электрического поля.
Проводники
В некоторых веществах валентные электроны свободно перемещаются между атомами. Прежде всего, к этой категории относятся металлы, в которых электроны внешних оболочек буквально находятся в «общей собственности» атомов кристаллической решетки (см. Химические связи и Электронная теория проводимости). Если подать на такое вещество электрическое напряжение (например, подключить к двум его концам полюса аккумуляторной батареи), электроны начнут беспрепятственное упорядоченное движение в направлении южного полюса разности потенциалов, создавая, тем самым, электрический ток. Токопроводящие вещества подобного рода принято называть проводниками. Самые распространенные в технике проводники — это, конечно же, металлы, прежде всего медь и алюминий, обладающие минимальным электрическим сопротивлением и достаточно широко распространенные в земной природе. Именно из них, в основном, изготавливаются и высоковольтные электрические кабели, и бытовая электропроводка. Имеются и другие виды материалов, обладающих хорошей электропроводностью, — это, в частности, солевые, щелочные и кислотные растворы, а также плазма и некоторые виды длинных органических молекул.
В этой связи важно помнить, что электропроводность может быть обусловлена наличием в веществе не только свободных электронов, но и свободных положительно и отрицательно заряженных ионов химических соединений. В частности, даже в обычной водопроводной воде растворено столько всевозможных солей, разлагающихся при растворении на отрицательно заряженные катионы и положительно заряженные анионы, что вода (даже пресная) является весьма хорошим проводником, и об этом нельзя забывать, работая с электрооборудованием в условиях повышенной влажности — иначе можно получить весьма ощутимый удар током.
Изоляторы
Во многих других веществах (в частности, в стекле, фарфоре, пластмассах) электроны прочно привязаны к атомам или молекулам и не способны к свободному перемещению под воздействием приложенного извне электрического напряжения. Такие материалы называются изоляторами.
Чаще всего в современной технике в качестве электроизоляторов используются различные пластмассы. По сути, любой пластик состоит из полимерных молекул — то есть очень длинных цепочек органических (водородно-углеродных) соединений, — которые, к тому же, образуют сложные и весьма прочные взаимные переплетения. Проще всего структуры полимера представить себе в виде тарелки перепутавшейся и слипшейся длинной и тонкой лапши. В таких материалах электроны прочно привязаны к своим сверхдлинным молекулам и не способны покинуть их под воздействием внешнего напряжения. Хорошими изоляционными свойствами обладают и аморфные вещества, такие как стекло, фарфор или резина, не имеющие жесткой кристаллической структуры. Они также нередко используются в качестве электроизоляторов.
И проводники, и изоляторы играют важную роль в нашей техногенной цивилизации, использующей электричество в качестве основного средства передачи энергии на расстоянии. По проводникам электроэнергия поступает от электростанций в наши дома и на всевозможные производственные предприятия, а изоляторы обеспечивают нашу безопасность, ограждая от губительных последствий прямого контакта человеческого организма с высоким электрическим напряжением.
Полупроводники
Наконец, имеется малочисленная категория химических элементов, занимающих промежуточное положение между металлами и изоляторами (самые известные из них — кремний и германий). В кристаллических решетках этих веществ все валентные электроны, на первый взгляд, связаны химическими связями, и свободных электронов для обеспечения электрической проводимости, казалось бы, оставаться не должно. Однако на деле ситуация выглядит несколько иначе, поскольку часть электронов оказывается выбитой со своих внешних орбит в результате теплового движения по причине недостаточной энергии их связи с атомами. В результате при температуре выше абсолютного нуля они все-таки обладают определенной электропроводностью под воздействием внешнего напряжения. Коэффициент проводимости у них достаточно низкий (тот же кремний проводит электрический ток в миллионы раз хуже меди), но какой-то ток, пусть и незначительный, они все-таки проводят. Такие вещества называют полупроводниками.
Как выяснилось в результате исследований, электрическая проводимость в полупроводниках, однако, обусловлена не только движением свободных электронов (так называемой n-проводимостью за счет направленного движения отрицательно заряженных частиц). Имеется и второй механизм электропроводности — при этом весьма необычный. При высвобождении электрона из кристаллической решетки полупроводника за счет теплового движения на его месте образуется так называемая дырка — положительно заряженная ячейка кристаллической структуры, которая может в любой момент оказаться занятой отрицательно заряженным электроном, перескочившим в нее с внешней орбиты соседнего атома, где, в свою очередь, образуется новая положительно заряженная дырка. Такой процесс может продолжаться сколь угодно долго — и выглядеть со стороны (в макроскопическом масштабе) всё будет так, что электрический ток под внешним напряжением обусловлен не движением электронов (которые всего лишь перескакивают с внешней орбиты одного атома на внешнюю орбиту соседнего атома), а направленной миграцией положительно заряженной дырки (дефицита электрона) в направлении отрицательного полюса приложенной разности потенциалов. В итоге в полупроводниках наблюдается и второй тип проводимости (так называемая дырочная или p–проводимость), обусловленная, конечно же, также движением отрицательно заряженных электронов, но, с точки зрения макроскопических свойств вещества, представляющаяся направленным током положительно заряженных дырок к отрицательному полюсу.
Явление дырочной проводимости проще всего проиллюстрировать на примере дорожной пробки. По мере продвижения вперед машины, застрявшей в ней, на ее месте образуется свободное пространство, которое тут же занимает следующая машина, место которой сразу же занимает третья машина и т. д. Этот процесс можно представить себе двояко: можно описывать редкое продвижение отдельных машин из числа стоящих в длинной пробке; проще, однако, характеризовать ситуацию с точки зрения эпизодического продвижения в противоположном направлении немногочисленных пустот между застрявшими в пробке машинами. Именно руководствуясь подобной аналогией, физики и говорят о дырочной проводимости, условно принимая за данность, что электрический ток проводится не благодаря движению многочисленных, но редко трогающихся с места отрицательно заряженных электронов, а благодаря движению в противоположном направлении положительно заряженных пустот на внешних орбитах атомов полупроводников, которые они условились называть «дырками». Таким образом, дуализм электронно-дырочной проводимости носит чисто условный характер, поскольку с физической точки зрения ток в полупроводниках, в любом случае, обусловлен исключительно направленным движением электронов.
Полупроводники нашли широкое практическое применение в современной радиоэлектронике и компьютерных технологиях именно благодаря тому, что их проводящие свойства легко и точно контролируются посредством изменения внешних условий.
См. также:
Источник
В предыдущей части мы ввели несколько новых понятий, таких как:
Металлические свойства – способность атомов химических элементов отдавать электроны.
Неметаллические свойства – способность атомов химических элементов эти электроны принимать.
Ионная связь – химическая связь, образованная за счёт электростатических сил взаимного притяжения между катионами металлов и анионами неметаллов (в этой работе наша задача ответить на вопрос о том, что такое катионы и анионы)
Ионная связь – тип химической связи, характерный для соединений металлов (Ме) с неметаллами (неМе)
Попробуем сделать отсюда несколько выводов: почему связь между металлами и неметаллами называется ионной? Наверное, потому что непосредственное отношение к делу имеют некие частицы, которые мы будем называть ионами? Конечно.
Ионы – это заряженные частицы вещества
Посмотрите, на рисунке выше атом в ходе отдачи либо принятия электрона(ов) становится ионом. Хм. Мы знаем, что атом – электронейтральная частица. Что же это получается, что в ходе отдачи либо принятия электронов атом приобретает заряд? Верно!
Попробуем в этом разобраться. Атом электронейтрален прежде всего по той причине, что число отрицательно заряженных частиц в атоме, то есть электронов, чей заряд мы условно принимаем равным -1, равно числу положительно заряженных частиц, то есть протонов, чей заряд мы условно принимаем равным +1, и суммарный заряд атома оказывается равен нулю (об этом здесь). Если же атом отдаёт или принимает электроны, то баланс нарушается, и электроотрицательных частиц в атоме, электронов, становится либо меньше, чем протонов, либо больше, в результате чего суммарный заряд частицы вещества окажется отличным от нуля! То есть, в качестве итога мы будем иметь дело уже не с атомом, а с ионом.
Ионы бывают положительными и отрицательными
С этого момента мы будем работать по следующей простой схеме:
1) Число электронов равно числу протонов – атом.
2) Число электронов меньше, чем число протонов – положительный ион.
3) Число электронов больше, чем число протонов – отрицательный ион.
Почему так? Дело в том, что атом, отдавая электроны, оказывается в ситуации, когда число протонов в ядре начинает преобладать над числом электронов, то есть, суммарный положительный заряд атома начинает превышать суммарный отрицательный заряд атома, что означает, что атом стал положительным ионом. И наоборот.
Символичное изображение процесса отдачи и принятия электронов
Замыкаем сюжетную линию.
Если, во-первых, атомы металлов, проявляя металлические свойства, отдают электроны, а мы знаем, что атомы, отдавая электроны, становятся положительными ионами, если, во-вторых, атомы неметаллов, проявляя неметаллические свойства, принимают электроны, а мы знаем, что атомы, принимая электроны, становятся отрицательными ионами, то понятие об ионной связи, как об электростатических силах удерживающих между собой катионы металлов и анионы неметаллов, открывается для нас в новом свете:
Катионы – это и есть положительные ионы
Анионы – это и есть отрицательные ионы
Катиончик (+) , аниончик (-)
В следующей части мы научимся по таблице Менделеева отличать металлы от неметаллов, что вне всяких сомнений нужно было сделать гораздо раньше. Но, как известно, лучше поздно, чем никогда.
Спасибо. Пока.
Источник
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и фтора:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
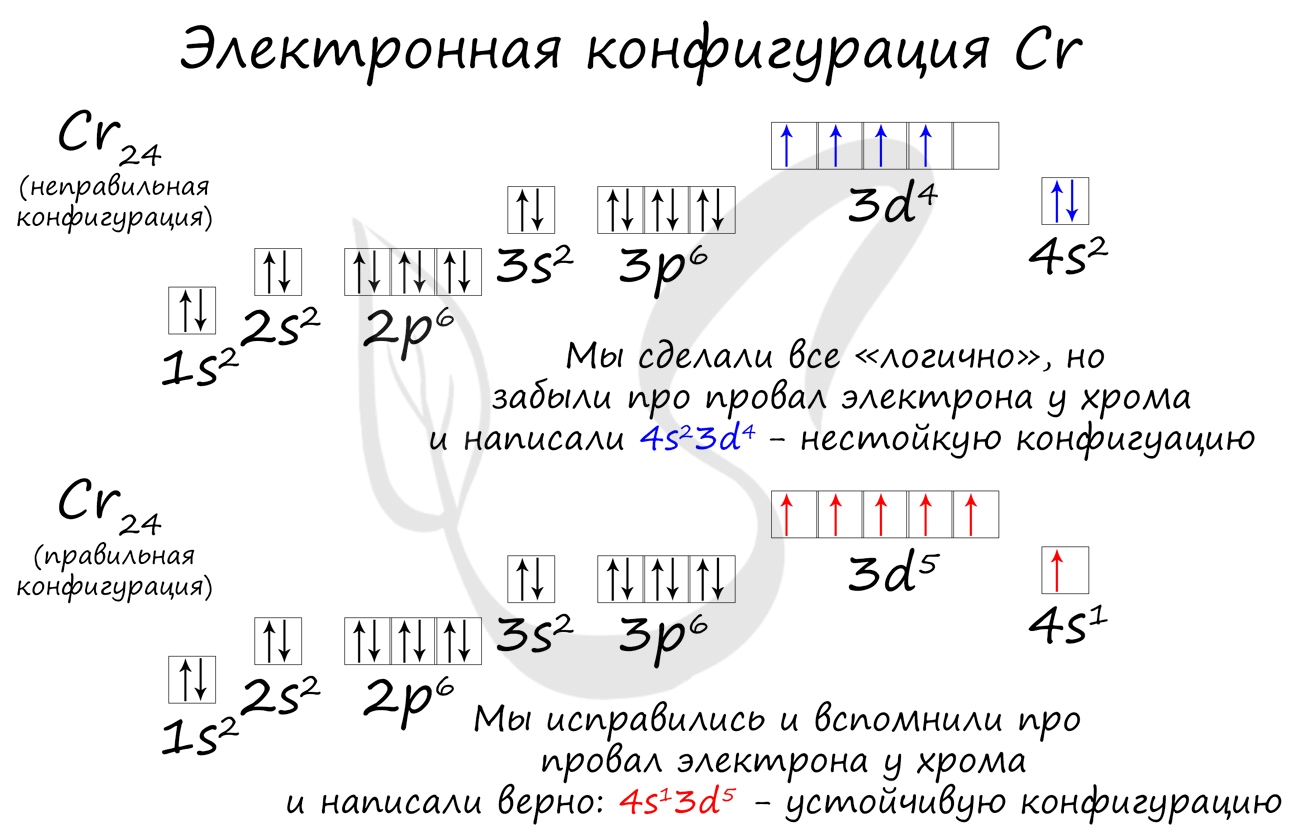
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
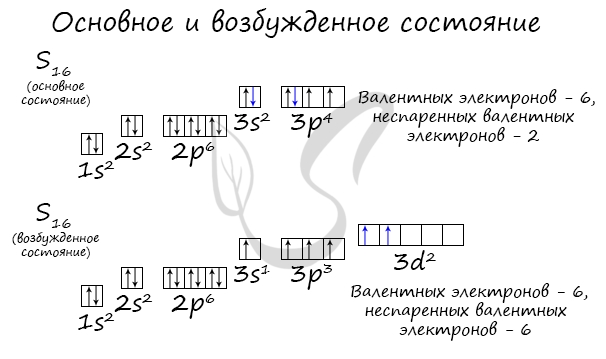
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
