Какими свойствами обладают вещества с атомными кристаллическими решетками

Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
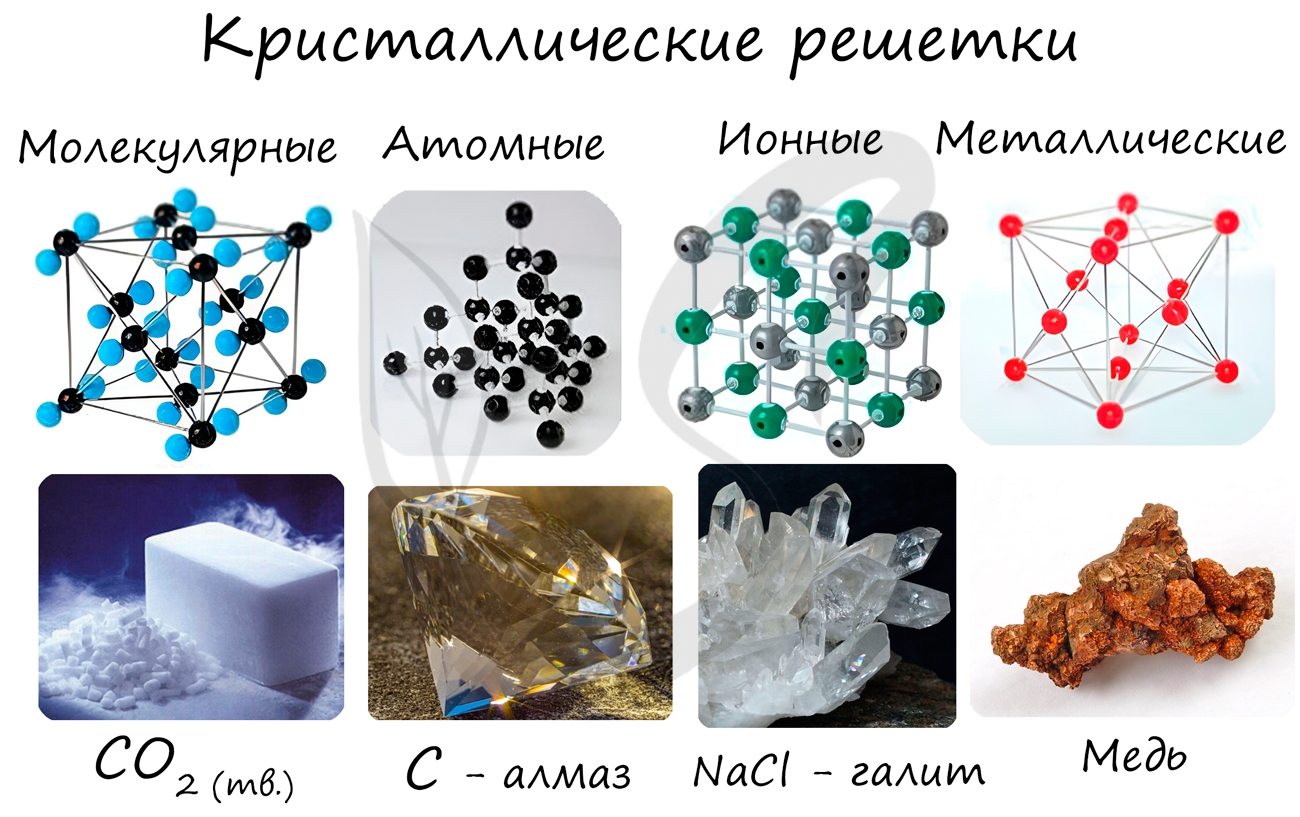
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
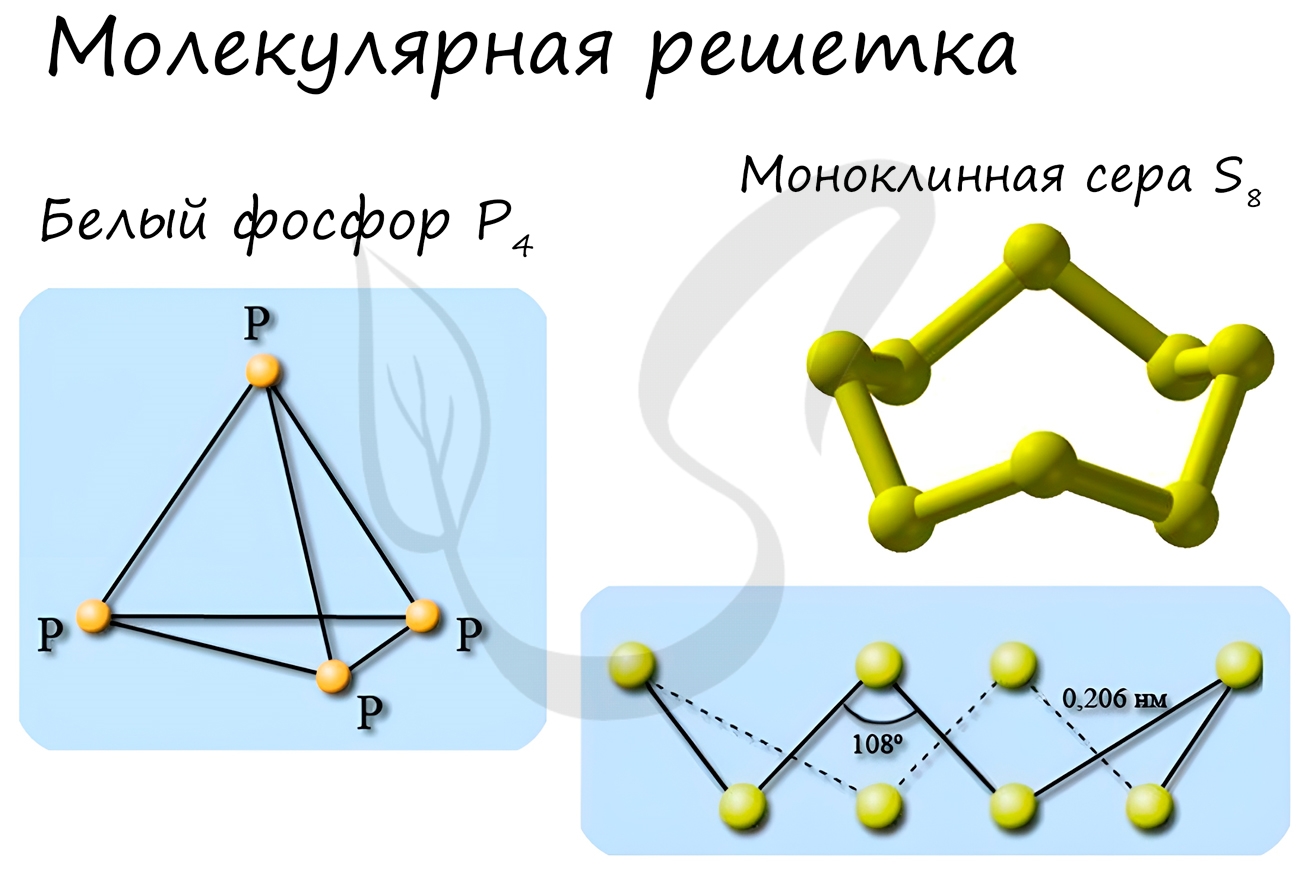
Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью – NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

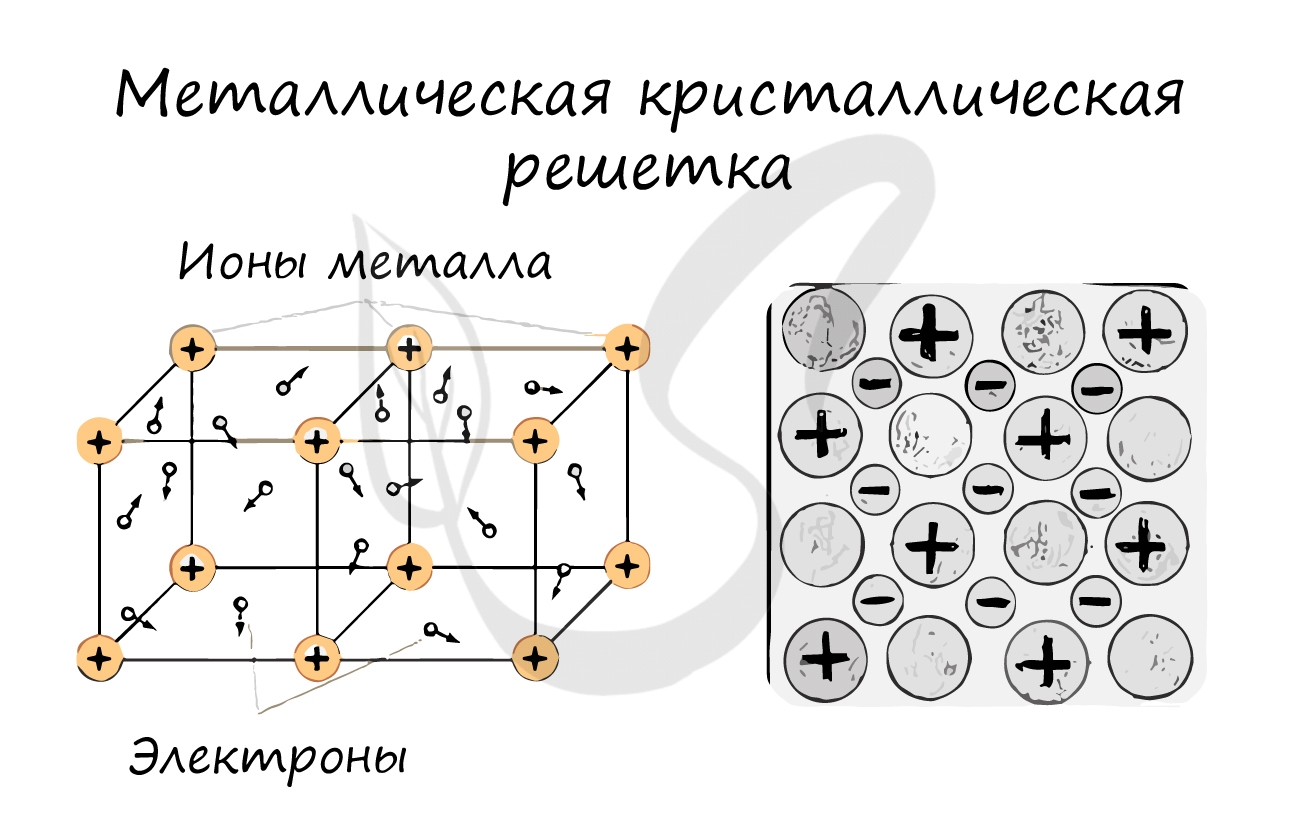
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Взаимосвязь
типа химической связи с видом кристаллической решеткиВещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще
всего имеют кристаллическое строение).Кристаллическое строение характеризуется
правильным расположением частиц в определенных точках пространства. При
соединении этих точек воображаемыми прямыми линиями образуется так называемая
кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.В узлах кристаллической решетки могут
находиться ионы, атомы или молекулы.В зависимости от вида частиц,
расположенных в узлах кристаллической решетки, и характера связи между ними
различают четыре типа кристаллических решеток:
·
ионные,·
атомные,·
молекулярные и·
металлические.Ионная решетка
Эту решетку образуют все вещества с
ионным типом связи — соли, щелочи, бинарные соединения активных металлов с
активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты,
соли аммония и аминов. В узлах решетки — ионы, между которыми существует
электростатическое притяжение. Ионная связь очень прочная.Примеры:
КОН, СаСО3, СН3СООК, NH4NO3, [CH3NH3]Cl,
С2Н5ОК.Свойства ионных кристаллов:
· твердые, но хрупкие;
· отличаются высокими температурами
плавления;· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают
электропроводностью;· многие растворимы в воде; при растворении
в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят
электрический ток.Металлическая решетка
Характерна для веществ с металлической
связью. Реализуется в простых веществах — металлах и их сплавах. В узлах
решетки — атомы и катионы металла, при этом электроны металла обобществляются и
образуют так называемый электронный газ, который движется между узлами решетки,
обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и
обусловлены свойства веществ с
металлической решеткой:·
тепло- и электропроводность;·
обладают металлическим блеском;·
высокие температуры плавления.Атомная решетка
В узлах решетки — атомы, связанные
ковалентными связями. Химическая связь — ковалентная полярная или неполярная.
Атомная кристаллическая решетка характерна для углерода (алмаз, графит),
бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц,
речной песок), карбида кремния SiC (карборунд), нитрида бора BN.Свойства веществ с атомной решеткой:
·
высокая твердость;·
высокие температуры плавления;·
нерастворимость;·
нелетучесть;·
отсутствие запаха.Молекулярная решетка
В узлах — молекулы веществ, которые
удерживаются в решетке с помощью слабых межмолекулярных сил.Молекулярное
строение имеют:o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах
которых ковалентные связи (полярные и неполярные).Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и
свойства веществ
Тип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная
Ионы
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем.
металловТвердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в
воде, расплавы проводят электрический токАтомная
Атомы
1. Ковалентная неполярная -очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния
(IV) SiO2Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Молекулярная
Молекулы
Между молекулами — слабые силы межмолекулярного притяжения, внутри
молекул — прочная ковалентная связьПри обычных условиях — газы, жидкости или летучие твердые вещества:
(О2,Н2,Cl2,N2,Br2,
H2O, CO2, HCl); сера, белый фосфор, йод; органические
веществаНепрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую
твердостьМеталлическая
Атом-ионы
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
источник информации: https://foxford.ru/wiki/himiya/vzaimosvyaz-tipa-himicheskoy-svyazi-s-vidom-kristallicheskoy-reshetki
Источник
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Химическая связь подразделяется на
Внутримолекулярные
Межмолекулярные
Характеристики химической связи
Длина связи – расстояние между ядрами атомов в молекуле; зависит от количества электронных уровней у каждого элемента.
Энергия связи – энергия, затрачиваемая на разрушение связи. Чем больше длина связи, тем меньше энергия.
Полярность молекулы определяется разностью электроотрицательностей атомов. Чем больше разность электроотрицательностей, тем больше полярность связи.
Ковалентная неполярная связь
Образуют атомы с одинаковой электроотрицательностью, чаще атомы одного и того же химического элемента (неметалла).Например:Cl2.Как образуется ковалентная неполярная связь?
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Ковалентная полярная связь
Образуют атомы неметаллов с разной электроотрицательностью. Пример:HCl.
Ионная связь
Образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности.
Пример: NaCl Как образуется ионная связь?
!!!!!Обрати внимание: существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи. Например, NaOH, KNO3.
Металлическая связь
Образуется в металлах или сплавах.
Примеры: Fe
Как образуется металлическая связь?
Атомы металлов слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. Эти электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь
Связь между атомами водорода одной молекулы и сильно электроотрицательными элементами (O, N, F) другой молекулы.
Ван-Дер-Ваальсова связь
Это силы притяжения между молекулами.
Что такое кристаллическая решетка?
Это каркас вещества, который получится, если частицы вещества соединить линиями.
Ионная кристаллическая решетка
Ионными называют решётки, в узлах которых находятся ИОНЫ.
Свойства веществ с ионными кристаллическими решетками:
1) все вещества при обычных условиях твердые
2) хрупкие
3) имеют высокие температуры кипения и плавления
4) нелетучесть
5) многие растворимы в воде
6) расплавы и растворы проводят электрический ток
Металлические кристаллические решетки
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Свойства веществ с металлическими кристаллическими решетками
1)Твердость
2)Электро- и теплопроводность
3)Металлический блеск
4)Ковкость, пластичность
Атомная кристаллическая решетка
Это кристаллические решётки, в узлах которых находятся отдельные атомы, соединенные ковалентными связями.
Свойства веществ с атомными решетками:
1) очень высокая твердость, прочность
2) очень высокая Тпл (алмаз 3500°С)
3) тугоплавкость
4) практически нерастворимы
5) нелетучесть
Примеры веществ атомного строения: углерод,алмаз, бор, оксид кремния.
Молекулярные кристаллические решетки
Это решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Примеры веществ: газы, органические вещества, вода.
Свойства веществ с молекулярными решетками:
1) малая твердость, прочность
2) низкие Тпл и Ткип
3) при комнатной температуре обычно жидкости или газы
4) высокая летучесть
5) растворы и расплавы проводят электрический ток
Источник
Строение вещества определяется не только взаимным расположением атомов в химических частицах, но и расположением этих химических частиц в пространстве. Наиболее упорядочено размещение атомов, молекул и ионов в кристаллах, где химические частицы расположены в определенном порядке, образуя в пространстве кристаллическую решетку.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллических решеток:
· Атомная
· Молекулярная
· Металлическая
· Ионная
Ионные кристаллические решетки образованы ионами – катионами и анионами. В узлах ионной решетки располагаются ИОНЫ – катионы и анионы, между которыми существует ЭЛЕКТРОСТАТИЧЕСКОЕ притяжение.
Это достаточно прочный тип решетки.

‼ Характеристики веществ с ионной кристаллической решеткой:
· высокие температуры плавления(тугоплавкость)–ионные соединения всегда твёрдые при обычных условиях;
· растворимость в воде большинства ионных соединений;
· растворы и расплавы проводят электрический ток.
У каких веществ ИОННАЯ решетка?
‼ Ионная решетка характерна для веществ с ИОННЫМ ТИПОМ связи (соли, основания, оксиды металлов, другие соединения, содержащие металл и неметалл).
Атомные кристаллические решетки состоят из отдельных атомов, соединённых прочными ковалентными связями.
 Кристалл графита
Кристалл графита
‼ Характеристики веществ с атомной кристаллической решеткой:
· атомные кристаллы очень прочные и твердые
· плохо проводят теплоту и электричество.
· плавятся при высоких температурах.
· нерастворимы в каких-либо растворителях.
· низкая реакционная способность.
У каких веществ АТОМНАЯ решетка?
‼Вещества с атомной кристаллической решеткой:
1) простые вещества – бор, кремний, углерод (алмаз и графит).
2) оксид кремния (кремнезем), карбид кремния (карборунд), а также карбид и нитрид бора.
Молекулярные кристаллические решетки состоят из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные (Ван-дер-Ваальсовы) силы. Это очень слабый вид взаимодействия.
 Молекула йода.
Молекула йода.
‼ Характеристики веществ с молекулярной кристаллической решеткой:
· вещества бывают газообразными, жидкими и твёрдыми
· низкие температуры плавления
· малая прочность решетки
· высокая летучесть веществ
· не обладают электрической проводимостью
· их растворы и расплавы также не проводят электрический ток.
У каких веществ МОЛЕКУЛЯРНАЯ решетка?
‼Вещества с молекулярной решеткой:
· простые двухатомные вещества-неметаллы
· соединения неметаллов (кроме оксидов и карбидов бора и кремния)
· все органические соединения, кроме солей.
Металлическая кристаллическая решетка характерна для простых веществ-металлов. В ней имеет место металлическая связь между атомами. В узлах решетки – катионы металлов; между ними движутся обобществлённые электроны («электронный газ»), которые удерживают катионы металла, притягивая их к себе. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
 В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной.
В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной.
‼ Характеристики веществ с металлической кристаллической решеткой:
· высокая электропроводимость и теплопроводность
· металлический блеск и непрозрачность
· ковкость и пластичность
Источник
Темы кодификатора ЕГЭ: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другиеположения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.

Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы. Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристалалах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества, образующие в твердом состоянии атомные кристаллы:
- Простые вещества с высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (корунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водродные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристалалах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества, образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы (O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптон и др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке. Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения. В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью. Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы, как при образовании ионной связи, и образуются общие электроны, как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют «электронным газом». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами: металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.

Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).



