Какими свойствами обладают сложные эфиры

В прошлой статье мы рассказывали о простых эфирах, а сейчас поговорим 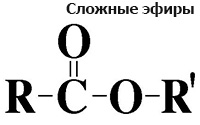 о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.
о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.
Сложные эфиры — органические соединения на основе кислородосодержащих органических карбоновых или неорганических кислот. Структуру вещества можно представить как молекулу кислоты, в которой атом Н в гидроксиле ОН— замещен углеводородным радикалом.
Получают сложные эфиры в результате реакции кислоты и спирта (реакция этерификации).
Классификация
 — Фруктовые эфиры — жидкости с фруктовым запахом, молекула содержит не более восьми атомов углерода. Получают из одноатомных спиртов и карбоновых кислот. Эфиры с цветочным запахом получают с помощью ароматических спиртов.
— Фруктовые эфиры — жидкости с фруктовым запахом, молекула содержит не более восьми атомов углерода. Получают из одноатомных спиртов и карбоновых кислот. Эфиры с цветочным запахом получают с помощью ароматических спиртов.
— Воски — твердые вещества, содержат в молекуле от 15 до 45 атомов С.
— Жиры — содержат в молекуле 9-19 атомов углерода. Получают из глицерина (трехатомного спирта) и высших карбоновых кислот. Жиры могут быть жидкими (растительные жиры, называемые маслами) и твердыми (животные жиры).
— Сложные эфиры минеральных кислот по своим физическим свойствам тоже могут быть как маслянистыми жидкостями (до 8 атомов углерода), так и твердыми веществами (от девяти атомов C).
Свойства
В нормальных условиях сложные эфиры могут быть жидкими без цвета, с фруктовым или цветочным запахом, или твердыми, пластичными; как правило, без запаха. Чем длиннее цепочка углеводородного радикала, тем тверже вещество. Почти неводорастворимы. Хорошо растворяются в органических растворителях. Горючи.
Вступают в реакции с аммиаком с образованием амидов; с водородом (именно эта реакция превращает жидкие растительные масла в твердые маргарины).
В результате реакции гидролиза разлагаются на спирт и кислоту. Гидролиз жиров в щелочной среде приводит к образованию не кислоты, а ее соли — мыла.
Сложные эфиры органических кислот малотоксичны, оказывают на человека наркотическое воздействие, в основном относятся ко 2-му и 3-му классу опасности. Некоторые реактивы на производстве требуют использования специальных средств защиты для глаз и дыхания. Чем больше длина молекулы эфира, теми он токсичнее. Эфиры неорганических фосфорных кислот ядовиты.
В организм вещества могут попадать через органы дыхания и кожу. Симптомами острого отравления служат возбуждение и нарушенная координация движений с последующим угнетением ЦНС. Регулярное воздействие может привести к болезням печени, почек, сердечно-сосудистой системы, нарушениям формулы крови.
Применение
— В органическом синтезе.
— Для производства инсектицидов, гербицидов, смазок, пропиток для кожи и бумаги, моющих средств, глицерина, нитроглицерина, олиф, масляных красок, синтетических волокон и смол, полимеров, оргстекла, пластификаторов, реагентов для обогащения руд.
— Как добавка к моторным маслам.
— В синтезе парфюмерных отдушек, пищевых фруктовых эссенций и косметических ароматизаторов; лекарственных средств, например, витаминов А, Е, В1, валидола, мазей.
— Как растворители красок, лаков, смол, жиров, масел, целлюлозы, полимеров.
В ассортименте магазина «ПраймКемикалсГрупп» вы можете купить востребованные сложные эфиры, в том числе бутилацетат и Твин-80.
Бутилацетат
Применяется как растворитель; в парфюмерной промышленности для изготовления отдушек; для дубления кож; в фармацевтике — в процессе изготовления некоторых лекарств.
Твин-80
Он же полисорбат-80, полиоксиэтилен сорбитан моноолеат (основан на сорбите оливкового масла). Эмульгатор, растворитель, техническая смазка, модификатор вязкости, стабилизатор эфирных масел, неионогенный ПАВ, увлажнитель. Входит в состав растворителей и смазочно-охлаждающих жидкостей. Используется для производства продукции косметического, пищевого, бытового, сельскохозяйственного, технического назначения. Обладает уникальным свойством превращать смесь воды и масла в эмульсию.
Источник
Сегодня, мы продолжим знакомство с различными классами органических соединений и поговорим о широко распространенных в природе сложных эфирах. Эта статья будет особенно полезна тем, кто подготавливается к сдаче ЕГЭ, изучает углубленно курс органической химии и просто тем, кому интересно вспомнить школьную программу по данной теме. Итак, приступим!
Что же такое сложные эфиры?
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами.
Таким образом, общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
Или:
Формулы отдельных простейших представителей класса сложных эфиров таковы:
Сложные эфиры широко распространены в природе. Специфический аромат ягод, плодов и фруктов в значительной степени обусловлен представителями этого класса органических соединений.
Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — так же, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое. Однако, вопрос применения и классификации сложных эфиров, мы затронем более обширно, чуть позже. А сейчас перейдем к не менее важному вопросу.
Изомерия сложных эфиров.
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например, метилбутирату изомерны метилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки –СО–О–. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат, этилпропионат и метилбутират.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота, а метилформиату уксусная кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис- , транс-изомерия.
Теперь поговорим подробнее о разновидностях сложных эфиров.
Необходимо знать следующее.
Сложные эфиры жирных кислот и спиртов с длинными углеводородными радикалами, называют восками.
Напоминаю, жирные кислоты — это алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из чётного числа атомов углерода (от 4 до 24, включая карбоксильный) и могут быть как насыщенными, так и ненасыщенными.
Важнейшими представителями природных сложных эфиров являются жиры.
Жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отображены общей формулой:
Где R – это радикалы входящие в состав высших карбоновых кислот:
– С3Н7 – масляной.
– С15H31 – пальмитиновой.
– С17Н35 – стеариновой
– С17Н33 – олеиновой.
– С17Н31 – линолевой.
Причем первые три радикала – это остатки предельных карбоновых кислот, а два последних – это остатки непредельных кислот.
В свою очередь, жиры классифицируют на твердые жиры и жидкие жиры (масла).
Физические свойства сложных эфиров.
Многие сложные эфиры, обладают приятными запахами цветов и фруктов. Они хорошо растворимы в спиртах, а вот в воде растворяются очень мало. Дело в том, что плотность сложных эфиров меньше чем у воды и поэтому они по большей части плавают на ее поверхности.
Сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения.
Способы получения сложных эфиров.
1. Реакция этерификации.
Реакция этерификации, является важнейшим из способов получения сложных эфиров.
Этерификация (от греч. eter — эфир и лат. facio — делаю) — это реакция образования сложных эфиров при взаимодействии кислот и спиртов.
В общем виде реакция этерификации может быть записана так:
Обратите внимание на то, что реакция этерификации обратима. Продукты этой реакции могут вернутся в состояние исходных веществ – спирта и кислоты. Таким образом, над стрелочкой, указывающей в сторону продуктов, мы можем написать – этерификация, а над стрелкой указывающей в сторону исходных веществ, можно написать – гидролиз сложного эфира.
О гидролизе сложных эфиров, мы поговорим чуть позже.
2. Получение сложных эфиров из хлорангидрирдов карбоновых кислот.
Хлорангидриды карбоновых кислот — это производные карбоновых кислот, в которых гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора.
Общая формула хлорангидридов карбоновых кислот такова:
Например, из хлорангидрида уксусной кислоты мы можем получить фенилацетат, путем следующей химической реакции:
Вместо фенола, в данной реакции можно использовать так же и его соли, например фенолят натрия:
Таким же образом эта реакция возможна и для предельных одноатомных и многоатомных спиртов, и их солей:
3. Получение сложного эфира, путем взаимодействия соли карбоновой кислоты и галогеналкана.
Химические свойства сложных эфиров:
1. Галогенирование.
Эта реакция характерна для сложных эфиров, содержащих непредельный углеводородный радикал. Реакция с бромной водой при этом, имеет особое значение, так как она качественная. Происходит обесцвечивание бромной воды.
2. Гидрирование.
Данная реакция так же характерна для сложных эфиров содержащих непредельный углеводородный радикал:
Эта реакция имеет большое практическое значение, так как именно она лежит в основе получения твердого жира – маргарина из жидкого растительного масла.
3. Гидролиз.
В зависимости от условий гидролиз бывает:
– Водный (без катализатора, при высоких температуре и давлении).
– Кислотный (в присутствии кислоты в качестве катализатора).
– Ферментативный (происходит в живых организмах).
Такой гидролиз является обратимым. Для смещения равновесия в сторону продуктов его проводят в присутствие щелочей (или например Na2CO3). При этом гидролиз протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Именно поэтому гидролиз жиров в щелочной среде, называют – омыливанием жиров.
Мыло, которое мы используем, представляет собой смесь солей, поскольку жир, из которого его получают, содержит остатки различных кислот. Натриевые соли высших кислот RCOONa имеют твердое агрегатное состояние, а калиевые RCOOK — жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты.
Все мыла диссоциируют как сильные электролиты по уравнению:
RCOONa —> RCOO(-) + Na(+)
Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO-Na+) и неполярный углеводородный радикал, содержащий 12—18 атомов углерода. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна) . В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко изменяется. Неполярные концы молекулы мыла погружаются в капли масла, а полярные карбоксилат-анионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОО-. Наличие этой оболочки препятствует слиянию частиц, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира, содержащего грязь, обусловливает очищающее действие мыла.
В жесткой воде, содержащей ионы Са2+ и Mg2+, мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде:
4. Взаимодействие с аммиаком.
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Реакция горения.
Горение сложных эфиров происходит с образованием углекислого газа и воды:
2CH3COOCH3 + 7O2 = 6CO2 + 6H20
Применение сложных эфиров.
Сложные эфиры используются в парфюмерии, косметике, в качестве пищевых добавок, для изготовления искусственных волокон, краски, лаков, клея. Они служат исходными веществами в производстве многих фармацевтических препаратов
Благодаря тому, что они смешиваются со многими органическими веществами, они используются как растворители для лаков и красок.
Этилформиат и этилацетат используются как растворители целлюлозных лаков.
Винилацетат используется для производства поливинилацетатных смол, клеев и красок.
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности(изготовление мыла, духов, кремов) .
Сложные эфиры применяются для производства пластмасс, резины в качестве пластификаторов.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Отдельно стоит упомянуть, про биологическую роль жиров.
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
– строительная (входят в состав клеточных мембран).
– энергетическая (1 г жира при окислении дает 9 ккал энергии).
– защитная (теплорегуляционная, механическая защита органов).
– запасная (запас энергии и воды).
– регулирующая (обмен веществ в организме).
Вот собственно и все, что нужно знать о сложных эфирах.
Так же рекомендую к прочтению:
Альдегиды и Кетоны.
Карбоновые кислоты.
То, что нужно знать о Спиртах.
Фенолы.
Удачи вам, в изучение химии и на сдачи экзаменов! До новых встреч!
Источник
Ñëîæíûå ýôèðû – ñîåäèíåíèÿ, ó êîòîðûõ àòîì âîäîðîäà çàìåùåí óãëåâîäîðîäíûì ðàäèêàëîì. Îáùàÿ ôîðìóëà:

Èçîìåðèÿ ñëîæíûõ ýôèðîâ.
Äëÿ ñëîæíûõ ýôèðîâ õàðàêòåðíû ñëåäóþùèå âèäû èçîìåðèè: èçîìåðèÿ óãëåðîäíîé öåïè, èçîìåðèÿ ïîëîæåíèÿ ñëîæíîýôèðíîé ãðóïïèðîâêè –ÑÎ-Î-, ìåæêëàññîâàÿ èçîìåðèÿ:



Ôèçè÷åñêèå ñâîéñòâà ñëîæíûõ ýôèðîâ.
Ñëîæíûå ýôèðû ïðåäñòàâëÿþò ñîáîé ëåòó÷èå, ìàëîðàñòâîðèìûå è ïðàêòè÷åñêè íåðàñòâîðèìûå â âîäå æèäêîñòè. Ìíîãèå èìåþò ïðèÿòíûé çàïàõ.
Ñëîæíûå ýôèðû èìåþò áîëåå íèçêóþ òåìïåðàòóðó êèïåíèÿ, ÷åì ñîîòâåòñòâóþùèå êèñëîòû. Ñëîæíûå ýôèðû âûñøèõ æèðíûõ êèñëîò è ñïèðòîâ – âîñêîîáðàçíûå âåùåñòâà, íå èìåþò çàïàõà è íåðàñòâîðèìû â âîäå, íî õîðîøî ðàñòâîðèìû â îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ.
Õèìè÷åñêèå ñâîéñòâà ñëîæíûõ ýôèðîâ.
1. Ðåàêöèÿ ãèäðîëèçà (îìûëåíèÿ).
2. Ýòåðèôèêàöèÿ:

Ãèäðîëèç óñêîðÿåòñÿ ïîä äåéñòâèåì ùåëî÷åé, è ãèäðîëèç íåîáðàòèì:


3. Ðåàêöèÿ âîññòàíîâëåíèÿ:

4. Ðåàêöèÿ îáðàçîâàíèÿ àìèäîâ.

Ðåàêöèÿ ýòåðèôèêàöèÿ ñëîæíûõ ýôèðîâ.
Ýòåðèôèêàöèÿ – îáðàòèìûé ïðîöåññ. Ïðÿìàÿ ðåàêöèÿ – ýòî îáðàçîâàíèå ñëîæíîãî ýôèðà, îáðàòíàÿ – êèñëîòíûé ãèäðîëèç.  ðåçóëüòàòå ïðîèñõîäèò àêòèâàöèÿ ìîëåêóëû êàðáîíîâîé êèñëîòû. Áåíçîéíàÿ êèñëîòà ïðîòîíèðóåòñÿ ïî àòîìó êèñëîðîäà êàðáîíèëüíîé ãðóïïû. Ïðîòîíèðîâàíèå ïðèâîäèò ê ïðåâðàùåíèþ ÷àñòè÷íîãî ïîëîæèòåëüíîãî çàðÿäà íà àòîìå óãëåðîäà êàðáîêñèëüíîé ãðóïïû.

Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Ñîåäèíåíèÿ õèìè÷åñêèõ ýëåìåíòîâ | |
| Àëêàíû, âîäà, ãàëîãåíû, ìûëà, æèðû, ãèäðîêñèäû; îêñèäû, õëîðèäû, ïðîèçâîäíûå õèìè÷åñêèõ ýëåìåíòîâ òàáëèöû Ìåíäåëååâà | |
| Ñîåäèíåíèÿ õèìè÷åñêèõ ýëåìåíòîâ | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Êàðáîíèëüíûå ñîåäèíåíèÿ. | |
| Îðãàíè÷åñêèå ñîåäèíåíèÿ, â ñîñòàâ êîòîðûõ âõîäèò Ñ=Î ãðóïïà, íàçûâàþò êàðáîíèëüíûìè ñîåäèíåíèÿìè . | |
| Êàðáîíèëüíûå ñîåäèíåíèÿ. | |
Êàðáîíîâûå êèñëîòû. | |
| Êàðáîíîâûìè êèñëîòàìè íàçûâàþò ñîåäèíåíèÿ, â êîòîðûõ ñîäåðæèòñÿ êàðáîêñèëüíàÿ ãðóïïà: . | |
| Êàðáîíîâûå êèñëîòû. | |
Источник
