Какими свойствами обладают силы молекулярного взаимодействия
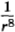
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Межмолекулярное взаимодействие имеет электростатическую природу. Предположение о его существовании было впервые использовано Я. Д. Ван-дер-Ваальсом в 1873 году для объяснения свойств реальных газов и жидкостей. В наиболее широком смысле под ним можно понимать такие взаимодействия между любыми частицами (молекулами, атомами, ионами), при которых не происходит образования химических, то есть ионных, ковалентных или металлических связей. Иными словами, эти взаимодействия существенно слабее ковалентных и не приводят к существенной перестройке электронного строения взаимодействующих частиц.
На больших расстояниях преобладают силы притяжения, которые могут иметь ориентационную, поляризационную (индукционную) и дисперсионную природу (см. подробнее в статьях Силы Ван-дер-Ваальса и Дисперсионные силы). При усреднении по вращению частиц, происходящему вследствие теплового движения, потенциал межмолекулярных сил обратно пропорционален шестой степени расстояния, а ион-дипольных (как с постоянным, так и с наведенным диполем) — четвёртой степени. На малых расстояниях начинают преобладать силы отталкивания электронных оболочек частиц. Особым случаем является водородная связь — возникающее на малом расстоянии взаимодействие между атомом водорода одной молекулы и электроотрицательным атомом другой, когда эти атомы несут достаточно большой эффективный заряд.
Упаковку частиц и расстояние между ними в конденсированной фазе, определяющиеся равновесием между притяжением и отталкиванием, можно предсказать, исходя из ван-дер-ваальсовых радиусов составляющих молекулы атомов (ионных в случае ионов): расстояния между атомами разных молекул не должны превышать суммы радиусов этих атомов. Для моделирования межмолекулярных взаимодействий используют эмпирические потенциалы, среди которых наиболее известны потенциалы Леннард-Джонса (отталкивание описывается двенадцатой степенью обратного расстояния, притяжение — шестой) и Бакингема (с более физически обоснованным экспоненциальным отталкиванием), из которых первый более удобен для расчетов. В конденсированной фазе, где мультипольное разложение для молекул плохо применимо из-за близости молекул друг к другу, может применяться метод атом-атомных потенциалов, основанный на тех же потенциалах, но уже для парных взаимодействий атомов и с добавкой кулоновских членов, описывающих взаимодействие их эффективных зарядов.
Межмолекулярное взаимодействие, водородная связь[править | править код]
Дипольная молекула создает вокруг себя электростатическое поле и ориентирует остальные диполи системы, что приводит к снижению энергии. Рассчитанная П.Кизомом средняя энергия ориентационного диполь-дипольного взаимодействия между полярными молекулами составляет:
(формула 1) где – дипольный момент молекулы; r – расстояние между центрами молекул; k – константа Больцмана; T – температура по Кельвину.
Множитель (kT) в знаменателе отражает влияние флуктуации на ориентацию диполей вследствие теплового движения, которое возрастает с увеличением температуры. Кроме ориентационного, следует учитывать индукционный эффект (), то есть взаимодействие диполя с приведенным диполем, который, соответственно с П.Дебаем, равен:
(формула 2)
Ориентационные и индукционные силы возникают между полярными молекулами и не могут объяснить межмолекулярное взаимодействие между неполярными. Учитывание так сказать слабой квадруполь-квадруполь взаимодействия не решает проблему, тем более, что молекула типа и атомы инертных газов не имеют вообще квадрупольного момента (отметим, что квадрупольный момент (без дипольного) имеют молекулы типа квадруполями можно считать двухатомные гомоядерные молекулы – и т.д.).
Природа межмолекулярных сил в неполярных системах была определена Ф.Лондоном с помощью квантовой механики. Можно сказать лишь, что учитывание корреляции во время движения атомных электронов приводит к снижению энергии. Если движение электронов в разных атомах скоррелировано, то это также способствует снижению энергии. Атомы с подвижными электронами можно считать диполями, которые осциллируют с некоторой частотой . При синхронном движении электронов мгновенные диполи ориентируются всегда так, что это приводит к снижению энергии:
(формула 3)
Заменив на , где – энергия ионизации молекулы (атома), получим:
(формула 4) Эту формулу можно получить более последовательно (не применяя модель осциллирующих диполей) на основе теории возмущений.
Дж.Слетер и Дж.Кирквуд для взаимодействия многоэлектронных атомов вывели следующую формулу:
(формула 5) где N – количество электронов на внешней оболочке; m – масса электрона; е – его заряд.
Формулы (3) и (5) совпадают при N=1, если вместо подставить его выражение: Из приведенных формул можно сделать вывод о том, что основная характеристика, которая определяет величину сил Лондона, – это поляризованность () атомов (молекул). В связи с тем, что поляризованность тесно связана с коэффициентом преломления света и характеризует способность вещества к рассеиванию энергии (дисперсии) света, силы Лондона часто называют дисперсионными ().
Поляризованность зависит от размера частички, поэтому прочность молекулярных решеток должна возрастать с увеличением размеров атомов и молекул, которые взаимодействуют. Эта закономерность хорошо иллюстрируется увеличением температур кипения (аналогические зависимости наблюдаются для теплот и температур плавления, сублимации, испарения и т.д., то есть для величин, которые зависят от прочности молекулярных связей) в группе инертных газов в гомологическом ряду парафинов.
Атом Гелия настолько мал и дисперсионные силы при взаимодействии атомов Гелия такие слабые, что Гелий не может существовать в кристаллическом состоянии даже при обычном давлении и 0К. Причина этого – существование нулевой кинетической энергии, которая для гелия больше, чем энергия связи. Наличие кинетической энергии ядер в связанных атомах (при 0К) является следствием соотношения неопределенностей Гейзенберга.
Энергия связи для гелия кДж/моль, где m – масса атома Гелия.
Поэтому, и кристаллическое состояние не может реализоваться даже при 0К. Лишь при большом внешнем давлении гелий может перейти в кристаллическое состояние.
Все межмолекулярные взаимодействия (их часто объединяют общим названием – взаимодействие Ван дер Вальса) можно выразить в таком виде:
Ориентационное, индукционное и дисперсионное взаимодействия делают разный вклад в энергию связи. Для атомов и неполярных молекул и равны нулю и остается только дисперсионное взаимодействие. Вклад ориентационных и индукционных сил увеличивается с ростом дипольного момента молекул. В молекуле (1D-дебай= Кл * м) вносит 0,005%, а – 14,4%, – 4,2%; В – 3,3%, – 2,2%; – 14,4%, – 4,2%.
Благодаря приведенным формулам можно сделать вывод, что даже для очень полярных молекул дисперсионное взаимодействие делает огромный вклад.
См. также[править | править код]
- Силы Ван-дер-Ваальса
- Межатомное взаимодействие
Литература[править | править код]
- [www.xumuk.ru/encyklopedia/2477.html Межмолекулярные взаимодействия] // Химическая энциклопедия. Т. 3. — М.: Большая Российская энциклопедия, 1992. С. 12-15.
- Маррел Дж., Кеттл С., Теддер Дж. Химическая связь / Пер. с англ. С. В. Христенко. Под ред. И. В. Александрова. — М.: Мир, 1980.— 382 с.
- Бараш Ю. С. «Силы Ван-дер-Ваальса» М.: Наука, 1988. 344с.
- Каплан И. Г. «Введение в теорию межмолекулярных взаимодействий» М.: Наука, 1982. 312с.
- Каплан И. Г. Межмолекулярные взаимодействия. Физическая интерпретация, компьютерные расчеты и модельные потенциал М.: БИНОМ. Лаборатория знаний, 2012. — 400 с. ISBN 978-5-94774-939-7
- «Межмолекулярные взаимодействия; от двухатомных молекул до биополимеров» Пюльман Б. (ред) Пер. с англ., М.: Мир, 1981. — 592с.
- Израелашвили Дж. Межмолекулярные и поверхностные силы. М.: Научный мир, 2011. — 456 с. ISBN 978-5-91522-222-8
Ссылки[править | править код]
- Межмолекулярное взаимодействие в ФЭ
- [www.xumuk.ru/bse/1603.html Межмолекулярное взаимодействие] в БСЭ
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Источник
Ìîëåêóëÿðíîå âçàèìîäåéñòâèå òàêæå êàê ñèëüíîå è ñëàáîå ÿâëÿåòñÿ ãðàâèòàöèîííûì áëèçêîäåéñòâèåì.  ìîëåêóëÿðíîì âçàèìîäåéñòâèè ó÷àñòâóþò àòîìû è ìîëåêóëû. Ìîëåêóëÿðíîå âçàèìîäåéñòâèå îáúÿñíÿåò ñóùåñòâîâàíèå àãðåãàòíûõ ñîñòîÿíèé âåùåñòâ è çàâèñèìîñòü èõ ñâîéñòâ îò âíåøíèõ óñëîâèé. Ðàçíîîáðàçèå ñîñòîÿíèé âåùåñòâà îáúÿñíÿåòñÿ: ðàçìåðàìè ìîëåêóë (àòîìîâ), ôîðìîé óïàêîâêè, åñëè ýòî òâ¸ðäîå âåùåñòâî, è óñëîâèÿìè, â êîòîðûõ íàõîäèòñÿ âåùåñòâî (äàâëåíèå, òåìïåðàòóðà è äð.). Åñëè ñëàáîå è ñèëüíîå âçàèìîäåéñòâèÿ îñóùåñòâëÿþòñÿ ëèøü òîãäà, êîãäà âçàèìîäåéñòâóþùèå ÷àñòèöû ñáëèçÿòñÿ íà ðàññòîÿíèå 10 â ìèíóñ 18 ñòåïåíè ì è 10 â ìèíóñ 15 ñòåïåíè ì, ñîîòâåòñòâåííî, òî òâ¸ðäîå è æèäêîå ñîñòîÿíèÿ âåùåñòâà íà÷èíàþòñÿ ïðè âçàèìîäåéñòâèè ìîëåêóë (àòîìîâ) ñ 10 â ìèíóñ 10 ñòåïåíè ì.
Êàê ýòî ïðîèñõîäèò? Ìîëåêóëû ñáëèæàþòñÿ íà êðèòè÷åñêîå ðàññòîÿíèå. Íî òàê êàê ïî÷òè âñÿ ìàññà ìîëåêóë ñîñðåäîòî÷åíà â ÿäðàõ, à âåñü îñòàëüíîé îáú¸ì ìîëåêóë ïóñòîé, òî âçàèìîäåéñòâóþò ìåæäó ñîáîé íà ñàìîì äåëå ÿäðà ìîëåêóë. Ýôèðíûå ÷àñòèöû áóäóò ïåðåäàâàòü èíåðöèþ (äàâèòü) íà ÿäðà ìîëåêóë ñ âíåøíèõ ñòîðîí. Êîãäà äàâëåíèå íåéòðèíèêîâ ñ âíåøíèõ ñòîðîí ÿäåð ìîëåêóë çíà÷èòåëüíî ïðåâûñèò äàâëåíèå ñ âíóòðåííèõ ñòîðîí, ïðîèñõîäèò ñõëîïûâàíèå. ßäðà ìîëåêóë ñáëèæàþòñÿ, íàñêîëüêî ïîçâîëÿþò ðàçìåðû ìîëåêóë. Ýôèð íà÷èíàåò íåïðåðûâíî óäåðæèâàòü ÿäðà ìîëåêóë ìåæäó ñîáîé è, ñîîòâåòñòâåííî, ìîëåêóëû òîæå. Òàê ïðîèñõîäèò ìîëåêóëÿðíîå âçàèìîäåéñòâèå è îáðàçîâàíèå æèäêîãî èëè òâ¸ðäîãî ñîñòîÿíèé âåùåñòâà.
Ñáëèçèòüñÿ íà êðèòè÷åñêîå ðàññòîÿíèå ÿäðà ìîëåêóë ìîãóò òîëüêî ïðè îõëàæäåíèè, êîãäà âíåøíèìè ýëåêòðîíàìè áóäóò èçëó÷åíû òåïëîâûå ôîòîíû. Ïðè ýòîì âíåøíèå ýëåêòðîíû ïåðåñêî÷àò íà áîëåå áëèçêèå ê ÿäðàì îðáèòû, óìåíüøèâ òåì ñàìûì ðàçìåðû ìîëåêóë è, ñîîòâåòñòâåííî, ðàññòîÿíèÿ ìåæäó ÿäðàìè ìîëåêóë.  ðåçóëüòàòå ýòîãî ìîëåêóëÿðíîå âçàèìîäåéñòâèå (ñâÿçü ìåæäó ìîëåêóëàìè) óñèëèòñÿ. È, íàîáîðîò, ïðè íàãðåâàíèè ìîëåêóëÿðíîå âçàèìîäåéñòâèå îñëàáíåò.
Êîíå÷íî, ìîëåêóëÿðíûå ñèëû âçàèìîäåéñòâèÿ çíà÷èòåëüíî ìåíüøå, ÷åì ñèëüíîå âçàèìîäåéñòâèå. Íàðóøèòü èõ äåéñòâèå ìîæíî, íàïðèìåð, íàãðåâàíèåì, âîçâðàòèâ ìîëåêóëàì èõ ðàçìåðû è ýíåðãèþ ñâÿçè â âèäå òåïëîâûõ èíôðàêðàñíûõ ôîòîíîâ.
Ðàçìåð àòîìà èëè ìîëåêóëû îïðåäåëÿåòñÿ äèàìåòðîì îðáèòû âíåøíåãî ýëåêòðîíà è çàâèñèò îò òåìïåðàòóðû. Ñäåëàåì îãîâîðêó, ÷òî ïðè îáúÿñíåíèè ñîñòîÿíèé âåùåñòâà ðå÷ü èä¸ò î ñðåäíèõ âåðîÿòíîñòíûõ çíà÷åíèÿõ õàðàêòåðèñòèê ÷àñòèö, ñâÿçàííûõ ñ òåìïåðàòóðîé.
Òåïëîâàÿ ýíåðãèÿ ïåðåíîñèòñÿ ôîòîíàìè èíôðàêðàñíîãî äèàïàçîíà. Ïðè íàãðåâàíèè âåùåñòâà âíåøíèå ýëåêòðîíû ïîãëîùàþò ôîòîíû èíôðàêðàñíîãî äèàïàçîíà è ïåðåñêàêèâàþò íà áîëåå ñêîðîñòíóþ è áîëåå äàëüíþþ îðáèòó îò ÿäðà, óâåëè÷èâàÿ òåì ñàìûì ðàçìåð àòîìîâ (ìîëåêóë) äàííîãî âåùåñòâà. Ïðè îñòûâàíèè âåùåñòâà âíåøíèå ýëåêòðîíû ìîëåêóë èçëó÷àþò ôîòîíû èíôðàêðàñíîãî äèàïàçîíà è ïåðåñêàêèâàþò, ñîîòâåòñòâåííî, íà âíóòðåííþþ îðáèòó, óìåíüøàÿ ðàçìåð àòîìîâ (ìîëåêóë) äàííîãî âåùåñòâà. Ïðè äàëüíåéøåì íàãðåâàíèè âåùåñòâà ðàçìåðû àòîìîâ (ìîëåêóë) óâåëè÷èâàþòñÿ íàñòîëüêî, ÷òî ìîëåêóëÿðíîå âçàèìîäåéñòâèå îñëàáåâàåò è òâ¸ðäîå âåùåñòâî ïåðåõîäèò â æèäêîå ñîñòîÿíèå, à æèäêîå â ãàçîîáðàçíîå.
Òàêèì îáðàçîì, â ðåçóëüòàòå íàãðåâàíèÿ âåùåñòâ:
óâåëè÷èâàþòñÿ ðàçìåðû àòîìîâ (ìîëåêóë);
óìåíüøàþòñÿ ñèëû âçàèìîäåéñòâèÿ ìåæäó ÿäðàìè ìîëåêóë âåùåñòâà;
èçìåíÿþòñÿ ôèçè÷åñêèå ñâîéñòâà âåùåñòâà: âÿçêîñòü, óïðóãîñòü, ïðî÷íîñòü êðèñòàëëè÷åñêèõ âåùåñòâ è äðóãèå ñâîéñòâà.
Ïðè÷èíîé èçìåíåíèÿ àãðåãàòíîãî ñîñòîÿíèÿ âåùåñòâ ÿâëÿþòñÿ òåïëîâûå ôîòîíû, êîòîðûå â äàííîì ñëó÷àå âûïîëíÿþò ðîëü ýíåðãèè ñâÿçè. Ñìûñë ýíåðãèè ñâÿçè â òîì, ÷òî ÷åì áîëüøå èçëó÷åíî òåïëîâûõ ôîòîíîâ, òåì êîìïàêòíåå (áëèæå äðóã ê äðóãó) ðàñïîëîæåíû ÿäðà àòîìîâ è ìîëåêóë. È, êàê ñëåäñòâèå, óñèëåíèå ìîëåêóëÿðíîãî (ãðàâèòàöèîííîãî) âçàèìîäåéñòâèÿ. Òî åñòü âñå ýôôåêòû, ñâÿçàííûå ñ èçìåíåíèåì òåìïåðàòóðû ãàçà, ñâÿçàíû ñ èçìåíåíèåì ðàçìåðîâ ìîëåêóë.
Äëÿ ïîíèìàíèÿ òîãî, êàê ïðîÿâëÿåòñÿ ìîëåêóëÿðíîå âçàèìîäåéñòâèå â ïðèðîäå, ðàññìîòðèì îäèí ïðèìåð. Êîíäåíñàöèÿ âîäÿíîãî ïàðà â àòìîñôåðå. Ïî÷òè âñÿ ìàññà ìîëåêóë ñîñðåäîòî÷åíà â èõ ÿäðàõ. Ýôèðíûå ÷àñòèöû áóäóò ïåðåäàâàòü èíåðöèþ ìàññå ÿäåð âçàèìîäåéñòâóþùèõ ìîëåêóë ñ âíåøíèõ ñòîðîí. À îñòàëüíîé âíóòðåííèé îáú¸ì ìîëåêóëû, î÷åð÷èâàåìûé âíåøíèì ýëåêòðîíîì, áóäåò ïóñòûì. Ïîýòîìó ýôôåêò ïðèòàëêèâàíèÿ (ïðèòÿæåíèÿ) ìîëåêóë äðóã ê äðóãó áóäåò çàâèñåòü îò ðàññòîÿíèÿ ìåæäó ÿäðàìè, òî åñòü îò ðàçìåðîâ ìîëåêóë.  íàãðåòîì ñîñòîÿíèè ìîëåêóëû âîäÿíîãî ïàðà âåäóò ñåáÿ òàêæå êàê è îñòàëüíûå ìîëåêóëû àòìîñôåðû. Ïðè ñòîëêíîâåíèÿõ ìåæäó ñîáîé îíè îòòàëêèâàþòñÿ äðóã îò äðóãà êàê óïðóãèå øàðèêè. Ýòî îáúÿñíÿåòñÿ òåì, ÷òî îáú¸ìû ìîëåêóë ïðè âûñîêèõ òåìïåðàòóðàõ áîëüøèå è ïðè ñòîëêíîâåíèÿõ ðàññòîÿíèÿ ìåæäó ÿäðàìè ìîëåêóë íåäîñòàòî÷íî áëèçêè äëÿ ìîëåêóëÿðíîãî âçàèìîäåéñòâèÿ (ðèñ. 16). Òàêèå ìîëåêóëû áóäóò ðàçëåòàòüñÿ. Ïî-äðóãîìó áóäóò ñåáÿ âåñòè îõëàæä¸ííûå ìîëåêóëû âîäÿíîãî ïàðà. Ðàçìåðû ýòèõ ìîëåêóë áóäóò ìåíüøå, à ðàññòîÿíèÿ ìåæäó ÿäðàìè ïðè ñòîëêíîâåíèÿõ áóäóò äîñòàòî÷íûìè äëÿ ãðàâèòàöèîííîãî âçàèìîäåéñòâèÿ (ðèñ. 17). Ýòè ìîëåêóëû áóäóò îáúåäèíÿòüñÿ â êàïåëüêè âîäû. Ïðè ýòîì, ïðè êàæäîì ïðèñîåäèíåíèè î÷åðåäíîé ìîëåêóëû ê äðóãèì, áóäóò èçëó÷àòüñÿ òåïëîâûå ôîòîíû (ñêðûòàÿ òåïëîòà ïëàâëåíèÿ è êîíäåíñàöèè).
Òàêèì îáðàçîì, ñòîëêíóâøèñü, îõëàæä¸ííûå ìîëåêóëû, ïîä äåéñòâèåì ãðàâèòàöèè ñëèïàþòñÿ, ïðåâðàùàÿñü â êàïåëüêè âîäû (êîíäåíñèðóþòñÿ).
Ðèñ. 16 Ðèñ. 17
Îôèöèàëüíàÿ íàóêà ýòè ýôôåêòû îáúÿñíèòü íå ìîæåò.
Ïî ñðàâíåíèþ ñ òâ¸ðäûìè âåùåñòâàìè, â æèäêîñòÿõ ìîëåêóëÿðíàÿ ñâÿçü îñëàáëåíà. Ïîëîæåíèå àòîìîâ (ìîëåêóë) â æèäêîñòÿõ äðóã îòíîñèòåëüíî äðóãà èçìåíÿåòñÿ. Ïðè íàãðåâàíèè æèäêîñòè òàêæå óâåëè÷èâàþòñÿ ðàçìåðû àòîìîâ (ìîëåêóë), îñëàáëÿÿ ìîëåêóëÿðíîå âçàèìîäåéñòâèå (âÿçêîñòü).
Íàèáîëåå ïðîñòûì ÿâëÿåòñÿ ãàçîîáðàçíîå ñîñòîÿíèå âåùåñòâà. Ãàç ìîæíî ïðåäñòàâèòü ñåáå â âèäå îòäåëüíûõ ëåòàþùèõ ïî âñåì íàïðàâëåíèÿì ìîëåêóë. Ñîãëàñíî çàêîíó Àâîãàäðî ïðè äàâëåíèè 1àòì. è òåìïåðàòóðå 20 ãðàäóñîâ Öåëüñèÿ, àòîìû è ìîëåêóëû îäíîãî ãðàìì-ìîëÿ ãàçà ñòàðàþòñÿ çàïîëíèòü îáú¸ì 22,4 ë. Ýòî ñîîòâåòñòâóåò äåñÿòèêðàòíîìó ðàññòîÿíèþ ìåæäó ìîëåêóëàìè, â ñðàâíåíèè ñ èõ ðàçìåðàìè. Ïðè ñòîëêíîâåíèè îíè âåäóò ñåáÿ êàê óïðóãèå øàðèêè. Ñðåäíåå ðàññòîÿíèå ìåæäó ìîëåêóëàìè ãàçà ïðè íîðìàëüíîì àòìîñôåðíîì äàâëåíèè áîëåå ÷åì â 10 ðàç ïðåâîñõîäèò äèàìåòð ñàìèõ ìîëåêóë. Íà òàêèõ ðàññòîÿíèÿõ ìîëåêóëÿðíîå âçàèìîäåéñòâèå ñåáÿ íå ïðîÿâëÿåò. Äèôôóçèÿ â ãàçàõ ïðîèñõîäèò î÷åíü èíòåíñèâíî. Ãàç ñòðåìèòñÿ çàíÿòü âåñü ïðåäîñòàâëåííûé åìó îáú¸ì, íàïðèìåð, ñîñóäà, â êîòîðîì îí íàõîäèòñÿ. Îäíàêî, ãàç ìîæåò ñîõðàíÿòü îáú¸ì è ôîðìó, íàõîäÿñü è âíå ñîñóäà.  ìåæçâ¸çäíîì ïðîñòðàíñòâå èìåþòñÿ ìíîãî÷èñëåííûå ãàçîâûå îáëàêà. Ïðè íàáëþäåíèÿõ â òåëåñêîï îíè ïðåäñòàâëÿþòñÿ òóìàííîñòÿìè. Èõ ïëîòíîñòü â òûñÿ÷ó ðàç ïðåâîñõîäèò ïëîòíîñòü îêðóæàþùåé ñðåäû.  ãàçîîáðàçíîì ñîñòîÿíèè íàõîäÿòñÿ Ñîëíöå è çâ¸çäû. Îáú¸ì è ôîðìà áîëüøèíñòâà ýòèõ îáúåêòîâ íà ïðîòÿæåíèè ìíîãèõ ìèëëèîíîâ ëåò îñòàþòñÿ ïîñòîÿííûìè. Íàøà Çåìëÿ èìååò ãàçîâóþ îáîëî÷êó àòìîñôåðó, îáú¸ì êîòîðîé òîæå ìîæíî ñ÷èòàòü ïîñòîÿííûì. Âî âñåõ ýòèõ ñëó÷àÿõ ðàññåèâàíèþ ãàçà ïðåïÿòñòâóåò ëèøü ñèëà òÿãîòåíèÿ. Òàêèì îáðàçîì, ãàç ýòî ñîñòîÿíèå âåùåñòâà, êîãäà ìîëåêóëÿðíîå âçàèìîäåéñòâèå îòñóòñòâóåò.
Ïî õàðàêòåðó âçàèìîäåéñòâèÿ ìåæäó àòîìàìè (ìîëåêóëàìè), íàïðèìåð, ðàñïîëîæåííûõ â óçëàõ êðèñòàëëè÷åñêîé ðåø¸òêè, ðàçëè÷àþò ÷åòûðå òèïà ñâÿçè: ìîëåêóëÿðíóþ, èîííóþ, àòîìíóþ è ìåòàëëè÷åñêóþ. Îäíàêî àòîìû è ìîëåêóëû íåéòðàëüíû è ïîýòîìó íèêàêèõ ýëåêòðè÷åñêèõ ñâÿçåé ìåæäó íèìè, áûòü íå ìîæåò. Ýëåêòðè÷åñêèå ñâÿçè ìîãóò áûòü òîëüêî âíóòðè ìîëåêóë. Ýòî õèìè÷åñêèå ñâÿçè. Åù¸ ðàç ïîâòîðÿþ, âçàèìîäåéñòâèå ìåæäó àòîìàìè è ìîëåêóëàìè òîëüêî ãðàâèòàöèîííîå. Âñå îñòàëüíûå îáúÿñíåíèÿ îøèáî÷íûå, à ïðèäóìàíû îíè ñïåöèàëüíî äëÿ çàïóòûâàíèÿ è îäóðà÷èâàíèÿ.
ÓÏÐÓÃÎÑÒÜ. Ìîëåêóëÿðíûì âçàèìîäåéñòâèåì îáúÿñíÿþòñÿ ìíîãèå ÿâëåíèÿ, íàïðèìåð, óïðóãîñòü.  òâ¸ðäûõ òåëàõ àòîìû ðàñïîëàãàþòñÿ ñòðîãî â îïðåäåë¸ííîì ïîðÿäêå, â âèäå êðèñòàëëè÷åñêîé ðåø¸òêè è óäåðæèâàþòñÿ ìåæäó ñîáîé íåïðåðûâíûì äåéñòâèåì ýôèðà. Ó íåêîòîðûõ âåùåñòâ êðèñòàëëè÷åñêàÿ ðåø¸òêà ïîñëå å¸ äåôîðìàöèè ìîæåò âîññòàíîâèòü ñâî¸ ïðåæíåå ñîñòîÿíèå, êîòîðîå õàðàêòåðèçóåòñÿ ìèíèìàëüíûìè (îïòèìàëüíûìè) ðàçìåðàìè ìåæäó àòîìàìè. Èòàê, ýôèð ñòàðàåòñÿ óäåðæèâàòü àòîìû êðèñòàëëè÷åñêîé ðåø¸òêè â å¸ îïòèìàëüíîì ñîñòîÿíèè. Èíåðöèè, äåôîðìèðóþùåé êðèñòàëëè÷åñêóþ ðåø¸òêó, ïðîòèâîäåéñòâóåò èíåðöèÿ ìîëåêóëÿðíîãî âçàèìîäåéñòâèÿ, ñîçäàâàåìàÿ ýôèðîì. Ïîñëå ïðåêðàùåíèÿ äåéñòâèÿ èíåðöèè äåôîðìàöèè, èíåðöèÿ ìîëåêóëÿðíîãî âçàèìîäåéñòâèÿ âîçâðàòèò àòîìû êðèñòàëëè÷åñêîé ðåø¸òêè â ñâî¸ ïðåæíåå îïòèìàëüíîå ñîñòîÿíèå. Òàêîé ýôôåêò íàçûâàåòñÿ óïðóãîñòüþ.
 ïîäàâëÿþùåì áîëüøèíñòâå ñëó÷àåâ òâ¸ðäîå ñîñòîÿíèå âåùåñòâà ïëîòíåå æèäêîãî. Îäíàêî ñóùåñòâóåò íåáîëüøàÿ ãðóïïà âåùåñòâ (âîäà, ÷óãóí, âèñìóò, ãàëëèé, ñóðüìà è äð.), ïëîòíîñòü êîòîðûõ â êðèñòàëëè÷åñêîì ñîñòîÿíèè ìåíüøå, ÷åì â æèäêîì [7]. Òàêîå àíîìàëüíîå ñâîéñòâî îáúÿñíÿåòñÿ ñâîåîáðàçíûì ñòðîåíèåì èõ êðèñòàëëè÷åñêîé ðåø¸òêè.
© Copyright: Ñåìåí Íèêîëàåâ, 2016
Ñâèäåòåëüñòâî î ïóáëèêàöèè ¹216042001427
Источник
Учебник по физике
10 класс
- Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без такого взаимодействия не было бы ни жидких, ни твердых тел.
Молекулярные силы
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул.
Существование сил притяжения между атомами может доказать такой наглядный опыт. Надо взять два свинцовых бруска и острым ножом срезать тонкие слои с их торцов. При достаточном навыке срезы получаются гладкими и чистыми, свободными от оксидов свинца. Если плотно прижать бруски друг к другу свежими срезами, то они слипнутся. После этого можно один из брусков нагрузить гирей в несколько килограммов, но разрыва брусков не произойдет. Силы притяжения между атомами оказываются достаточными, чтобы предотвратить разрыв.
Если бы между молекулами не существовало сил притяжения, то вещество при любых условиях находилось бы в газообразном состоянии. Только благодаря силам притяжения молекулы могут удерживаться около друг друга и образовывать жидкие и твердые тела.
Но кроме сил притяжения между молекулами должны действовать силы отталкивания. В том, что между атомами или молекулами при непосредственном их сближении появляются силы отталкивания, убедиться очень просто. Если бы таких сил не существовало, то вы свободно могли бы проткнуть пальцем толстую стальную плиту. Более того, без появления сил отталкивания на очень малых расстояниях между молекулами вещество не могло бы существовать. Молекулы проникли бы друг в друга, и весь кусок вещества сжался бы до объема одной молекулы.
Представления о существенной роли межмолекулярных сил для описания свойств газов впервые ввел нидерландский физик Я. Д. Ван-дер-Ваальс (1837—1923). Он не пытался установить точную зависимость сил от расстояния. Ван-дер-Ваальс считал, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения, сравнительно медленно убывающими при дальнейшем увеличении расстояния. Силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми силами.
Электромагнитная природа молекулярных сил
Приступить к теоретическому исследованию молекулярных сил до начала XX в. было почти невозможно. Простые и хорошо изученные гравитационные силы при взаимодействии столь малых тел, как молекулы, явно не могли играть заметной роли. Оставалось предположить, что молекулярные силы имеют электромагнитную природу.
Любой атом и тем более молекула — это сложная система, состоящая из большого числа заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними действуют значительные электрические силы: происходит взаимодействие между электронами и ядрами соседних молекул. Описание движения частиц внутри атомов и молекул — очень сложная задача. Ее рассматривают в атомной физике и решают с помощью законов квантовой механики. Мы ограничимся качественным рассмотрением межмолекулярных сил различных типов и потом приведем конечный результат: примерную зависимость сил взаимодействия двух молекул от расстояния между ними.
Ориентационные силы
У многих молекул, например у молекулы воды, распределение положительных и отрицательных зарядов таково, что в среднем центры этих зарядов не совпадают. Такую молекулу приближенно можно рассматривать как совокупность двух точечных зарядов +q и -q на небольшом расстоянии l друг от друга (рис. 2.7). Эта система зарядов называется электрическим диполем(1). Электрические свойства такой молекулы характеризуются дипольным моментом

где q — абсолютное значение заряда.
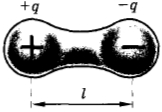
Рис. 2.7
Рассчитывать значения дипольных моментов молекул на первых порах не умели. До создания квантовой механики это вообще было невозможно.
Но если считать дипольные моменты р1 и р2 двух молекул известными, то зависимость силы взаимодействия между ними от расстояния можно вычислить.
Для этого нужно только знать закон взаимодействия двух точечных электрических зарядов. Этот закон (закон Кулона) уже давно был известен. Сила притяжения двух диполей максимальна, когда они располагаются вдоль одной линии (рис. 2.8). Эта сила возникает из-за того, что расстояние между разноименными зарядами, находящимися в точках 2 и 3, чуть меньше, чем между одноименными, расположенными в точках 1, З и 2, 4.
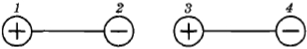
Рис. 2.8
Сила взаимодействия диполей зависит от их взаимной ориентации. Поэтому она называется ориентационной. Хаотическое тепловое движение непрерывно меняет ориентацию молекул-диполей. Учитывая это, силу взаимодействия диполей нужно вычислять как среднюю по всевозможным ориентациям. Расчеты приводят к следующему результату: сила притяжения пропорциональна произведению дипольных моментов р1 и р2 молекул и обратно пропорциональна расстоянию между ними в седьмой степени:

Это очень быстрое убывание по сравнению с силой взаимодействия точечных заряженных частиц, которая пропорциональна 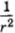 .
.
Индукционные (поляризационные) силы
Можно указать еще одно достаточно простое взаимодействие молекул. Оно возникает между двумя молекулами, одна из которых обладает дипольным моментом, а другая — нет.
Дипольная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределенными по объему. Положительные заряды смещаются по направлению линий напряженности электрического поля, а отрицательные — против. В результате неполярная молекула растягивается (поляризуется) и у нее возникает дипольный момент (рис. 2.9).

Рис. 2.9
Силу взаимодействия можно рассчитать и в этом случае. Она пропорциональна дипольному моменту р полярной молекулы, некоторой величине α, характеризующей способность неполярной молекулы поляризоваться (она называется поляризуемостью), и обратно пропорциональна седьмой степени расстояния между молекулами:

Эти силы притяжения называются индукционными или поляризационными, так как они возникают благодаря поляризации молекул, вызванной электростатической индукцией.
Дисперсионные силы
Хорошо известно, что силы притяжения существуют и между неполярными молекулами. Например, атомы инертных газов не имеют дипольного момента, но тем не менее притягиваются друг к другу.
Качественно и очень приближенно появление этих сил можно объяснить так. В атомах и молекулах электроны каким-то сложным образом движутся вокруг ядер, и в среднем по времени дипольные моменты молекул могут оказаться равными нулю. Но в каждый момент времени электроны занимают какое-то определенное положение. Поэтому мгновенное значение дипольного момента отлично от нуля. Такой «мгновенный» диполь создает поле, поляризующее соседние неполярные атомы. Из-за этого «мгновенные» диполи начинают взаимодействовать друг с другом. Полная сила взаимодействия между неполярными молекулами есть средний результат взаимодействия всевозможных «мгновенных» диполей.
Расчет, выполненный в рамках квантовой механики, приводит к выводу, что сила взаимодействия в этом случае пропорциональна произведению поляризуемостей молекул α1 и α2 и обратно пропорциональна седьмой степени расстояния:

Эти силы называются дисперсионными, потому что дисперсия света (зависимость показателя преломления света от частоты) определяется теми же свойствами молекул, что и рассмотренные силы.
Дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их проявления не зависит от того, есть ли у них постоянные дипольные моменты или нет. Обычно эти силы превосходят как ориентационные, так и индукционные силы. Только при взаимодействии молекул с большими дипольными моментами, например молекул воды, ориентационная сила оказывается больше дисперсионной (для молекул воды в 3 раза). При взаимодействии же таких полярных молекул, как СО, НСl, дисперсионные силы в десятки и сотни раз превосходят другие силы.
Существенно, что все три типа сил притяжения одинаковым образом убывают с расстоянием пропорционально 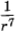 . Впрочем, на расстояниях, в несколько раз больших размеров молекул, начинает сказываться конечность скорости распространения электромагнитных взаимодействий. Из-за этого на расстояниях порядка 10-5 см силы притяжения начинают убывать уже
. Впрочем, на расстояниях, в несколько раз больших размеров молекул, начинает сказываться конечность скорости распространения электромагнитных взаимодействий. Из-за этого на расстояниях порядка 10-5 см силы притяжения начинают убывать уже 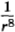 .
.
Силы отталкивания
Теперь обратим внимание на силы отталкивания, действующие между молекулами на очень малых расстояниях. С одной стороны, ситуация здесь проще, а с другой — сложнее. Проще в том смысле, что эти силы очень быстро возрастают при сближении молекул, и поэтому та или иная быстрота изменения силы с расстоянием не оказывает заметного влияния на течение любых процессов.
Сложность состоит в том, что силы отталкивания в значительно большей мере, чем силы притяжения, зависят от индивидуальности молекул. Зная, как молекула А отталкивает молекулы В и С, мы еще не в состоянии судить, какие силы отталкивания будут действовать между молекулами В и С. При непосредственном сближении молекул их электронные оболочки начинают перекрываться и особенность строения молекул сказывается в большей степени, чем при больших расстояниях между ними.
К достаточно хорошим результатам приводит допущение, что силы отталкивания возрастают при сближении молекул по закону

Учитывая, что силы притяжения с уменьшением расстояния увеличиваются пропорционально 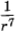 , а силы отталкивания — пропорционально
, а силы отталкивания — пропорционально 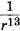 , можно примерную зависимость сил от расстояния изобразить графически.
, можно примерную зависимость сил от расстояния изобразить графически.
График зависимости молекулярных сил от расстояния между молекулами
Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция результирующей силы взаимодействия между ними на прямую, соединяющую центры молекул. Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия между ними практически не сказываются. Силы взаимодействия между молекулами короткодействующие.
На расстояниях, превышающих 2—3 диаметра молекул, сила отталкивания практически равна нулю. Заметна лишь сила притяжения. По мере уменьшения расстояния сила притяжения возрастает и одновременно начинает сказываться сила отталкивания. Эта сила очень быстро увеличивается, когда электронные оболочки молекул начинают перекрываться.
На рисунке 2.10 графически изображена зависимость проекции Fr силы взаимодействия молекул от расстояния между их центрами. На расстоянии г0, примерно равном сумме радиусов молекул, Fr = 0, так как сила притяжения равна по модулю силе отталкивания. При г > г0 между молекулами действует сила притяжения. Проекция силы, действующей на правую молекулу, отрицательна. При г < г0 действует сила отталкивания с положительным значением проекции Fr.
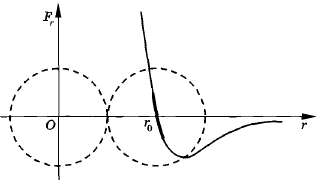
Рис. 2.10
Происхождение сил упругости
Зависимость сил взаимодействия молекул от расстояния между ними объясняет появление силы упругости при сжатии и растяжении тел. Если пытаться сблизить молекулы на расстояние, меньшее г0, то начинает действовать сила, препятствующая сближению. Наоборот, при удалении молекул друг от друга действует сила притяжения, возвращающая молекулы в исходные положения после прекращения внешнего воздействия.
При малом смещении молекул из положений равновесия силы притяжения или отталкивания растут линейно с увеличением смещения. На малом участке кривую можно считать отрезком прямой (утолщенный участок кривой на рис. 2.10). Именно поэтому при малых деформациях оказывается справедливым закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях молекул закон Гука уже несправедлив.
Так как при деформации тела изменяются расстояния между всеми молекулами, то на долю соседних слоев молекул приходится незначительная часть общей деформации. Поэтому закон Гука выполняется при деформациях, в миллионы раз превышающих размеры молекул.
Атомно-силовой микроскоп
На действии сил отталкивания между атомами и молекулами на малых расстояниях основано устройство атомно-силового микроскопа (АСМ). Этот микроскоп в отличие от туннельного позволяет получать изображения не проводящих электрический ток поверхностей. Вместо вольфрамового острия в АСМ используют маленький осколок алмаза, заостренный до атомных размеров. Этот осколок закрепляется на тонком металлическом держателе. При сближении острия с исследуемой поверхностью электронные облака атомов алмаза и поверхности начинают перекрываться и возникают силы отталкивания. Эти силы отклоняют кончик алмазного острия. Отклонение регистрируется с помощью лазерного луча, отражающегося от зеркальца, закрепленного на держателе. Отраженный луч приводит в действие пьезоэлектрический манипулятор, аналогичный манипулятору туннельного микроскопа. Механизм обратной связи обеспечивает такую высоту алмазной иглы над поверхностью, чтобы изгиб пластины держателя оставался неизменным.
На рисунке 2.11 вы видите изображение полимерных цепей аминокислоты аланина, полученное с помощью АСМ. Каждый бугорок представляет собой одну молекулу аминокислоты.

Рис. 2.11
В настоящее время сконструированы атомные микроскопы, устройство которых основано на действии молекулярных сил притяжения на расстояниях, в несколько раз превышающих размеры атома. Эти силы примерно в 1000 раз меньше сил отталкивания в АСМ. Поэтому применяется более сложная чувствительная система для регистрации сил.
Атомы и молекулы состоят из электрически заряженных частиц. Благодаря действию электрических сил на малых расстояниях молекулы притягиваются, но начинают отталкиваться, когда электронные оболочки атомов перекрываются.
(1) Подробнее об электрических диполях будет рассказано в дальнейшем.
Источник
