Какими свойствами обладают щелочные металлы
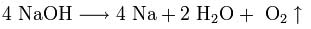
31 июля 2014
Автор
КакПросто!
Литий, натрий, калий, рубидий, цезий и франций – металлы главной подгруппы I группы в таблице элементов Д.И. Менделеева. Их называют щелочными, поскольку при взаимодействии с водой они образуют растворимые основания – щелочи.
Щелочные металлы – s-элементы. На внешнем электронном слое каждый из них имеет один электрон (ns1). Радиусы атомов сверху вниз в подгруппе увеличиваются, энергия ионизации уменьшается, восстановительная активность, как и способность отдавать валентные электроны с внешнего слоя, увеличивается.
Рассматриваемые металлы очень активны, поэтому в свободном состоянии они в природе не встречаются. Их можно обнаружить в виде соединений, в составе минералов (поваренной соли NaCl, сильвинита NaCl∙KCl, глауберовой соли NaSO4∙10H2O и других) или в виде ионов в морской воде.
Все щелочные металлы при обычных условиях представляют собой серебристо-белые кристаллические вещества, обладающие высокой тепло- и электропроводностью. Они имеют объемно-центрированную кубическую упаковку (ОЦКУ). Плотности, температуры кипения и плавления у металлов I группы относительно низкие. Сверху вниз в подгруппе плотности увеличиваются, а температуры плавления уменьшаются.
Щелочные металлы получают обычно электролизом расплавленных солей (чаще хлоридов) или щелочей. При электролизе расплава NaCl, к примеру, на катоде выделяется чистый натрий, а на аноде – газообразный хлор: 2NaCl(расплав)=2Na+Cl2↑.
По химическим свойствам литий, натрий, калий, рубидий, цезий и франций – это наиболее активные металлы и одни из самых сильных восстановителей. В реакциях они легко отдают электроны с внешнего слоя, превращаясь в положительно заряженные ионы. В образуемых щелочными металлами соединениях преобладает ионная связь.
При взаимодействии щелочных металлов с кислородом в качестве основного продукта образуются пероксиды, и в качестве побочного – оксиды:
2Na+O2=Na2O2 (пероксид натрия),
4Na+O2=2Na2O (оксид натрия).
С галогенами они дают галогениды, с серой – сульфиды, с водородом – гидриды:
2Na+Cl2=2NaCl (хлорид натрия),
2Na+S=Na2S (сульфид натрия),
2Na+H2=2NaH (гидрид натрия).
Гидрид натрия – неустойчивое соединение. Он разлагается водой, давая щелочь и свободный водород:
NaH+H2O=NaOH+H2↑.
Свободный водород и щелочь образуются также при взаимодействии с водой самих щелочных металлов:
2Na+2H2O=2NaOH+H2↑.
Эти металлы также взаимодействуют с разбавленными кислотами, вытесняя из них водород:
2Na+2HCl=2NaCl+H2↑.
С органическими галогенидами щелочные металлы взаимодействуют по реакции Вюрца:
2Na+2CH3Cl=C2H6+2NaCl.
Источник
Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCL) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод ((–)): 2Na++2e=2Na,
анод ((+)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
Источник
Щелочные металлы.
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Далее таблица свойств щелочных металлов:
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов: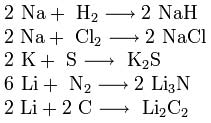
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Источник
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за
их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li – 2s1
- Na – 3s1
- K – 4s1
- Rb – 5s1
- Cs – 6s1
- Fr – 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl – галит (каменная соль)
- KCl – сильвит
- NaCl*KCl – сильвинит

Получение
Получить такие активные металлы электролизом водного раствора – невозможно. Для их получения применяют электролиз расплавов при
высоких температурах (естественно – безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид,
натрий – пероксид, калий, рубидий и цезий – супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления
+1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда – взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH – натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: “… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет”.
Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий – в желтый, калий – в фиолетовый, рубидий – синевато-красный,
цезий – синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
Li + O2 → Li2O (оксид лития)
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из
пероксида, так и из супероксида, при желании можно получить оксид:
Na2O2 + Na → Na2O
KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание – реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание – мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам – растворимым основаниям. Наиболее известные представители: NaOH – едкий натр, KOH – едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции
щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде – хлор)
Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
K + H2O → KOH + H2↑
Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется
газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке – получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке – получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 – получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 – получается средняя соль)
NaOH + MgBr2 → NaBr + Mg(OH)2↓
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием оксиелов –
смешанных оксидов (при высоких температурах – прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется оксиел – смесь двух оксидов: Al2O3
и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам – и азотной,
и азотистой.
LiOH + NO2 → LiNO2 + LiNO3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
